Nội dung bài giảng Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học giúp học sinh hệ thống hoá lại các kiến thức trong chương như: tính chất của phi kim, tính chất của clo,C, Si, CO, CO2, H2CO3, muối cacbonat. Cấu tạo bảng tuần hoàn và sự biến đổi tuần hoàn tính chất của các nguyên tố trong chu kì, nhóm và ý nghĩa của bảng tuần hoàn.
Tóm tắt lý thuyết
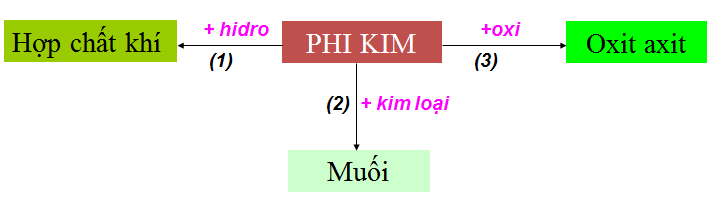
1.1. Tính chất hóa học của phi kim
Hình 1: Tính chất hóa học của phi kim
1.2. Tính chất hóa học của phi kim (cụ thể)
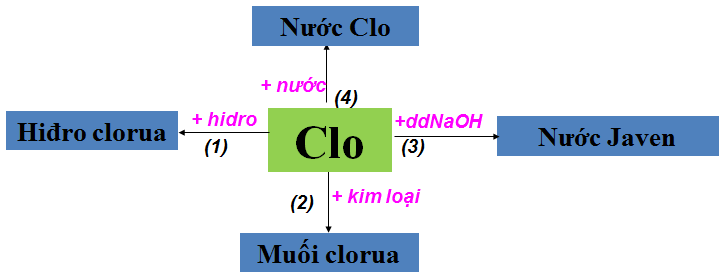
1.2.1. Tính chất hóa học của Clo
Hình 2: Tính chất hóa học của Clo
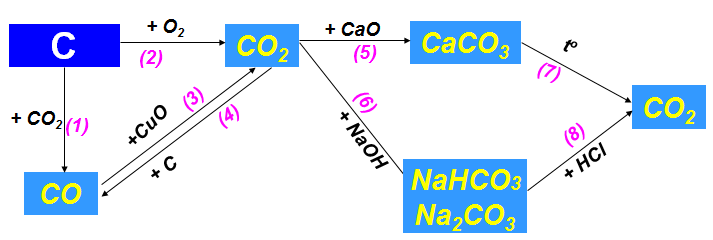
1.2.2. Tính chất hóa học của Cacbon và hợp chất của Cacbon
Hình 3: Tính chất hóa học của Cacbon và hợp chất của Cacbon
1.3. Bảng tuần hoàn các nguyên tố hóa học
1.3.1. Cấu tạo bảng tuần hoàn
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số e = vị trí
+ Ký hiệu hóa học
+ Tên nguyên tố
+ Nguyên tử khối
- Chu kì: Có 7 chu kì gồm chu kì nhỏ (1, 2, 3) và chu kì lớn (4, 5, 6, 7)
- Nhóm: Có 8 nhóm
1.3.2. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ đi từ trái sang phải tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm đi từ trên xuống tính kim loại của các nguyên tố tăng dần, tính phi kim của các nguyên tố giảm dần.
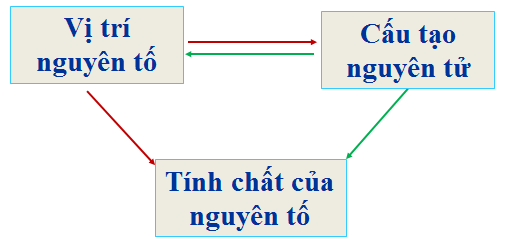
1.3.3. Ý nghĩa của bảng tuần hoàn
- Biết vị trí của nguyên tố → cấu tạo nguyên tử và tính chất của nguyên tố.
- Biết cấu tạo nguyên tử → vị trí và tính chất của nguyên tố.
Hình 4: Ý nghĩa của Bảng tuần hoàn
2. Luyện tập Bài 32 Hóa học 9
Sau bài học cần nắm:
- Tính chất hóa học của phi kim
- Bảng tuần hoàn các nguyên tố hóa học
2.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 32 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. SO2 , H2O, CO2 , P2O5
- B. SO3 , H2O, CO2 , P2O5
- C. SO2 , H2O, CO , P2O5
- D. SO3 , H2O, CO , P2O5
-
- A. S → SO2 →SO3 → H2SO4
- B. C → CO → CO2 → H2CO3
- C. P →P2O3 → P2O5 →H3PO3
- D. N2 → NO →N2O5 →HNO3
-
- A. KCl, H2O, K2O
- B. KCl, KClO, H2O
- C. KCl, KClO3, H2O
- D. KClO, KClO3, H2O
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
2.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 32.
Bài tập 1 trang 103 SGK Hóa học 9
Bài tập 2 trang 103 SGK Hóa học 9
Bài tập 3 trang 103 SGK Hóa học 9
Bài tập 4 trang 103 SGK Hóa học 9
Bài tập 5 trang 103 SGK Hóa học 9
Bài tập 6 trang 103 SGK Hóa học 9
Bài tập 32.1 trang 40 SBT Hóa học 9
Bài tập 32.2 trang 40 SBT Hóa học 9
Bài tập 32.3 trang 40 SBT Hóa học 9
Bài tập 32.4 trang 40 SBT Hóa học 9
Bài tập 32.5 trang 41 SBT Hóa học 9
Bài tập 32.6 trang 41 SBT Hóa học 9
Bài tập 32.7 trang 41 SBT Hóa học 9
Bài tập 32.8 trang 41 SBT Hóa học 9
Bài tập 32.9 trang 41 SBT Hóa học 9
Bài tập 32.10 trang 41 SBT Hóa học 9
Bài tập 32.11 trang 41 SBT Hóa học 9
Bài tập 32.12 trang 41 SBT Hóa học 9
Bài tập 32.13 trang 42 SBT Hóa học 9
Bài tập 32.14 trang 42 SBT Hóa học 9
Bài tập 32.15 trang 42 SBT Hóa học 9
Bài tập 32.16 trang 42 SBT Hóa học 9
Bài tập 32.17 trang 42 SBT Hóa học 9
Bài tập 32.18 trang 42 SBT Hóa học 9
Bài tập 32.19 trang 42 SBT Hóa học 9
Bài tập 32.20 trang 42 SBT Hóa học 9
Bài tập 32.21 trang 42 SBT Hóa học 9
Bài tập 32.22 trang 42 SBT Hóa học 9
3. Hỏi đáp về Bài 32 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.