Nội dung bài giảng Tính chất của phi kim tìm hiểu về một số tính chất vật lí của phi kim: Phi kim tồn tại ở 3 trạng thái rắn, lỏng, khí. Phần lớn các nguyên tố phi kim không dẫn điện, dẫn nhiệt, nhiệt độ nóng chảy thấp; Biết những tính chất hoá học chung của phi kim: Tác dụng với oxi, với kim loại và với hiđrô. (KTTT). Sơ lược về mức độ hoạt động hoá học mạnh yếu của 1 số phi kim.
Tóm tắt lý thuyết
1.1. Phi kim có những tính chất vật lí nào?
- Phi kim có thể tồn tại ở trạng thái:Thể rắn I2, S, C..., thể lỏng Br2, thể khí O2, Cl2...
- Không dẫn điện, không dẫn nhiệt, và có nhiệt độ nóng chảy thấp
1.2. Phi kim có những tính chất hoá học nào?
1.2.1. Tác dụng với kim loại
- Nhiều phi kim tác dụng với kim loại tạo thành muối
- Các em chú ý quan sát thao tác thí nghiệm, cũng như hiện tượng xảy ra như sau:
Video 1: Sắt tác dụng với khí Clo
- Hiện tượng: Sắt cháy sáng trong khí clo, xuất hiện chất màu nâu đỏ
- Giải thích: Do xảy ra phản ứng 2Fe + 3Cl2 .PNG)
- Ví dụ khác: Fe (trắng xám) + S (vàng) .PNG)
- Chú ý: Khi phi kim là Oxi thì Kim loại + Oxi tạo Oxit
- Ví dụ như: 2Cu + O2 .PNG)
1.2.2. Tác dụng với Hidro
- Oxi tác dụng với khí Hidro tạo thành nước: 2H2 + O2 .PNG)
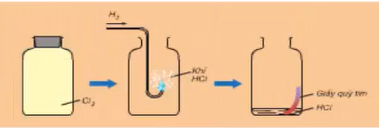
- Clo tác dụng với khí Hidro
Video 2: Phản ứng giữa H2 và Cl2
Hình 1: Khí Hidro cháy trong Clo
- Hiện tượng: Hiđro cháy trong khí Clo (màu vàng lục) tạo thành khí không màu. Màu vàng lục của clo biến mất, giấy quỳ hơi đỏ
- Giải thích:
+ Do xảy ra phản ứng: H2 + Cl2 .PNG)
(Thí nghiệm mô tả trong SGK có thêm một bước là sau phản ứng thêm ít nước vào trong lọ. Mục đích là để khí HCl hòa tan vào nước tạo thành dung dịch axit HCl. Thử môi trường tạo thành bằng quỳ tím. Thấy quỳ tím hóa đỏ, chứng tỏ là môi trường axit)
+ Ngoài ra, nhiều phi kim khác như C, S, Br,... tác dụng với Hidro tạo hợp chất khí.
1.2.3. Tác dụng với Oxi
S (vàng) + O2 .PNG)
Video 3: Phản ứng giữa lưu huỳnh và Oxi
4P (đỏ) +5 O2 .PNG)
Nhiều phi kim tác dụng với oxi tạo thành oxít axít
1.2.4. Mức độ hoạt động của phi kim
Mức độ hoạt động hoá học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro
Ví dụ:
- F,Cl, O là những phi kim mạnh
- S, P, C, Si là những phi kim yếu
Bài tập minh họa
Bài 1:
Cho các chất sau: Cl2, S, Cu, Mg.
Hướng dẫn:
a. Chất nào tác dụng với khí oxi tạo thành oxit axit là Lưu huỳnh (S)
S + O2 .PNG)
b. Chất nào tác dụng với khí oxi tạo thành oxit bazơ là Đồng (Cu), Magie (Mg)
2Cu + O2 .PNG)
2Mg + O2 .PNG)
c. Chất nào tác dụng với kim loại đồng tạo thành muối là Clo, lưu huỳnh
Cu + Cl2 .PNG)
Cu + S .PNG)
Bài 2:
Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (ở đktc) cần dùng là:
Hướng dẫn:
Fe + 1,5Cl2 → FeCl3
\(\Rightarrow n_{Cl_2}=1,5n_{Fe}=0,3\ mol\)
⇒ V = 6,72 lít
3. Luyện tập Bài 25 Hóa học 9
Sau bài học cần nắm:
- Phi kim có những tính chất vật lí nào?
- Phi kim có những tính chất hoá học nào?
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 25 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Kim loại
- B. Oxi
- C. Hiđro
- D. Phi kim khác
-
- A. Hiđro và clo
- B. Lưu huỳnh và oxi
- C. Hiđro và oxi
- D. Photpho và oxi
-
- A. Nhiều kim loại và phi kim
- B. Nhiều kim loại và hiđro
- C. Nhiều kim loại và oxi
- D. Nhiều kim loại và clo
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 25.
Bài tập 1 trang 76 SGK Hóa học 9
Bài tập 2 trang 76 SGK Hóa học 9
Bài tập 3 trang 76 SGK Hóa học 9
Bài tập 4 trang 76 SGK Hóa học 9
Bài tập 5 trang 76 SGK Hóa học 9
Bài tập 6 trang 76 SGK Hóa học 9
Bài tập 25.1 trang 30 SBT Hóa học 9
Bài tập 25.2 trang 30 SBT Hóa học 9
Bài tập 25.3 trang 30 SBT Hóa học 9
Bài tập 25.4 trang 30 SBT Hóa học 9
Bài tập 25.5 trang 30 SBT Hóa học 9
Bài tập 25.6 trang 30 SBT Hóa học 9
Bài tập 25.7 trang 31 SBT Hóa học 9
Bài tập 25.8 trang 31 SBT Hóa học 9
Bài tập 25.9 trang 31 SBT Hóa học 9
4. Hỏi đáp về Bài 25 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.