Bài giảng Clo đi sâu tìm hiểu về Tính chất vật lí của clo; Clo có một số tính chất chung của phi kim (tác dụng với kim loại, với hiđro), clo còn tác dụng với nước và dung dịch bazơ, clo là phi kim hoạt động mạnh; Phương pháp điều chế clo trong công nghiệp, trong phòng thí nghiệm; Một số ứng dụng, thu khí clo trong công nghiệp, trong phòng thí nghiệm.
Tóm tắt lý thuyết
1.1. Tính chất vật lí
Chất khí, màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí và tan được trong nước, clo là khí độc.
1.2. Tính chất hoá học
1.2.1. Clo có những tính chất của phi kim không?
Tác dụng với kim loại
- Phản ứng hóa học: 2Fe (trắng xám) + 3Cl2 .PNG)
Video 1: Phản ứng giữa Sắt và khí Clo
- Phản ứng hóa học: Cu +Cl2 .PNG)
Video 2: Phản ứng giữa Đồng và khí Clo
- Nhận xét: Clo phản ứng với hầu hết kim loại tạo thành muối clorua
Tác dụng với hiđro
- Phản ứng hóa học: Cl2 + H2 .PNG)
Video 3: Phản ứng giữa H2 và Cl2
- Kết luận: Clo có những tính chất hoá học của phi kim :tác dụng hầu hết kim loại tạo thành muối clorua,tác dụng với hiđro tạo thành hiđroclorua .Clo là phi kim hoạt động hoá học mạnh
1.2.2. Clo còn có tính chất hoá học nào khác?
Tác dụng với nước
- Phương trình phản ứng: Cl2 + H2O \(\leftrightarrows\) HClO + HCl
Video 4: Phản ứng giữa khí Clo và nước
- Nhận xét: Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO
Tác dụng với dd NaOH
Cl2 (vàng lục) +NaOH \(\leftrightarrows\) NaClO (không màu) + NaCl (không màu) +H2O
Dung dịch hỗn hợp hai muối Natri clorua (NaCl) và Natri hipoclorit (NaClO) gọi là hỗn hợp nước Javen. Dung dịch này có tính tẩy màu tương tự HCl và HClO là chất oxi hóa mạnh.
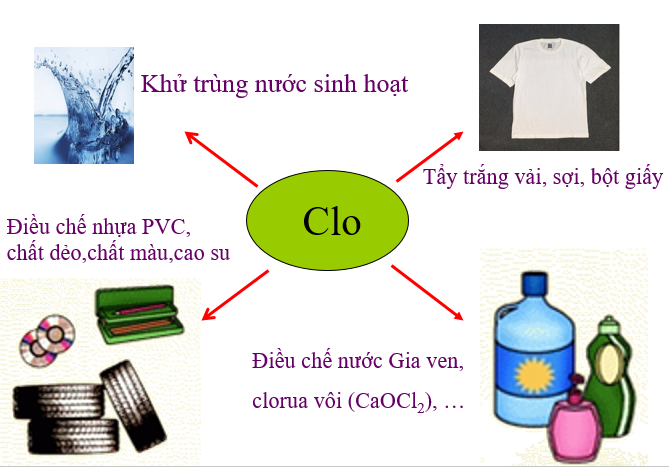
1.3. Ứng dụng của Clo
- Khử trùng nước sinh hoạt.
- Tẩy trắng vải sợi, bột giấy.
- Điều chế nhựa PVC, chất dẻo, chất màu, cao su.
- Điều chế nước giaven, clorua vôi
Hình 1: Ứng dụng của Clo
1.4. Điều chế khí Clo
1.4.1. Điều chế khí Clo trong phòng thí nghiệm
Hình 2: Điều chế Clo trong phòng thí nghiệm
- Phương pháp điều chế: 4HCl+MnO2 (đun nhẹ) → MnCl2+Cl2+2H2O
- Khí Clo có màu vàng lục, mùi hắc thoát ra
- Khi thu khí để bình đứng vì khí clo có M = 71 > không khí (29) nên nặng hơn không khí. Không thể thu khí bằng cách đẩy nước vì khí Clo tác dụng với nước tạo dung dịch axit.
- H2SO4 có tính háo nước nên sử dụng để hút ẩm, vì clo có phản ứng với nước
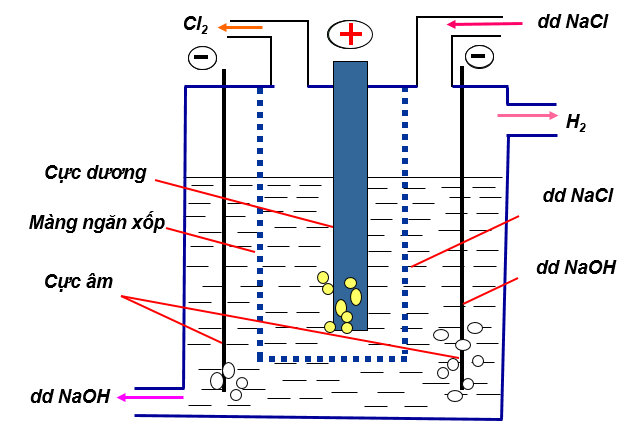
1.4.2. Điều chế Clo trong công nghiệp
Hình 3: Sơ đồ điện phân NaCl điều chế Clo
- Phương trình hóa học: 2NaCl+2H2O (điện phân có màng ngăn) → Cl2 + H2 +2NaOH
- Khí Clo thu ở cực dương, khí Hidro thu ở cực âm, dung dịch NaOH
Bài tập minh họa
Bài 1:
Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 ở đkc?
Hướng dẫn:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
\(\Rightarrow n_{Cl_2}=n_{MnO_2}=0,6\ mol\)
⇒ V = 13,44 lít
3. Luyện tập Bài 26 Hóa học 9
Sau bài học cần nắm:
- Tính chất vật lí của clo
- Clo có một số tính chất chung của phi kim (tác dụng với kim loại, với hiđro), clo còn tác dụng với nước và dung dịch bazơ, clo là phi kim hoạt động mạnh
- Phương pháp điều chế clo trong công nghiệp, trong phòng thí nghiệm
- Một số ứng dụng, thu khí clo trong công nghiệp, trong phòng thí nghiệm.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 26 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Photpho
- B. hiđro
- C. Clo
- D. Lưu huỳnh
-
- A. Photpho
- B. Hiđro
- C. Clo
- D. Lưu huỳnh
-
- A. Sắt
- B. Đồng
- C. Hidro
- D. Natri hidroxit
-
- A. Săt (II) clorua
- B. Đồng clorua
- C. canxi clorua
- D. Magiê clorua
-
- A. Tác dụng với kim loại và hiđro
- B. Tác dụng với kim loại và nước
- C. Tác dụng với hiđro và dung dịch Natri hiđroxit
- D. Tác dụng với nước và dung dịch Natri hiđroxit
-
- A. Zn.
- B. Cu.
- C. Ag.
- D. Fe.
-
- A. 8,96 lít.
- B. 3,36 lít.
- C. 6,72 lít.
- D. 2,24 lít.
Câu 8-20: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 26.
Bài tập 1 trang 81 SGK Hóa học 9
Bài tập 2 trang 81 SGK Hóa học 9
Bài tập 3 trang 81 SGK Hóa học 9
Bài tập 4 trang 81 SGK Hóa học 9
Bài tập 5 trang 81 SGK Hóa học 9
Bài tập 6 trang 81 SGK Hóa học 9
Bài tập 7 trang 81 SGK Hóa học 9
Bài tập 8 trang 81 SGK Hóa học 9
Bài tập 9 trang 81 SGK Hóa học 9
Bài tập 10 trang 81 SGK Hóa học 9
Bài tập 11 trang 81 SGK Hóa học 9
Bài tập 26.1 trang 31 SBT Hóa học 9
Bài tập 26.2 trang 31 SBT Hóa học 9
Bài tập 26.3 trang 31 SBT Hóa học 9
Bài tập 26.4 trang 31 SBT Hóa học 9
Bài tập 26.5 trang 31 SBT Hóa học 9
Bài tập 26.6 trang 32 SBT Hóa học 9
Bài tập 26.7 trang 32 SBT Hóa học 9
Bài tập 26.8 trang 32 SBT Hóa học 9
Bài tập 26.9 trang 32 SBT Hóa học 9
Bài tập 26.10 trang 32 SBT Hóa học 9
Bài tập 26.11 trang 32 SBT Hóa học 9
Bài tập 26.12 trang 32 SBT Hóa học 9
Bài tập 26.13 trang 32 SBT Hóa học 9
Bài tập 26.14 trang 32 SBT Hóa học 9
Bài tập 26.15 trang 32 SBT Hóa học 9
Bài tập 26.16 trang 33 SBT Hóa học 9
4. Hỏi đáp về Bài 26 chương 3 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.





.PNG)