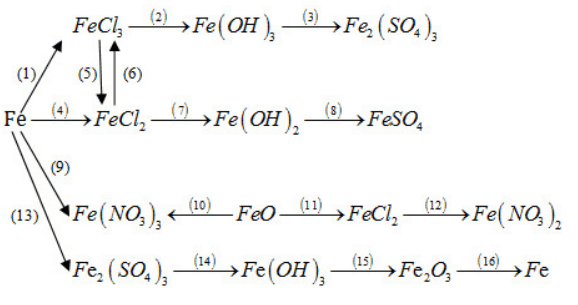Hướng dẫn giải bài tập SGK Hoá học 12 Bài 37 Luyện tập Tính chất hóa học của sắt và hợp chất của sắt giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức môn hoá.
-
Bài tập 1 trang 165 SGK Hóa học 12
Điền công thức hóa học của chất vào những chỗ trống và lập các phương trình hóa học sau:
a) Fe + H2SO4 (đặc) → SO2 + …
b) Fe + HNO3 (đặc) → NO2 + …
c) Fe + HNO3 (loãng) → NO + …
d) FeS2 + HNO3 → NO + Fe2(SO4)3 + …
-
Bài tập 2 trang 165 SGK Hóa học 12
Bằng phương pháp hóa học, hãy phân biệt ba mẫu hợp kim sau:
Al - Fe; Al - Cu và Cu - Fe.
-
Bài tập 3 trang 165 SGK Hóa học 12
Một hỗn hợp gồm Al,Fe,Cu. Hãy trình bày phương pháp hóa học để tách riêng từng kim loại trong hỗn hợp đó. Viết phương trình hóa học của các phản ứng?
-
Bài tập 4 trang 165 SGK Hóa học 12
Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch H2SO4 loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch CuSO4 thì thu được chất rắn. Tính khối lượng bột sắt đã dùng và khối lượng chất rắn thu được?
- VIDEOYOMEDIA
-
Bài tập 5 trang 165 SGK Hóa học 12
Biết 2,3 gam hỗn hợp gồm MgO, CuO, FeO tác dụng vừa đủ với 100ml dung dịch H2SO4 0,2M. Khối lượng muối thu được là:
A. 3,6 gam.
B. 3,7 gam.
C. 3,8 gam.
D. 3,9 gam.
-
Bài tập 6 trang 165 SGK Hóa học 12
Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron và electron là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tố X là:
A. Sắt.
B. Brom.
C. Photpho.
D. Crom.
-
Bài tập 1 trang 222 SGK Hóa 12 Nâng cao
Cho phương trình hóa học: 2Cr + 3Sn2+ → 2Cr3+ + 3Sn
Câu nào diễn tả đúng vai trò các chất?
A. Cr là chất oxi hóa, Sn2+ là chất khử
B. Cr là chất khử, Sn2+ là chất oxi hóa
C. Sn2+ là chất khử, Cr3+ là chất oxi hóa
D. Cr3+ là chất khử, Zn2+ là chất oxi hóa
-
Bài tập 2 trang 222 SGK Hóa 12 Nâng cao
Kim loại trong cặp oxi hóa khử nào sau đây có thể phản ứng với ion Ni2+ trong Ni2+/Ni?
A. Pb2+/Pb
B. Cu2+/Cu
C. Sn2+/Sn
D. Cr3+/Cr
-
Bài tập 3 trang 222 SGK Hóa 12 Nâng cao
Trong phản ứng Fe + H2SO4 \(\xrightarrow[ \ ]{ \ t^0 }\) Fe2(SO4)3 + H2O + SO2 có bao nhiêu nguyên tử Fe bị oxi hóa và bao nhiêu nguyên tử H2SO4 bị khử?
A. 2 và 3
B. 1 và 1
C. 3 và 2
D. 2 và 6
-
Bài tập 4 trang 222 SGK Hóa 12 Nâng cao
Viết phương trình hóa học cho những chuyển đổi sau:
.jpg)
.jpg)
-
Bài tập 5 trang 222 SGK Hóa học 12 nâng cao
Sự ăn mòn sắt, thép là một quá trình oxi hóa – khử.
a. Giải thích và viết phương trình hóa học của phản ứng xảy ra khi sắt thép bị ăn mòn.
b. Kẽm hoặc thiếc tráng ngoài vật bằng sắt, thép có tác dụng bảo vệ chống ăn mòn. Hãy giải thích một thực tế là sau một thời gian sử dụng thì vật được tráng bằng kẽm lại có hiệu quả bảo vệ tốt hơn
c. Vì sao thiếc lại được dùng nhiều hơn kẽm để bảo vệ những đồ hộp đựng thực phẩm. Còn lại kẽm lại được dùng nhiều hơn để bảo vệ ống dẫn nước, xô, chậu...?
-
Bài tập 6 trang 223 SGK Hóa 12 Nâng cao
a. Từ Fe hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4. Viết các phương trình hóa học.
b. Từ hỗn hợp Ag và Cu, hãy tình bày 3 phương pháp hóa học tách riêng Ag và Cu. Viết các phương trình hóa học.
-
Bài tập 7 trang 223 SGK Hóa 12 Nâng cao
Có 3 lọ, mỗi lọ đựng một trong 3 hỗn hợp sau: Fe và FeO; Fe và Fe2O3; FeO và Fe2O3. Hãy dẫn ra cách nhận biết hỗn hợp chất đựng trong mỗi lọ bằng phương pháp hóa học và viết các phương trình hóa học.
-
Bài tập 8 trang 223 SGK Hóa 12 Nâng cao
Khử 2,4 gam hỗn hợp CuO và một oxit sắt có tỉ lệ mol 1:1. Sau phản ứng thu được 1,76 gam chất rắn, đem hòa tan vào dung dịch HCl dư thấy thoát ra 0,448 lit khí (đktc). Xác định công thức của oxit sắt.
-
Bài tập 9 trang 223 SGK Hóa 12 Nâng cao
Dung dịch A là FeSO4 có lẫn tạp chất Fe2(SO4)3. Để xác định nồng độ mol của mỗi chất trong dung dịch A, người ta tiến hành những thí nghiệm sau:
Thí nghiệm 1: Thêm dần dần dung dịch NaOH vào 200ml dung dịch A cho đến dư, đun nóng. Lọc lấy kết tủa, nung ở nhiệt độ cao đến khi khối lượng không đổi, được chất rắn duy nhất có khối lượng 1,2 gam.
Thí nghiệm 2: Thêm vài giọt dung dịch H2SO4 vào 20 ml dung dịch A, rồi nhỏ dần dần từng giọt dung dịch KMnO4 vào dung dịch trên lắc nhẹ. Khi đun nóng dung dịch có màu hồng thì ngừng thí nghiệm, người ta đã dùng hết 10ml dung dịch KMnO4 0,2M.
a. Giải thích quá trình thì nghiệm và viết các phương trình hóa học.
b. Tính nồng độ mol của mỗi chất có trogn dung dịch A ban đầu.
c. Bằng phương pháp hóa học nào có thể loại bỏ được tạp chất trong dung dịch A ban đầu. Viết phương tình hóa học của phản ứng đã dùng.
-
Bài tập 37.1 trang 90 SBT Hóa học 12
Để bảo quản dung dịch FeSO4 trong phòng thí nghiêm, người ta ngâm vào dung dịch đó một đinh sắt đã làm sạch. Chọn cách giải thích đúng cho việc làm trên.
A. Để Fe tác dụng hết với H2SO4 dư khi điều chế FeSO4 bằng phản ứng :
Fe + H2SO4 (loãng) → FeSO4 + H2↑
B. Để Fe tác dụng với các tạp chất trong dung dịch, chẳng hạn với tạp chất là CuSO4 :
Fe + CuSO4 → FeSO4 + Cu
C. Để sắt tác dụng hết O2 hoà tan :
2Fe + O2 → 2FeO
D. Để sắt khử muối sắt(III) thành muối sắt(II) :
Fe + Fe2(SO4)3 → 3FeSO4
-
Bài tập 37.2 trang 90 SBT Hóa học 12
Cho hai phương trình hoá học sau :
Cu + 2FeCl3 → 2FeCl2 + CuCl2
Fe + CuCl2 → FeCl2 + Cu
Có thể rút ra kết luận nào sau đây
A. Tính oxi hoá : Fe3+ > Cu2+ > Fe2+.
B. Tính oxi hoá : Fe2+ > Cu2+ > Fe3+.
C. Tính khử : Fe > Fe2+ > Cu.
D. Tính khử : Fe2+ > Fe > Cu.
-
Bài tập 37.3 trang 90 SBT Hóa học 12
Nhúng thanh sắt (đã đánh sạch) vào các dung dịch ở ba thí nghiệm sau :
Thí nghiệm 1: nhúng vào dung dịch CuSO4.
Thí nghiệm 2: nhúng vào dung dịch NaOH.
Thí nghiệm 3: nhúng vào dung dịch Fe2(SO4)3.
Giả sử rằng các kim loại sinh ra (nếu có) đều bám vào thanh sắt thì nhận xét nào sau đây đúng ?
A. Ở thí nghiệm 1, khối lượng thanh sắt giảm.
B. Ở thí nghiệm 2, khối lượng thanh sắt không đổi.
C. Ớ thí nghiệm 3, khối lượng thanh sắt không đổi.
D. A, B, C đều đúng.
-
Bài tập 37.4 trang 91 SBT Hóa học 12
Cho khí CO khử hoàn toàn 10 g quặng hematit. Lượng sắt thu được cho tác dụng hết với dung dịch H2SO4 loãng thu được 2,24 lít H2 (đktc). Phần trăm khối lượng của Fe2O3 trong quặng là
A. 70%.
B. 75%.
C. 80%.
D. 85%.
-
Bài tập 37.5 trang 91 SBT Hóa học 12
Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc, nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, thu được
A. 0,03 mol Fe2(SO4)3 và 0,06 mol FeSO4
B. 0,05 mol Fe2(SO4)3 0,02 mol Fe dư.
C. 0,02 mol Fe2(SO4)3 và 0,08 mol FeSO4.
D. 0,12 mol FeSO4.
-
Bài tập 37.6 trang 91 SBT Hóa học 12
Cho khí CO khử hoàn toàn đến Fe một hỗn hợp gồm: FeO, Fe2O3, Fe3O4 thấy có 4,48 lít CO2 (đktc) thoát ra. Thể tích CO (đktc) đã tham gia phản ứng là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
-
Bài tập 37.7 trang 91 SBT Hóa học 12
Cho 11,36g hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m g muối khan. Giá trị m là
A. 43,076
B. 34,076
C. 43,706
D. 34,706
-
Bài tập 37.8 trang 92 SBT Hóa học 12
Thực hiện những biến đổi hoá học trong sơ đồ sau bằng cách viết phương trình hoá học của các phản ứng và nêu điều kiện của phản ứng (nếu có).
-
Bài tập 37.9 trang 92 SBT Hóa học 12
Dung dịch A có chứa CuSO4 và Fe2(SO4)3
a) Thêm Mg vào dung dịch A → dung dịch B có 3 muối tan.
b) Thêm Mg vào dung dịch A → dung dịch C có 2 muối tan.
Viết PTHH của các phản ứng xảy ra.
-
Bài tập 37.10 trang 92 SBT Hóa học 12
Muốn có đủ khí clo để tác dụng với 1,12 g Fe cần phải dùng bao nhiêu gam K2Cr2O7 và bao nhiêu mililít dung dịch HCl 36,5% (D = 1,19 g/ml)
-
Bài tập 37.11 trang 92 SBT Hóa học 12
Hỗn hợp A gồm Fe và kim loại M có hoá trị không đổi trong mọi hợp chất, M đứng trước hiđro trong dãy điện hoá. Tỉ lệ số mol của M và Fe trong hỗn hợp A là 1 : 2. Cho 13,9 g hỗn hợp A tác dụng với khí Cl2 thì cần dùng 10,08 lít Cl2. Cho 13,9 g hỗn hợp A tác dụng với dung dịch HCl thì thu được 7,84 lít H2. Các thể tích khí đều đo ở đktc. Xác định kim loại M và % khối lượng của mỗi kim loại trong hỗn hợp A.
-
Bài tập 37.12 trang 92 SBT Hóa học 12
Cho luồng khí co dư đi qua ống sứ đựng m gam hỗn hợp FeO và Fe2O3 nung nóng. Sau khi kết thúc phản ứng, khối lượng chất rắn trong ống sứ là 5,5 gam. Cho khí đi ra khỏi ống sứ hấp thụ vào nước vôi trong dư thấy có 5 gam kết tủa. Xác định giá trị của m.
-
Bài tập 37.13 trang 92 SBT Hóa học 12
Cho 18,5 gam hỗn hợp X gồm Fe, Fe3O4 tác dụng với 200 ml dung dịch HNO3 loãng đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và còn lại 1,46 gam kim loại. Xác định khối lượng muối trong Y và nồng độ mol của dung dịch HNO3.
-
Bài tập 37.14 trang 93 SBT Hóa học 12
Hoà tan hoàn toàn 10 gam hỗn hợp X (Fe, Fe2O3) trong dung dịch HNO3 vừa đủ được 1,12 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho Y tác dụng với NaOH dư được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được m gam chất rắn. Xác định giá trị của m.