Mб»қi quГҪ thбә§y, cГҙ vГ cГЎc em cГ№ng HOC247 khГЎm phГЎ nб»ҷi dung BГ i 14: TГӯnh biбәҝn thiГӘn Enthalpy của phбәЈn б»©ng hГіa hб»Қc chЖ°ЖЎng trГ¬nh SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo. ThГҙng qua bГ i hб»Қc nГ y cГЎc em sбәҪ xГЎc Д‘б»Ӣnh Д‘Ж°б»Јc sб»ұ biбәҝn thiГӘn Enthalpy cЕ©ng nhЖ° cГЎch Д‘б»ғ tГӯnh toГЎn nДғng lЖ°б»Јng biбәҝn thiГӘn của mб»ҷt phбәЈn б»©ng. Mб»қi quГҪ thбә§y, cГҙ vГ cГЎc em theo dГөi nб»ҷi dung chi tiбәҝt bГ i hб»Қc bГӘn dЖ°б»ӣi nhГ©!
TГіm tбәҜt lГҪ thuyбәҝt
1.1. XГЎc Д‘б»Ӣnh biбәҝn thiГӘn Enthalpy của phбәЈn б»©ng dб»ұa vГ o nДғng lЖ°б»Јng liГӘn kбәҝt
- TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng dб»ұa vГ o nДғng lЖ°б»Јng liГӘn kбәҝt
.jpg)
HГ¬nh 14.1. Sб»ұ hГ¬nh thГ nh phГўn tб»ӯ nЖ°б»ӣc
- PhбәЈn б»©ng hГіa hб»Қc xбәЈy ra khi cГі sб»ұ phГЎ vб»Ў cГЎc liГӘn kбәҝt hoГЎ hб»Қc của chбәҘt Д‘бә§u (cД‘) vГ hГ¬nh thГ nh cГЎc liГӘn kбәҝt hoГЎ hб»Қc của sбәЈn phбә©m (sp). Sб»ұ phГЎ vб»Ў cГЎc liГӘn kбәҝt cбә§n cung cбәҘp nДғng lЖ°б»Јng, sб»ұ hГ¬nh thГ nh cГЎc liГӘn kбәҝt lбәЎi giбәЈi phГіng nДғng lЖ°б»Јng.
- Cho phбәЈn б»©ng tб»•ng quГЎt б»ҹ Д‘iб»Ғu kiб»Үn chuбә©n: aA (g) + bB (g) вҶ’ mM (g) + nN (g)
- TГӯnh \({\Delta _r}H_{298}^0\) của phбәЈn б»©ng khi biбәҝt cГЎc giГЎ trб»Ӣ nДғng lЖ°б»Јng liГӘn kбәҝt (Eb) theo cГҙng thб»©c:
\({\Delta _r}H_{298}^0\) = a x Eb (A) + b x Eb (B) вҖ“ m x Eb (M) - n x Eb (N) (1)
- TГӯnh biбәҝn thiб»ғn enthalpy của phбәЈn б»©ng dб»ұa vГ o nДғng lЖ°б»Јng liГӘn kбәҝt Д‘Ж°б»Јc ГЎp dб»Ҙng cho phбәЈn б»©ng trong Д‘Гі cГЎc chбәҘt Д‘б»Ғu cГі liГӘn kбәҝt cб»ҷng hoГЎ trб»Ӣ б»ҹ thб»ғ khГӯ khi biбәҝt giГЎ trб»Ӣ nДғng lЖ°б»Јng liГӘn kбәҝt của tбәҘt cбәЈ cГЎc chбәҘt trong phбәЈn б»©ng.
BбәЈng 14.1. NДғng lЖ°б»Јng liГӘn kбәҝt của mб»ҷt sб»‘ liГӘn kбәҝt cб»ҷng hoГЎ trб»Ӣ
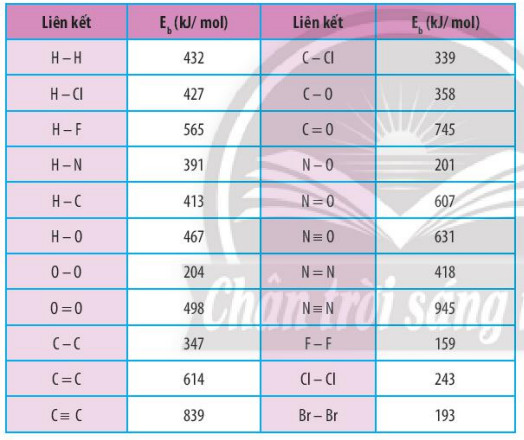
VГӯ dб»Ҙ 1: Dб»ұa vГ o nДғng lЖ°б»Јng liГӘn kбәҝt б»ҹ BбәЈng 14.1, tГӯnh biбәҝn thiб»Үn enthalpy của phбәЈn б»©ng:
H2(g) + Cl2(g) вҶ’ 2HCl(g)
- BЖ°б»ӣc 1: TГӯnh nДғng lЖ°б»Јng cбә§n thiбәҝt Д‘б»ғ phГЎ vб»Ў 1 mol H - H vГ 1 mol Cl - Cl
+ Tб»•ng nДғng lЖ°б»Јng thu vГ o Д‘б»ғ phГЎ vб»Ў cГЎc liГӘn kбәҝt: Eb (H -H) + Eb (C - C) = 432 +243 = 675 kJ
- BЖ°б»ӣc 2: TГӯnh nДғng lЖ°б»Јng toбәЈ ra khi hГ¬nh thГ nh 2 mol H - Cl
+ Tб»•ng nДғng lЖ°б»Јng toбәЈ ra Д‘б»ғ hГ¬nh thГ nh liГӘn kбәҝt: 2 x Eb (H-Cl) = 2 x 427 = 854 kJ
- BЖ°б»ӣc 3: TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng theo cГҙng thб»©c (1)
+ \({\Delta _r}H_{298}^0\) = 675 - 854 = -179 kJ
+ Do \({\Delta _r}H_{298}^0\) < 0 nГӘn phбәЈn б»©ng toбәЈ nhiб»Үt.
VГӯ dб»Ҙ 2: TГӯnh biбәҝn thiГӘn enthanny của phбәЈn б»©ng tбәЎo thГ nh ammonia (sб»ӯ dб»Ҙng nДғng lЖ°б»Јng liГӘn kбәҝt б»ҹ BбәЈng 14.1). Cho biбәҝt phбәЈn б»©ng thu nhiб»Үt hay toбәЈ nhiб»Үt vГ vбәҪ sЖЎ Д‘б»“ biб»ғu diб»…n biбәҝn thiГӘn enthalpy của phбәЈn б»©ng.
3H2(g) + N2(g) вҶ’ 2NH3 (g)
\({\Delta _r}H_{298}^0\) = 3 x Eb (H2) + Eb (N2) - 2 x Eb (NH3)
= 3 x Eb(H - H) + Eb(N - N) вҖ“ 2 x 3 x Eb(N - H) = 3 x 432 + 945 - 2 x 3 x 391 = -105 kJ.
- Do \({\Delta _r}H_{298}^0\) < 0 nГӘn phбәЈn б»©ng toбәЈ nhiб»Үt.
- SЖЎ Д‘б»“ biб»ғu diб»…n biбәҝn thiГӘn enthalpy của phбәЈn б»©ng:
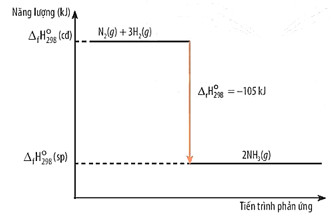
HГ¬nh 14.2.SЖЎ Д‘б»“ biб»ғu diб»…n biбәҝn thiГӘn enthalpy
|
Tб»•ng quГЎt: \({\Delta _r}H_{298}^0 = \sum {E_b}(c{\rm{d}}) - \sum {E_b}(sp)\) Vб»ӣi \(\sum {E_b}(c{\rm{d}})\), \(\sum {E_b}(s{\rm{p}})\): tб»•ng nДғng lЖ°б»Јng liГӘn kбәҝt trong phГўn tб»ӯ chбәҘt Д‘бә§u vГ sбәЈn phбә©m của phбәЈn б»©ng. |
|---|
1.2. XГЎc Д‘б»Ӣnh biбәҝn thiГӘn Enthalpy của phбәЈn б»©ng dб»ұa vГ o Enthalpy
- TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng dб»ұa vГ o enthalpy tбәЎo thГ nh
- Cho phЖ°ЖЎng trГ¬nh hoГЎ hб»Қc tб»•ng quГЎt: aA + bB вҶ’ MM + nN
- CГі thб»ғ tГӯnh Д‘Ж°б»Јc biбәҝn thiГӘn enthalpy chuбә©n của mб»ҷt phбәЈn б»©ng hoГЎ hб»Қc (\({\Delta _r}H_{298}^0\)) khi biбәҝt cГЎc giГЎ trб»Ӣ \({\Delta _f}H_{298}^0\) của tбәҘt cбәЈ cГЎc chбәҘt Д‘бә§u vГ sбәЈn phбә©m theo cГҙng thб»©c sau:
\({\Delta _r}H_{298}^0 = m.{\Delta _f}H_{298}^0(M) + n.{\Delta _f}H_{298}^0(N) - a.{\Delta _f}H_{298}^0(A) - b.{\Delta _f}H_{298}^0(B)\) (2)
VГӯ dб»Ҙ 3: Cho enthalpy tбәЎo thГ nh chuбә©n của cГЎc chбәҘt tЖ°ЖЎng б»©ng trong phЖ°ЖЎng trГ¬nh.
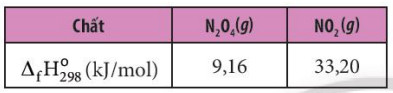
- TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng sau: 2NO2 (g) вҶ’ N2O4 (g)
- Theo cГҙng thб»©c (2), ta cГі: \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}{O_4}) - 2.{\Delta _f}H_{298}^0(N{O_2})\)= 9,16 вҖ“ 2 x 33,20 = -57,24 kg
- Do \({\Delta _r}H_{298}^0\) < 0 nГӘn phбәЈn б»©ng toбәЈ nhiб»Үt.
VГӯ dб»Ҙ 4: Cho nhiб»Үt tбәЎo thГ nh chuбә©n của cГЎc chбәҘt tЖ°ЖЎng б»©ng trong phЖ°ЖЎng trГ¬nh.
.jpg)
- TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng sau: N2O4 (g) + 3CO (g) вҶ’ N2O (g) + 3CO2 (8)
- Theo cГҙng thб»©c (2), ta cГі:
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0({N_2}O) + 3.{\Delta _f}H_{298}^0(C{O_2}) - {\Delta _f}H_{298}^0({N_2}{O_4}) - 3.{\Delta _f}H_{298}^0(CO)\)
= 82,05 + 3 x (-393,50) - 9,16 - 3x (-110,50) = -776,11 kJ
- Do \({\Delta _f}H_{298}^0\) < 0 nГӘn phбәЈn б»©ng toбәЈ nhiб»Үt.
|
Tб»•ng quГЎt: \({\Delta _r}H_{298}^0 = \sum {\Delta _f}H_{298}^0(sp) - \sum {\Delta _f}H_{298}^0(cd)\) Vб»ӣi \(\sum {\Delta _f}H_{298}^0(sp);\sum {\Delta _f}H_{298}^0(cd)\): tб»•ng enthalpy tбәЎo thГ nh б»ҹ Д‘iб»Ғu kiб»Үn chuбә©n tЖ°ЖЎng б»©ng của sбәЈn phбә©m, chбәҘt Д‘бә§u của phбәЈn б»©ng. |
|---|
BГ i tбәӯp minh hб»Қa
BГ i 1: Methane chГЎy tб»Ҹa nhiб»Үt lб»ӣn nГӘn Д‘Ж°б»Јc dГ№ng lГ m nhiГӘn liб»Үu. Khi trб»ҷn methane vГ oxygen vб»ӣi tб»ү lб»Ү thГӯch hб»Јp thГ¬ sбәҪ tбәЎo ra hб»—n hб»Јp nб»•
Biбәҝn thiГӘn enthalpy của phбәЈn б»©ng trГӘn Д‘Ж°б»Јc tГӯnh toГЎn dб»ұa trГӘn cГЎc giГЎ trб»Ӣ nГ o?
HЖ°б»ӣng dбә«n giбәЈi
- Trong bбәҘt cб»© phбәЈn б»©ng hГіa hб»Қc nГ o, nhiб»Үt cГі thб»ғ hoбә·c lГ Д‘Ж°б»Јc thu vГ o hoбә·c lГ thoГЎt ra mГҙi trЖ°б»қng xung quanh. Nhiб»Үt Д‘б»ҷ trao Д‘б»•i giб»Ҝa phбәЈn б»©ng hГіa hб»Қc vГ mГҙi trЖ°б»қng xung quanh Д‘Ж°б»Јc gб»Қi lГ entanpy của phбәЈn б»©ng, kГҪ hiб»Үu lГ H. Tuy nhiГӘn, H khГҙng thб»ғ Д‘o Д‘Ж°б»Јc mб»ҷt cГЎch trб»ұc tiбәҝp, thay vГ o Д‘Гі, viб»Үc Д‘o sб»ұ thay Д‘б»•i nhiб»Үt Д‘б»ҷ của phбәЈn б»©ng theo thб»қi gian Д‘Ж°б»Јc sб»ӯ dб»Ҙng Д‘б»ғ tГӯnh sб»ұ biбәҝn thiГӘn của entanpy theo thб»қi gian (kГҪ hiб»Үu lГ вҲҶH). Biбәҝt вҲҶH của mб»ҷt phбәЈn б»©ng, ta cГі thб»ғ xГЎc Д‘б»Ӣnh Д‘Ж°б»Јc Д‘Гі lГ phбәЈn б»©ng thu nhiб»Үt (nhiб»Үt của phбәЈn б»©ng lбәҘy tб»« mГҙi trЖ°б»қng) hay tб»Ҹa nhiб»Үt (nhiб»Үt của phбәЈn б»©ng tб»Ҹa ra mГҙi trЖ°б»қng).
- Biбәҝn thiГӘn enthalpy của phбәЈn б»©ng Д‘Ж°б»Јc tГӯnh toГЎn dб»ұa trГӘn giГЎ trб»Ӣ nДғng lЖ°б»Јng liГӘn kбәҝt hoбә·c dб»ұa vГ o enthalpy tбәЎo thГ nh.
BГ i 2: TГӯnh biбәҝn thiГӘn enthalpy của phбәЈn б»©ng phГўn hủy trinitroglycerin (C3H5O3(NO2)3), theo phЖ°ЖЎng trГ¬nh sau (biбәҝt nhiб»Үt tбәЎo thГ nh của nitroglycerin lГ -370,15 kJ/mol):
4 C3H5O3(NO2)3(s) вҶ’ 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
HГЈy giбәЈi thГӯch vГ¬ sao trinitroglycerin Д‘Ж°б»Јc б»©ng dб»Ҙng lГ m thГ nh phбә§n thuб»‘c sГәng khГҙng khГіi.
HЖ°б»ӣng dбә«n giбәЈi
|
ChбәҘt |
C3H5O3(NO2)3(s) |
N2(g) |
CO2(g) |
H2O(g) |
O2(g) |
|
\({\Delta _f}H_{298}^o\) |
-370,15 |
0 |
-393,50 |
-241,82 |
0 |
\({\Delta _r}H_{298}^o\) = 6.\({\Delta _f}H_{298}^o\)(N2) + 12.\({\Delta _f}H_{298}^o\)(CO2) + 10.\({\Delta _f}H_{298}^o\)(H2O) + \({\Delta _f}H_{298}^o\)(O2) - 4.\({\Delta _f}H_{298}^o\)(C3H5O3(NO2)3)
= 6.0 + 12.(-393,50) + 10.(-241,82) + 1.0 вҖ“ 4.(-370,15) = -5659,60 kJ < 0
вҶ’ PhбәЈn б»©ng phГўn hủy trinitroglycerin tб»Ҹa ra lЖ°б»Јng nhiб»Үt rбәҘt lб»ӣn вҶ’ GГўy tГӯnh sГЎt thЖ°ЖЎng cao
вҶ’ Trinitroglycerin Д‘Ж°б»Јc б»©ng dб»Ҙng lГ m thГ nh phбә§n của thuб»‘c sГәng khГҙng khГіi.
Luyб»Үn tбәӯp BГ i 14 HГіa 10 CTST
Sau bГ i hб»Қc nГ y, hб»Қc sinh sбәҪ:
- TГӯnh Д‘Ж°б»Јc \({\Delta _r}H_{298}^0\) của mб»ҷt phбәЈn б»©ng dб»ұa vГ o bбәЈng sб»‘ liб»Үu nДғng lЖ°б»Јng liГӘn kбәҝt, nhiб»Үt tбәЎo thГ nh cho sбәөn.
3.1. TrбәҜc nghiб»Үm BГ i 14 HГіa 10 CTST
CГЎc em cГі thб»ғ hб»Ү thб»‘ng lбәЎi nб»ҷi dung kiбәҝn thб»©c Д‘ГЈ hб»Қc Д‘Ж°б»Јc thГҙng qua bГ i kiб»ғm tra TrбәҜc nghiб»Үm HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo BГ i 14 cб»ұc hay cГі Д‘ГЎp ГЎn vГ lб»қi giбәЈi chi tiбәҝt.
-
- A. 42,67 kJ.
- B. 41,67 kJ.
- C. 31,67 kJ.
- D. 32,67 kJ.
-
- A. -1428,4 kJ.mol-1
- B. -1323 kJ.mol-1
- C. -563 kJ.mol-1
- D. -283 kJ.mol-1
-
- A. LiГӘn kбәҝt trong phГўn tб»ӯ BaF2 vГ CsCl lГ liГӘn kбәҝt ion.
- B. LiГӘn kбәҝt trong phГўn tб»ӯ NH3, H2O, H2S lГ liГӘn kбәҝt cб»ҷng hГіa trб»Ӣ cГі cб»ұc.
- C. LiГӘn kбәҝt trong phГўn tб»ӯ Cl2, H2, O2, N2 lГ liГӘn kбәҝt cб»ҷng hГіa trб»Ӣ khГҙng cб»ұc.
- D. LiГӘn kбәҝt trong phГўn tб»ӯ CaS vГ AlCl3 lГ liГӘn kбәҝt ion vГ¬ Д‘Ж°б»Јc hГ¬nh thГ nh giб»Ҝa kim loбәЎi vГ phi kim.
CГўu 4-10: Mб»қi cГЎc em Д‘Дғng nhбәӯp xem tiбәҝp nб»ҷi dung vГ thi thб»ӯ Online Д‘б»ғ củng cб»‘ kiбәҝn thб»©c vб»Ғ bГ i hб»Қc nГ y nhГ©!
3.2. BГ i tбәӯp SGK BГ i 14 HГіa 10 CTST
CГЎc em cГі thб»ғ xem thГӘm phбә§n hЖ°б»ӣng dбә«n GiбәЈi bГ i tбәӯp HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo BГ i 14 Д‘б»ғ giГәp cГЎc em nбәҜm vб»Ҝng bГ i hб»Қc vГ cГЎc phЖ°ЖЎng phГЎp giбәЈi bГ i tбәӯp.
GiбәЈi cГўu hб»Ҹi 1 trang 88 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi cГўu hб»Ҹi 2 trang 89 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi cГўu hб»Ҹi 3 trang 89 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp trang 89 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Vбәӯn dб»Ҙng trang 90 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp trang 90 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Vбәӯn dб»Ҙng trang 91 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi cГўu hб»Ҹi 4 trang 91 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp trang 91 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 1 trang 92 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 2 trang 92 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 3 trang 93 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 4 trang 93 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 5 trang 93 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 6 trang 93 SGK HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.1 trang 56 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.2 trang 56 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.3 trang 56 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.4 trang 56 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.5 trang 57 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.6 trang 57 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.7 trang 57 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.8 trang 58 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.9 trang 58 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.10 trang 58 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.11 trang 59 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.12 trang 59 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.13 trang 59 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.14 trang 59 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 14.15 trang 59 SBT HГіa hб»Қc 10 ChГўn trб»қi sГЎng tбәЎo - CTST
Hб»Ҹi Д‘ГЎp BГ i 14 HГіa hб»Қc 10 CTST
Trong quГЎ trГ¬nh hб»Қc tбәӯp nбәҝu cГі thбәҜc mбәҜc hay cбә§n trб»Ј giГәp gГ¬ thГ¬ cГЎc em hГЈy comment б»ҹ mб»Ҙc Hб»Ҹi Д‘ГЎp, Cб»ҷng Д‘б»“ng HГіa hб»Қc HOC247 sбәҪ hб»— trб»Ј cho cГЎc em mб»ҷt cГЎch nhanh chГіng!
ChГәc cГЎc em hб»Қc tбәӯp tб»‘t vГ luГҙn Д‘бәЎt thГ nh tГӯch cao trong hб»Қc tбәӯp!





