Hó¯Ã£ng dä¨n GiäÈi bû i täÙp Hû°a hãc 10 ChûÂn trãi sûÀng täÀo Bû i 14 Bû i 14: TûÙnh biä¢n thiûˆn Enthalpy cãÏa phäÈn ãˋng hû°a hãc lãp 10 CTST giû¤p cûÀc em hãc sinh nä₤m vã₤ng phó¯óÀng phûÀp giäÈi bû i täÙp vû ûÇn luyãn tãt kiä¢n thãˋc.
-
GiäÈi cûÂu hãi 1 trang 88 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Quan sûÀt Hû˜nh 14.1 cho biä¢t liûˆn kä¢t hû°a hãc nû o bã phûÀ vãÀ, liûˆn kä¢t hû°a hãc nû o áó¯Ã£Èc hû˜nh thû nh khi H2 phäÈn ãˋng vãi O2 täÀo thû nh H2O (ã thã khûÙ)?
.jpg)
Hû˜nh 14.1. SÃ£Ý hû˜nh thû nh phûÂn tã٠nó¯Ã£c
-
GiäÈi cûÂu hãi 2 trang 89 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
TûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng dãÝa vû o náng ló¯Ã£Èng liûˆn kä¢t phäÈi viä¢t áó¯Ã£Èc cûÇng thãˋc cäËu täÀo cãÏa täËt cÃ¤È cûÀc chäËt trong phäÈn ãˋng áã xûÀc áãnh sã ló¯Ã£Èng vû loäÀi liûˆn kä¢t. XûÀc áãnh sã ló¯Ã£Èng mãi loäÀi liûˆn kä¢t trong cûÀc phûÂn tã٠sau: CH4, CH3Cl, NH3, CO2.
-
GiäÈi cûÂu hãi 3 trang 89 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
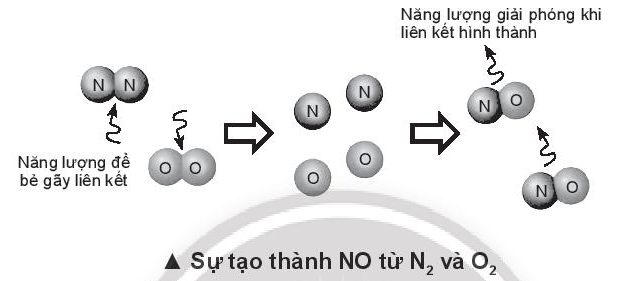
DãÝa vû o náng ló¯Ã£Èng liûˆn kä¢t ã BäÈng 14.1, tûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng vû giäÈi thûÙch vû˜ sao nitrogen (N\( \equiv \)N) chã phäÈn ãˋng vãi oxygen (O=O) ã nhiãt áã cao hoäñc cû° tia lãÙa áiãn áã täÀo thû nh nitrogen monoxide (N=O).
N2(g) + O2(g) \(\xrightarrow{{{t^o}}}\) 2NO(g)
-
Luyãn täÙp trang 89 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
XûÀc áãnh \({\Delta _r}H_{298}^o\) cãÏa phäÈn ãˋng sau dãÝa vû o giûÀ trã Eb ã BäÈng 14.1:
CH4(g) + Cl2(g) \(\xrightarrow{{askt}}\) CH3Cl(g) + HCl(g)
HûÈy cho biä¢t phäÈn ãˋng trûˆn tãa nhiãt hay thu nhiãt?
BäÈng 14.1. Náng ló¯Ã£Èng liûˆn kä¢t cãÏa mãt sã liûˆn kä¢t cãng hoûÀ trã
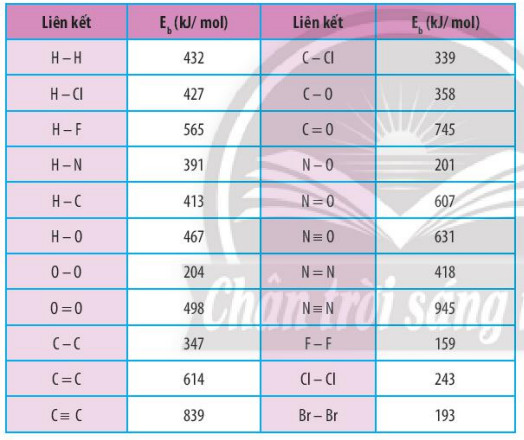
- VIDEOYOMEDIA
-
VäÙn dãËng trang 90 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
DãÝa vû o sã liãu vã náng ló¯Ã£Èng liûˆn kä¢t ã BäÈng 14.1, hûÈy tûÙnh biä¢n thiûˆn enthalpy cãÏa 2 phäÈn ãˋng sau:
2H2(g) + O2(g) \(\xrightarrow{{{t^o}}}\)2H2O(g) (1)
C7H16(g) + 11O2(g) \(\xrightarrow{{{t^o}}}\) 7CO2(g) + 8H2O(g) (2)
So sûÀnh kä¢t quÃ¤È thu áó¯Ã£Èc, t㨠áû° cho biä¢t H2 hay C7H16 lû nhiûˆn liãu hiãu quÃ¤È hóÀn cho tûˆn lãÙa (biä¢t trong C7H16 cû° 6 liûˆn kä¢t C-C vû 16 liûˆn kä¢t C-H)
-
Luyãn täÙp trang 90 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
TûÙnh \({\Delta _r}H_{298}^o\) cãÏa hai phäÈn ãˋng sau:
3O2(g) ã 2O3(g) (1)
2O3(g) ã 3O2(g) (2)
Liûˆn hã giã₤a giûÀ trã \({\Delta _r}H_{298}^o\) vãi áã bãn cãÏa O3, O2 vû giäÈi thûÙch, biä¢t phûÂn tã٠O3 gãm 1 liûˆn kä¢t áûÇi O=O vû 1 liûˆn kä¢t áóÀn O-O
-
VäÙn dãËng trang 91 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
TûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng phûÂn hãÏy trinitroglycerin (C3H5O3(NO2)3), theo phó¯óÀng trû˜nh sau (biä¢t nhiãt täÀo thû nh cãÏa nitroglycerin lû -370,15 kJ/mol):
4 C3H5O3(NO2)3(s) ã 6N2(g) + 12CO2(g) + 10H2O(g) + O2(g)
HûÈy giäÈi thûÙch vû˜ sao trinitroglycerin áó¯Ã£Èc ãˋng dãËng lû m thû nh phäÏn thuãc sû¤ng khûÇng khû°i
-
GiäÈi cûÂu hãi 4 trang 91 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
GiûÀ trã biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng cû° liûˆn quan tãi hã sã cûÀc chäËt trong phó¯óÀng trû˜nh nhiãt hû°a hãc khûÇng? GiûÀ trã enthalpy täÀo thû nh thó¯Ã£ng áó¯Ã£Èc áo ã áiãu kiãn nû o?
-
Luyãn täÙp trang 91 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
DãÝa vû o giûÀ trã enthalpy täÀo thû nh ã BäÈng 13.1, hûÈy tûÙnh giûÀ trã \({\Delta _r}H_{298}^o\) cãÏa cûÀc phäÈn ãˋng sau:
CS2(l) + 3O2(g) \(\xrightarrow{{{t^o}}}\) CO2(g) + 2SO2(g) (1)
4NH3(g) + 3O2 \(\xrightarrow{{{t^o}}}\) 2N2(g) + 6H2O(g) (2)
-
GiäÈi bû i 1 trang 92 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
TûÙnh \({\Delta _r}H_{298}^o\) cãÏa cûÀc phäÈn ãˋng sau dãÝa theo náng ló¯Ã£Èng liûˆn kä¢t (sã٠dãËng sã liãu t㨠BäÈng 14.1):
BäÈng 14.1. Náng ló¯Ã£Èng liûˆn kä¢t cãÏa mãt sã liûˆn kä¢t cãng hoûÀ trã

a) N2H4(g) ã N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) \(\xrightarrow{{{t^o}}}\) 2Cl2(g) + 2H2O(g)
-
GiäÈi bû i 2 trang 92 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
DãÝa vû o BäÈng 13.1, tûÙnh biä¢n thiûˆn enthalpy chuäˋn cãÏa phäÈn ãˋng áãt chûÀy hoû n toû n 1 mol benzene C6H6(l) trong khûÙ oxygen, täÀo thû nh CO2(g) vû H2O(l). So sûÀnh ló¯Ã£Èng nhiãt sinh ra khi áãt chûÀy hoû n toû n 1,0 g propane C3H8(g) vãi ló¯Ã£Èng nhiãt sinh ra khi áãt chûÀy hoû n toû n 1,0 g benzenne C6H6(l).
-
GiäÈi bû i 3 trang 93 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
DãÝa vû o enthalpy täÀo thû nh ã BäÈng 13.1, tûÙnh biä¢n thiûˆn enthalpy chuäˋn cãÏa phäÈn ãˋng nhiãt nhûÇm:
2Al(s) + Fe2O3(s) \(\xrightarrow{{{t^o}}}\) 2Fe(s) + Al2O3(s)
T㨠kä¢t quÃ¤È tûÙnh áó¯Ã£Èc ã trûˆn, hûÈy rû¤t ra û§ ngháˋa cãÏa däËu vû giûÀ trã \({\Delta _r}H_{298}^o\) áãi vãi phäÈn ãˋng
-
GiäÈi bû i 4 trang 93 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho phó¯óÀng trû˜nh nhiãt hû°a hãc sau:
SO2(g) + ô§ O2(g) \(\xrightarrow{{{t^o},{V_2}{O_5}}}\) SO3(g) \({\Delta _r}H_{298}^o\) = -98,5 kJ
a) TûÙnh ló¯Ã£Èng nhiãt giäÈi phû°ng ra khi chuyãn 74,6 g SO2 thû nh SO3
b) GiûÀ trã \({\Delta _r}H_{298}^o\) cãÏa phäÈn ãˋng: SO3(g) ã SO2(g) + ô§ O2(g) lû bao nhiûˆu?
-
GiäÈi bû i 5 trang 93 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
KhûÙ hydrogen chûÀy trong khûÇng khûÙ täÀo thû nh nó¯Ã£c theo phó¯óÀng trû˜nh hû°a hãc sau:
2H2(g) + O2(g) ã 2H2O(g) \({\Delta _r}H_{298}^o\) = -483,64 kJ
a) Nó¯Ã£c hay hãn hãÈp cãÏa oxygen vû hydrogen cû° náng ló¯Ã£Èng lãn hóÀn? GiäÈi thûÙch
b) Vä§ sóÀ áã biä¢n thiûˆn náng ló¯Ã£Èng cãÏa phäÈn ãˋng giã₤a hydrogen vû oxygen.
-
GiäÈi bû i 6 trang 93 SGK Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Xûˋt quûÀ trû˜nh áãt chûÀy khûÙ propane C3H8(g):
C3H8(g) + 5O2(g) \(\xrightarrow{{{t^o}}}\) 3CO2(g) + 4H2O(g)
TûÙnh biä¢n thiûˆn enthalpy chuäˋn cãÏa phäÈn ãˋng dãÝa vû o nhiãt täÀo thû nh cãÏa hãÈp chäËt (BäÈng 13.1) vû dãÝa vû o náng ló¯Ã£Èng liûˆn kä¢t (BäÈng 14.1). So sûÀnh hai giûÀ trã áû° vû rû¤t ra kä¢t luäÙn
-
GiäÈi bû i 14.1 trang 56 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Trû˜nh bû y cûÀch tûÙnh enthalpy cãÏa phäÈn ãˋng hoûÀ hãc dãÝa vû o náng ló¯Ã£Èng liûˆn kä¢t vû dãÝa vû o enthalpy täÀo thû nh cãÏa cûÀc chäËt
-
GiäÈi bû i 14.2 trang 56 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho phäÈn ãˋng tãng quûÀt aA + bB -> mM + nN. HûÈy chãn cûÀc phó¯óÀng ûÀn tûÙnh áû¤ng. \({\Delta _r}H_{298}^0\) cãÏa phäÈn ãˋng:
(a) \({\Delta _r}H_{298K}^0 = m\;x\;{\Delta _f}H_{298}^0(M) + n\;x\;{\Delta _f}H_{298}^0(N) - a\;x\;{\Delta _f}H_{298}^0(A) - b\;x\;{\Delta _f}H_{298}^0(B)\)
(b) \({\Delta _r}H_{298K}^0 = a\;x\;{\Delta _f}H_{298}^0(A) + b\;x\;{\Delta _f}H_{298}^0(B) - m\;x\;{\Delta _f}H_{298}^0(M) - n\;x\;{\Delta _f}H_{298}^0(N)\)
(c) \({\Delta _r}H_{298K}^0 = a\;x\;{E_b}(A) + b\;x\;{E_b}(B) - m\;x\;{E_b}(M) - n\;x\;{E_b}(N)\)
(d) \({\Delta _r}H_{298K}^0 = m\;x\;{E_b}(M) + n\;x\;{E_b}(N) - a\;x\;{E_b}(A) - b\;x\;{E_b}(B)\)
-
GiäÈi bû i 14.3 trang 56 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Thû nh phäÏn chûÙnh cãÏa áa sã cûÀc loäÀi áûÀ dû¿ng trong xûÂy dãÝng lû CaCO3, chû¤ng vã¨a cû° tûÀc dãËng chãu nhiãt, vã¨a chãu áó¯Ã£Èc lãÝc. DãÝa vû o bäÈng 13.1 SGK trang 84, tûÙnh \({\Delta _r}H_{298}^0\) cãÏa phäÈn ãˋng:
CaCO3(s) -> CaO(s) + CO2(g)
PhäÈn ãˋng cû° xäÈy ra thuäÙn lãÈi ã áiãu kiãn thó¯Ã£ng khûÇng?
-
GiäÈi bû i 14.4 trang 56 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Propene lû nguyûˆn liãu cho säÈn xuäËt nhãÝa polypropylene (PP). PP áó¯Ã£Èc sã٠dãËng áã säÈn xuäËt cûÀc säÈn phäˋm ûÇng, mû ng, dû y cûÀch áiãn, kûˋo sãÈi, áã gia dãËng vû cûÀc säÈn phäˋm täÀo hû˜nh khûÀc.

PhäÈn ãˋng täÀo thû nh propene t㨠propyne:
CH3-CãÀCH(g) + H2(g) ->CH3-CH=CH2(g)
a) HûÈy xûÀc áãnh sã liûˆn kä¢t C-H; C-C; C=C trong hãÈp chäËt CH3-CãÀCH (propyne).
b) T㨠náng ló¯Ã£Èng cãÏa cûÀc liûˆn kä¢t (BäÈng 14.1, SGK trang 89), hûÈy tûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng täÀo thû nh propene trûˆn.
-
GiäÈi bû i 14.5 trang 57 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
TûÙnh nhiãt täÀo thû nh chuäˋn cãÏa HF vû NO dãÝa vû o náng ló¯Ã£Èng liûˆn kä¢t (BäÈng 14.1 SGK), cãÏa F2, H2, HF, N2, O2, NO. GiäÈi thûÙch sÃ£Ý khûÀc nhau vã nhiãt täÀo thû nh cãÏa HF vû NO.
-
GiäÈi bû i 14.6 trang 57 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
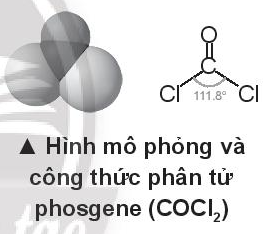
Phosgene lû chäËt khûÙ khûÇng mû u, mû¿i cã mãËc, dã hoûÀ lãng; khãi ló¯Ã£Èng riûˆng 1,420 g/cm3 (ã 0ô¯C); t = 8,2ô¯C. Phosgene ûÙt tan trong nó¯Ã£c; dã tan trong cûÀc dung mûÇi hã₤u cóÀ, bã thuãñ phûÂn chäÙm bäÝng hóÀi nó¯Ã£c; khûÇng chûÀy, lû säÈn phäˋm cûÇng nghiãp quan trãng; dû¿ng trong tãng hãÈp hã₤u cóÀ áã säÈn xuäËt säÈn phäˋm nhuãm, chäËt diãt cã, polyurethane,ãÎ
Phosgene lû mãt chäËt áãc. ã nãng áã 0,005 mg/L áûÈ nguy hiãm áãi vãi ngó¯Ã£i, trong khoäÈng 0,1 ã 0,3 mg/L, gûÂy tã٠vong sau khoäÈng 15 phû¤t.
Phosgene áó¯Ã£Èc áiãu chä¢ bäÝng cûÀch cho hãn hãÈp CO vû Cl2, ái qua than hoäÀt tûÙnh. Biä¢t Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(CãÀO) = 1075 kJ/mol.
HûÈy tûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng täÀo thû nh phosgene t㨠CO vû Cl2.
-
GiäÈi bû i 14.7 trang 57 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Kim loäÀi nhûÇm cû° thã khã٠áó¯Ã£Èc oxide cãÏa nhiãu nguyûˆn tã. DãÝa vû o nhiãt täÀo thû nh chuäˋn cãÏa cûÀc chäËt (BäÈng 13.1 SGK), tûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng nhûÇm khã٠1 mol mãi oxide sau
a) Fe3O4(s)
b) Cr2O3(s)
-
GiäÈi bû i 14.8 trang 58 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho 3 hydrocarbon X, Y, Z áãu cû° 2 nguyûˆn tã٠C trong phûÂn tãÙ. Sã nguyûˆn tã٠H trong cûÀc phûÂn tã٠táng däÏn theo thãˋ tÃ£Ý X, Y, Z.
a) Viä¢t cûÇng thãˋc cäËu täÀo cãÏa X, Y, Z.
b) Viä¢t phó¯óÀng trû˜nh áãt chûÀy hoû n toû n X, Y, Z vãi hã sã nguyûˆn tãi giäÈn.
c) TûÙnh biä¢n thiûˆn enthalpy cãÏa mãi phäÈn ãˋng dãÝa vû o enthalpy täÀo thû nh tiûˆu chuäˋn trong bäÈng sau:
ChäËt
X(g)
Y(g)
Z(g)
CO2(g)
H2O(g)
\({\Delta _f}H_{298}^0\)(kJ/mol)
+227,0
+52,47
-84,67
-393,5
-241,82
d) T㨠kä¢t quÃ¤È tûÙnh toûÀn áó¯a ra kä¢t luäÙn vã ãˋng dãËng cãÏa phäÈn ãˋng áãt chûÀy X, Y, Z trong thãÝc tiã n.
-
GiäÈi bû i 14.9 trang 58 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho cûÀc phäÈn ãˋng:
CaCO3(s) -> CaO(s) + CO2(g) \({\Delta _r}H_{298}^0 = + 178,49kJ\)
C2H5OH(l) + 3O2(g) -> 2CO2(g) + 3H2O(l) \({\Delta _r}H_{298}^0 = - 1370,70kJ\)
C(graphite, s) + O2(g) -> CO2(g) \({\Delta _r}H_{298}^0 = - 393,51kJ\)
a) PhäÈn ãˋng nû o cû° thã tÃ£Ý xäÈy ra (sau giai áoäÀn khóÀi mû o ban áäÏu), phäÈn ãˋng nû o khûÇng thã tÃ£Ý xäÈy ra?
b) Khãi ló¯Ã£Èng ethanol hay graphite cäÏn dû¿ng khi áãt chûÀy hoû n toû n áÃ£Ï täÀo ló¯Ã£Èng nhiãt cho quûÀ trû˜nh nhiãt phûÂn hoû n toû n 0,1 mol CaCO3. GiÃ¤È thiä¢t hiãu suäËt cûÀc quûÀ trû˜nh áãu lû 100%.
-
GiäÈi bû i 14.10 trang 58 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
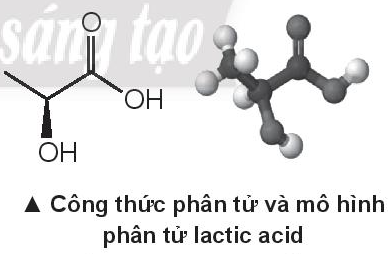
Lactic acid hay acid sã₤a lû hãÈp chäËt hoûÀ hãc áû°ng vai trûý quan trãng trong nhiãu quûÀ trû˜nh sinh hoûÀ, läÏn áäÏu tiûˆn áó¯Ã£Èc phûÂn tûÀch vû o nám 1780 bãi nhû hoûÀ hãc Thuãç áiãn Carl Wilhelm Scheele. Lactic acid cû° cûÇng thãˋc phûÂn tã٠C3H6O3, cûÇng thãˋc cäËu täÀo CH3-CH(OH)-COOH
Khi väÙn áãng mäÀnh cóÀ thã khûÇng áÃ£Ï cung cäËp oxygen, thû˜ cóÀ thã sä§ chuyãn hoûÀ glucose thû nh lactic acid t㨠cûÀc tä¢ bû o áã cung cäËp náng ló¯Ã£Èng cho cóÀ thã (lactic acid täÀo thû nh t㨠quûÀ trû˜nh nû y sä§ gûÂy mãi cóÀ) theo phó¯óÀng trû˜nh sau:
C6H12O6(aq) -> 2C3H6O3(aq) \({\Delta _r}H_{298}^0 = - 150kJ\)
Biä¢t räÝng cóÀ thã chã cung cäËp 98% náng ló¯Ã£Èng nhã oxygen, náng ló¯Ã£Èng cûýn läÀi nhã vû o sÃ£Ý chuyãn hoûÀ glucose thû nh lactic acid.
GiÃ¤È sã٠mãt ngó¯Ã£i chäÀy bã trong mãt thãi gian tiûˆu tãn 300 kcal. TûÙnh khãi ló¯Ã£Èng lactic acid täÀo ra t㨠quûÀ trû˜nh chuyãn hû°a áû° (biä¢t 1 cal = 4,184 J).
-
GiäÈi bû i 14.11 trang 59 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Chloromethane (CH3Cl), cûýn áó¯Ã£Èc gãi lû methyl chloride, Refrigerant-40 hoäñc HCC 40. CH3Cl tã¨ng áó¯Ã£Èc sã٠dãËng rãng rûÈi nhó¯ mãt chäËt lû m läÀnh. HãÈp chäËt khûÙ nû y räËt dã chûÀy, cû° thã khûÇng mû¿i hoäñc cû° mû¿i thóÀm nhä¿.
T㨠náng ló¯Ã£Èng cãÏa cûÀc liûˆn kä¢t (BäÈng 14.1 SGK), hûÈy tûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng täÀo thû nh chloromethane:
CH4(g) + Cl2(g) -> CH3Cl(g) + HCl(g)
Cho biä¢t phäÈn ãˋng dã dû ng xäÈy ra dó¯Ã£i ûÀnh sûÀng mäñt trãi. Kä¢t quÃ¤È tûÙnh cû° mûÂu thuä¨n vãi khÃ¤È náng dã xäÈy ra cãÏa phäÈn ãˋng khûÇng?
-
GiäÈi bû i 14.12 trang 59 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Mãt xe täÈi áang väÙn chuyãn áäËt áû´n (thû nh phäÏn chûÙnh lû CaC2 vû CaO) gäñp mó¯a xäÈy ra sÃ£Ý cã, xe täÈi áûÈ bãc chûÀy.
a) Viä¢t phäÈn ãˋng cãÏa CaC2 vû CaO vãi nó¯Ã£c.
b) Xe täÈi bãc chûÀy do cûÀc phäÈn ãˋng trûˆn toÃ¤È nhiãt kûÙch thûÙch phäÈn ãˋng chûÀy cãÏa acetylene:
C2H2(g) + 2,5O2(g) -> 2CO2(g) + H2O(g)
DãÝa vû o BäÈng 13.1 SGK, tûÙnh biä¢n thiûˆn enthalpy cãÏa cûÀc phäÈn ãˋng trûˆn. Cho biä¢t phäÈn ãˋng toÃ¤È nhiãt hay thu nhiãt.
-
GiäÈi bû i 14.13 trang 59 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho phó¯óÀng trû˜nh hoûÀ hãc cãÏa phäÈn ãˋng:
C2H4(g) + H2O(l) -> C2H5OH(l)
TûÙnh biä¢n thiûˆn enthalpy cãÏa phäÈn ãˋng theo nhiãt täÀo thû nh chuäˋn cãÏa cûÀc chäËt (BäÈng 13.1 SGK).
-
GiäÈi bû i 14.14 trang 59 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
Cho phäÈn ãˋng phûÂn huãñ hydrazine:
N2H4(g) -> N2(g) + 2H2(g)
a) TûÙnh \({\Delta _r}H_{298}^0\) theo náng ló¯Ã£Èng liûˆn kä¢t cãÏa phäÈn ãˋng trûˆn.
b) Hydrazine (N2H4) lû chäËt lãng ã áiãu kiãn thó¯Ã£ng (sûÇi ã 114ô¯C, khãi ló¯Ã£Èng riûˆng 1,021 g/cm3). HûÈy áã xuäËt lûÙ do N2H4 áó¯Ã£Èc sã٠dãËng lû m nhiûˆn liãu trong áãng cóÀ tûˆn lãÙa. Biä¢t Eb(N-N) = 160 kJ/mol; Eb(NãH) = 391 kJ/mol, Eb(NãÀN) = 945 kJ/mol; Eb(H-H) = 432 kJ/mol.
-
GiäÈi bû i 14.15 trang 59 SBT Hû°a hãc 10 ChûÂn trãi sûÀng täÀo - CTST
QuûÀ trû˜nh hoû tan calcium chloride trong nó¯Ã£c:
CaCl2(s) -> Ca2+(aq) + 2Cl-(aq) \({\Delta _r}H_{298}^0 = ?\)
ChäËt
CaCl2
Ca2+
Cl-
\({\Delta _f}H_{298}^0\)(kJ/mol)
-795,0
-542,83
-167,16
TûÙnh biä¢n thiûˆn enthalpy cãÏa quûÀ trû˜nh.





