Thông qua nội dung chi tiết của Bài 13: Enthalpy tạo thành và biến thiên Enthalpy của phản ứng hóa học lớp 10 SGK Chân trời sáng tạo được HOC247 biên soạn bên dưới đây các em học sinh sẽ nắm được khái niệm về phản ứng thu, tỏa nhiệt, biết cách tính toán năng lượng biến thiên Enthalpy một cách thành thạo nhất.
Mời các em tham khảo nội dung chi tiết!
Tóm tắt lý thuyết
1.1. Phản ứng tỏa nhiệt
* Tìm hiểu phản ứng toả nhiệt
- Trong ngành đường sắt, phương pháp hàn nhiệt nhôm được dùng để hàn đường ray. Hỗn hợp tron(III) oxide và bột nhôm được đốt cháy. Phản ứng nhiệt nhôm toả nhiệt rất lớn (trên 2500°C), làm nóng chảy hỗn hợp và sắt sinh ra từ phản ứng lấp đầy khe hở (Hình 13.1). Ngoài ứng dụng để hàn đường ray, phản ứng trên còn được sử dụng hàn nối các thanh kim loại đồng và hàn thép không gỉ, gang.
.jpg)
Hình 13.1. Phản ứng nhiệt nhôm để hàn đường ray
- Thí nghiệm 1: Sự thay đổi nhiệt độ khi vôi sống phản ứng với nước
+ Dụng cụ và thiết bị: Cốc chịu nhiệt 50 ml, cần, nhiệt kế, đũa thuỷ tinh, giá đỡ nhiệt kế.
+ Hoá chất: Vôi sống (CaO), nước cất.
+ Tiến hành:
- Bước 1: Cho khoảng 25 ml nước cất vào cốc chịu nhiệt, đặt bầu nhiệt kế vào trong lòng chất lỏng (Hình 13.2a), ghi nhận giá trị nhiệt độ.
- Bước 2: Cần khoảng 5 g CaO. Cho nhanh Cao vào cốc, bắt đầu bấm giờ và ghi nhận nhiệt độ, đồng thời dùng đũa thuỷ tinh khuấy nhẹ (Hình 13.2b).
- Bước 3: Ghi nhận giá trị nhiệt độ sau khoảng 2 phút.ư
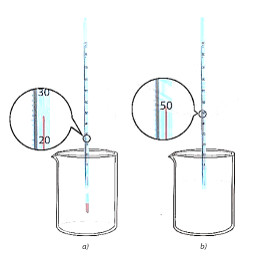
Hình 13.2. Minh họa vôi sống phản ứng với nước
| Phản ứng toả nhiệt là phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường. |
|---|
1.2. Phản ứng thu nhiệt
* Tìm hiểu phản ứng thu nhiệt
.jpg)
Hình 13.3. Hoà tan viên vitamin C sủi vào cốc nước
- Thí nghiệm 2: Nhiệt phân potassium chlorate
+ Dụng cụ và thiết bị: Đèn cồn, ống nghiệm chịu nhiệt, nút cao su có gắn ống dẫn khí, chậu thuỷ tinh, bình tam giác, giá sắt.
+ Hoá chất: Potassium chlorate (KClO3), manganese dioxide (MnO2).
+ Tiến hành:
- Bước 1: Trộn đều khoảng 4g tinh thể KClO3 đã được nghiền nhỏ với 1g MnO2. Cho hỗn hợp vào ống nghiệm chịu nhiệt, khổ. Đậy ống nghiệm bằng nút có gắn ống dẫn khí. Lắp hệ thống như Hình 13.4. Quan sát hiện tượng.
- Bước 2: Dùng đèn cồn hơ nóng đều nửa đáy ống nghiệm, sau đó đun tập trung ở phần có chứa hoá chất. Quan sát hiện tượng.
.jpg)
Hình 13.4. Nhiệt phân potassium chlorate
+ Phương trình hóa học của phản ứng: 2KCIO3(s) → 3O2 (g) + 2KCl(s)
| Phản ứng thu nhiệt là phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường. |
|---|
1.3. Biến thiên Enthalpy chuẩn của phản ứng
a. Tìm hiểu về biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu \({\Delta _r}H\)), thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là lượng nhiệt toả ra hay thu vào của một phản ứng hoá học trong quá trình đẳng áp (áp suất không đổi).
|
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hoá học, được kí hiệu là \({\Delta _r}H_{298}^0\)) là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn. - Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25°C (hay 298 K). |
|---|
b. Tìm hiểu về phương trình nhiệt hoá học
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì \({\Delta _f}H_{298}^0\) > 0.
Ví dụ 1: CH4 (g) + H2O (l) → CO (g) + 3H2 (g)
\({\Delta _r}H_{298}^0\) = 250kJ
- Phản ứng toả nhiệt (hệ toả nhiệt ra môi trường) thì \({\Delta _r}H_{298}^0\) < 0.
Ví dụ 2: C2H5OH(1) + 3O2 (g) → 2CO2 (g) + 3H2O (l)
\({\Delta _r}H_{298}^0\) = -1366,89 kJ
- Các phương trình hoá học của phản ứng trong Ví dụ 1 và 2 được gọi là phương trình nhiệt hoá học.
| Phương trình nhiệt hoá học là phương trình phản ứng hoá học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cd) và sản phẩm (sp). |
|---|
1.4. Enthalpy tạo thành (nhiệt tạo thành)
* Tìm hiểu enthalpy tạo thành
+ Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu \({\Delta _f}H\), thường tính theo đơn vị kJ/mol hoặc kcal/mol.
| Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất. |
|---|
- Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là \({\Delta _f}H_{298}^0\)
Ví dụ 3: \({\Delta _f}H_{298}^0\) (CO2, g) = -393,50 kJ/mol là lượng nhiệt toả ra khi tạo ra 1 mol CO2 (g) từ các đơn chất ở trạng thái bền ở điều kiện chuẩn (carbon dạng graphite, oxygen dạng phân tử khí chính là các dạng đơn chất bền nhất của carbon và oxygen).
C(graphite) + O2 → CO2 (g)
\({\Delta _f}H_{298}^0\) (CO2,g) = -393,50 kJ/mol
1.5. Ý nghĩa của dấu và giá trị \({\Delta _r}H_{298}^0\)
* Tìm hiểu về dấu và giá trị biến thiên enthalpy của phản ứng
Ví dụ 4: H2SO4 (aq) + 2NaOH (aq) → Na2SO4 (aq) + 2H2O(1)
\({\Delta _f}H_{298}^0\) = -11,68 kJ
.jpg)
Hình 13.5. Sơ đồ biểu diễn biến thiên enthalpy của phản ứng tỏa nhiệt
Ví dụ 5: Phản ứng nhiệt phân CaCO3
CaCO3 (s) → CaO (s) + CO2(g) \({\Delta _r}H_{298}^0\) = +178,49 kJ
- Khi than (C) hoặc ethanol (C,H,OH) muốn cháy trong không khí cần được đốt nóng, khi cháy phản ứng tỏa nhiệt và tự tiếp diễn mà không cần đốt nóng nữa.
- Nhưng phản ứng nung vôi cần cung cấp nhiệt liên tục, nếu | dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn.
|
- Phản ứng toả nhiệt: \(\sum {\Delta _f}H_{298}^0(sp) < \sum {\Delta _f}H_{298}^0(cd) \to {\Delta _r}H_{298}^0 < 0\) - Phản ứng thu nhiệt: \(\sum {\Delta _f}H_{298}^0(sp) > \sum {\Delta _f}H_{298}^0(cd) \to {\Delta _r}H_{298}^0 > 0\) - Thường các phản ứng có \({\Delta _r}H_{298}^0\) < 0 thì xảy ra thuận lợi. |
|---|
Bài tập minh họa
Bài 1: Hầu như mọi phản ứng hóa học cũng như quá trình chuyển thể của chất luôn kèm theo sự thay đổi năng lượng

Gas cháy sinh nhiệt

Nhiệt phân Cu(OH)2 tạo thành CuO
Trong cả 2 ví dụ đều có phản ứng xảy ra với sự thay đổi năng lượng. Theo em, phản ứng có kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng đóng vai trò gì trong đời sống?
Hướng dẫn giải
- Phản ứng có kèm theo sự thay đổi năng lượng dưới dạng nhiệt năng đóng vai trò quan trọng trong đời sống:
+ Cung cấp nhiệt cho các nhu cầu đun nấu thức ăn
+ Giảm nhiệt độ của môi trường xung quanh
Bài 2: Tính \({\Delta _r}H_{298}^o\) của hai phản ứng sau:
3O2(g) → 2O3(g) (1)
2O3(g) → 3O2(g) (2)
Liên hệ giữa giá trị \({\Delta _r}H_{298}^o\) với độ bền của O3, O2 và giải thích, biết phân tử O3 gồm 1 liên kết đôi O=O và 1 liên kết đơn O-O
Hướng dẫn giải
- Xét phản ứng: 3O2(g) → 2O3(g) (1)
\({\Delta _r}H_{298}^o\) = \(\Sigma \)Eb(cđ) - \(\Sigma \)Eb(sp)
→ \({\Delta _r}H_{298}^o\)(1) = 3. Eb(O2) – 2.Eb(O3)
= 3.Eb(O=O) – 2.(Eb(O=O) + Eb(O-O))
= 3.498 –2.(498 + 204) = 90 kJ/mol > 0
- Xét phản ứng: 2O3(g) → 3O2(g) (2)
\({\Delta _r}H_{298}^o\) = \(\Sigma \)Eb(cđ) - \(\Sigma \)Eb(sp)
→ \({\Delta _r}H_{298}^o\)(2) = 2.Eb(O3) - 3. Eb(O2)
= 2.(Eb(O=O) + Eb(O-O)) - 3.Eb(O=O)
= 2.(498 + 204) - 3.498 = -90 kJ/mol < 0
→ Phản ứng (1) xảy ra cần phải cung cấp năng lượng là 90 kJ/mol. Phản ứng (2) xảy ra tỏa ra năng lượng là 90 kJ/mol
→ Phản ứng (2) xảy ra thuận lợi hơn
→ Liên kết O3 bền hơn O2
Luyện tập Bài 13 Hóa 10 CTST
Sau bài học này, học sinh sẽ:
- Trình bày được khái niệm phản ứng toả nhiệt, thu nhiệt, điều kiện chuẩn (áp suất 1 bar và thường chọn nhiệt độ 25oC hay 298 K); enthalpy tạo thành (nhiệt tạo thành) \({\Delta _f}H_{298}^0\) và biến thiên enthalpy (nhiệt phản ứng) của phản ứng \({\Delta _r}H_{298}^0\).
- Nêu được ý nghĩa của dấu và giá trị \({\Delta _r}H_{298}^0\).
3.1. Trắc nghiệm Bài 13 Hóa 10 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Chân trời sáng tạo Bài 13 cực hay có đáp án và lời giải chi tiết.
-
Câu 1:
Chỉ ra ý kiến đúng?
- A. Tinh thể nguyên tử là tinh thể tạo bởi các nguyên tử nằm ở các nút mạng, liên kết với nhau bằng liên kết ion
- B. Các tinh thể nguyên tử đều có độ cứng nhỏ, nhiệt độ sôi và nhiệt độ nóng chảy thấp
- C. Liên kết trong tinh thể là liên kết kém bền
- D. Tinh thể nguyên tử là tinh thể tạo bởi các nguyên tử nằm ở các nút mạng, liên kết với nhau bằng liên kết cộng hóa trị
-
- A. Các nguyên tử I2 phân bố ở các đỉnh và tâm ở các mặt của hình lập phương
- B. Các phân tử I2 phân bố ở các đỉnh và tâm ở các mặt của hình lập phương
- C. Các phân tử I2 liên kết với nhau bằng liên kết cộng hóa trị
- D. Các nguyên tử I2 liên kết với nhau bằng lực tương tác yếu giữa các nguyên tử
-
Câu 3:
Nêu bản chất liên kết giữa X với oxi biết cation X+ có cấu hình electron phân lớp ngoài cùng là 3p6.
- A. vừa ion, vừa cộng hóa trị.
- B. cộng hóa trị phân cực.
- C. ion.
- D. cộng hóa trị không phân cực.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 13 Hóa 10 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 13 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 81 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 2 trang 81 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 81 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 3 trang 82 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 4 trang 82 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 5 trang 82 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 6 trang 83 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 7 trang 83 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 83 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 8 trang 84 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 9 trang 84 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 10 trang 84 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 11 trang 84 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 84 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 12 trang 85 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 13 trang 85 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 14 trang 85 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 86 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 1 trang 86 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 2 trang 86 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 4 trang 87 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.1 trang 52 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.2 trang 52 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.3 trang 52 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.3 trang 52 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.4 trang 52 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.5 trang 53 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.6 trang 53 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.7 trang 53 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.8 trang 53 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.9 trang 53 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.10 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.11 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.12 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.13 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.14 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.15 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.16 trang 54 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.17 trang 55 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.18 trang 55 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.19 trang 55 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 13.20 trang 55 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỏi đáp Bài 13 Hóa học 10 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





