Nội dung bài học chủ yếu đề cập đến tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu, và với axit); tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối); tính chất riêng của bazơ không tan trong nước (bị nhiệt phân huỷ).
Tóm tắt lý thuyết
1.1. Tác dụng với chất chỉ thị
- Quỳ tím hóa xanh .
- Phenolphtalin không màu thành đỏ.
- Các em chú ý quan sát hiện tượng xảy ra trên miếng quỳ trong thí nghiệm sau:
Video 1: Sự đổi màu của quỳ tím trong các môi trường axit, bazơ và nước
1.2. Tác dụng với oxit axit (tạo muối và nước)
- Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
- Thí nghiệm: Khí CO2 tác dụng với dung dịch Ca(OH)2
Video 2: Khí CO2 làm vẩn đục dung dịch nước vôi trong
- Hiện tượng: Khi sục khí CO2 vào dung dịch nước vôi trong thấy kết tủa trắng.
- Giải thích: Do phản ứng CO2 + Ca(OH)2 → CaCO3 (kết tủa trắng) + H2O
Ví dụ khác:
Ca(OH)2+ SO2 → CaSO3 + H2O
6KOH+ P2O5→2K3PO4+ 3H2O
1.3. Tác dụng với axit (tạo muối và nước)
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 2: Phản ứng giữa dung dịch Cu(OH)2 và H2SO4
- Hiện tượng: Cu(OH)2 tan dần và tạo dung dịch màu xanh
- Giải thích: Do xảy ra phản ứng H2SO4l+Cu(OH)2 → CuSO4 + 2H2O
Ví dụ khác:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Ba(OH)2+ 2HNO3→ Ba(NO3)2 + 2H2O
1.4. Bazơ không tan bị nhiệt phân huỷ (tạo oxit và nước)
- Các em chú ý quan sát thao tác thí nghiệm và hiện tượng phản ứng diễn ra:
Video 3: Phản ứng Nhiệt phân Đồng (II) hidroxit
- Hiện tượng: Cu(OH)2 chất rắn màu xanh chuyển dần thành bột màu đen
- Giải thích: Do xảy ra phản ứng
Cu(OH)2 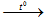
Màu xanh Màu đen
1.5. Tổng kết
Hình 1: Sơ đồ tư duy bài tính chất hóa học của bazơ
Bài tập minh họa
Bài 1:
Có những bazơ sau: NaOH, Cu(OH)2, Ba(OH)2. Hãy cho biết những bazơ nào: (viết PTHH minh họa nếu có)
a) Tác dụng được với dd HCl?
b) Bị nhiệt phân hủy?
c) Tác dụng được với CO2?
d) Đổi màu quì tím thành xanh?
Hướng dẫn:
a) Tác dụng được với dd HCl: NaOH, Cu(OH)2, Ba(OH)2
2NaOH (dd) + 2HCl (dd) → 2NaCl (dd) + H2O (l)
Cu(OH)2 (dd) + 2HCl (dd) → CuCl2 (dd) + 2H2O (l)
Ba(OH)2 (dd) + 2HCl (dd) → FeCl2 (dd) + 2H2O (l)
b) Bị nhiệt phân hủy: Cu(OH)2
Cu(OH)2 (r) .PNG)
c) Tác dụng được với CO2: NaOH, Ba(OH)2
2NaOH (dd) + CO2 (k) → Na2CO3 (dd) + H2O (l)
Ba(OH)2 (dd) + CO2 (k) → BaCO3 (dd) + H2O (l)
d) Đổi màu quì tím thành xanh: NaOH, Ba(OH)2
Bài 2:
Cần bao nhiêu ml dung dịch NaOH 0,75M để trung hoà 400ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M.
Hướng dẫn:
Đổi 400ml thành 0,4 lít
Số mol mỗi axit là:
\(\begin{array}{l} {n_{{H_2}S{O_4}}} = {C_M}.V = 0,4 \times 0,5 = 0,2(mol)\\ {n_{HCl}} = {C_M}.V = 0,4 \times 1 = 0,4(mol) \end{array}\)
Phương trình phản ứng:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,2 → 0,4 (mol)
HCl + NaOH → NaCl + H2O
0,4 → 0,4 (mol)
Số ml dung dịch NaOH 0,75M cần để trung hòa lượng axit trên là:
\({C_M} = \frac{n}{V} \Rightarrow V = \frac{n}{{{C_M}}} = \frac{{0,4 + 0,4}}{{0,75}} = 1,07(lit)\)
3. Luyện tập Bài 7 Hóa học 9
Sau bài học cần nắm:
- Tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu, và với axit)
- Tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối); tính chất riêng của bazơ không tan trong nước (bị nhiệt phân huỷ).
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 7 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. H2SO4
- B. NaCl
- C. Ca(OH)2
- D. K2SO4
-
- A. Zn(OH)2
- B. Fe(OH)2
- C. NaOH
- D. Al(OH)3
-
- A. CO2
- B. O2
- C. SO2
- D. Cả A , B và C
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 7.
Bài tập 1 trang 25 SGK Hóa học 9
Bài tập 2 trang 25 SGK Hóa học 9
Bài tập 3 trang 25 SGK Hóa học 9
Bài tập 4 trang 25 SGK Hóa học 9
Bài tập 5 trang 25 SGK Hóa học 9
Bài tập 7.1 trang 9 SBT Hóa học 9
Bài tập 7.2 trang 9 SBT Hóa học 9
Bài tập 7.3 trang 9 SBT Hóa học 9
Bài tập 7.4 trang 9 SBT Hóa học 9
Bài tập 7.5 trang 9 SBT Hóa học 9
4. Hỏi đáp về Bài 7 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.





.PNG)






