Bài thực hành rèn luyện các kĩ năng tiến hành thí nghiệm, quan sát hiện tượng phản ứng, giải thích và rút ra kết luận về những tính chất hóa học của Oxit và Axit
Tóm tắt lý thuyết
1.1. Kiến thức cần nắm
1.1.1. Thí nghiệm 1: Phản ứng của canxi oxit với nước
Ca(OH)2 tan ít trong nước, phần tan tạo thành dung dịch bazơ: CaO + H2O → Ca(OH)2
1.1.2. Thí nghiệm 2: Phản ứng của điphôtpho pentaoxit với nước
Điphôtpho pentaoxit với nước tạo thành dung dịch axit: P2O5 + H2O → H3PO4
1.1.3. Thí nghiệm: Nhận biết các dung dịch
- Rèn cách vẽ sơ đồ nhận biết
- Thao tác, trình tự thí nghiệm
1.2. Kĩ năng thí nghiệm
- Chú ý khi đun ống nghiệm trên ngọn lửa đèn cồn cần đun nóng toàn bộ ống nghiệm sơ qua trước sau đó mới tập trung đun ở phần dung dịch chứa trong ống nghiệm. Bởi vì ống nghiệm được làm bằng thủy tinh, sự chênh lệch nhiệt độ sẽ làm cho ống nghiệm bị vỡ.
- Khi sử dụng axit đặc, cần đeo bao tay, cẩn thận vì axit đặc rơi vào da gây bỏng nặng.
- Khi đun ống nghiệm có sử dụng kẹp thì nên kẹp ở 2/3 thân ống nghiệm tính từ đáy. Bởi vì trong phòng thí nghiệm thường sử dụng kẹp gỗ (dễ cháy), kẹp kim loại (truyền nhiệt làm bỏng tay)
Bài tập minh họa
2.1. Thí nghiệm 1: Phản ứng của canxi oxit với nước
- Các em chú ý thao tác tiến hành và hiện tượng xảy ra:
Video 1: Thí nghiệm phản ứng giữa CaO và nước
- Hiện tượng: Mẫu CaO nhão ra, phản ứng toả nhiệt. Thử dung dịch sau phản ứng bằng giấy qùy tím hóa xanh
- Giải thích: CaO tác dụng với nước tạo dung dịch bazơ làm quỳ tím hóa xanh
2.2. Thí nghiệm 2: Phản ứng của điphôtpho pentaoxit với nước
- Điphôtpho pentaoxit (P2O5) được tạo ả bằng cách đốt cháy Phopho đỏ trong oxi. Phản ứng xảy ra: 4P + 5O2 → 2P2O5
- Các em chú ý thao tác tiến hành và hiện tượng xảy ra:
Video 2: Thí nghiệm P2O5 và nước
- Hiện tượng: phôtpho nhỏ màu trắng tan tạo dung dịch trong suốt. Nhúng mẫu quì tím vào dung dịch làm quỳ hoá đỏ.
- Giải thích: P2O5 tan trong nước tạo dung dịch có tính axit P2O5 + 3H2O → 2H3PO4
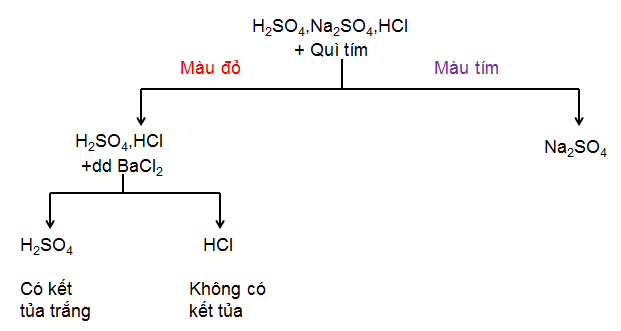
2.3. Thí nghiệm: Nhận biết các dung dịch
- Dung dịch gồm H2SO4 loãng, HCl , Na2SO4
- Cách tiến hành:
+ Nhận thấy 3 dung dịch gồm 2 axit và 1 muối ⇒ Dùng quỳ tím thì nhận biết được muối Na2SO4
+ 2 axit có 1 axit chứa gốc =SO4 nên có thể nhận biết bằng nguyên tử Bari chứa trong BaCl2 hoặc Ba(OH)2 đều được.
- Các em chú ý thao tác tiến hành và hiện tượng xảy ra:
Video 3: Nhận biết 3 dung dịch H2SO4 loãng, HCl , Na2SO4
Sơ đồ nhận biết:
Hình 1: Sơ đồ nhận biết H2SO4, HCl, Na2SO4
3. Luyện tập Bài 6 Hóa học 9
Sau bài học cần nắm: Kĩ năng tiến hành thí nghiệm, quan sát hiện tượng phản ứng, giải thích và rút ra kết luận về những tính chất hóa học của Oxit và Axit
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 6 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
-
A.
Niken
- B. Canxi
- C. Nhôm
- D. Sắt
-
A.
-
-
A.
Y, T, Z, X
- B. T, X, Y, Z
- C. Y, X, T, Z
- D. X, Y, Z, T
-
A.
-
-
A.
Quì tím
- B. dd NaOH
- C. dd Ba(OH)2
- D. dd BaCl2
-
A.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4. Hỏi đáp về Bài 6 chương 1 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.