Hướng dẫn giải bài tập SGK Hoá học 12 Bài 35 Đồng và hợp chất của Đồng giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức môn hoá.
-
Bài tập 1 trang 158 SGK Hóa học 12
Cấu hình electron của Cu2+ là:
A. [Ar]3d7.
B. [Ar]3d8.
C. [Ar]3d9.
D. [Ar]3d10.
-
Bài tập 2 trang 159 SGK Hóa học 12
Cho 19,2 gam kim loại M tác dụng với dung dịch HNO3 loãng, dư thu được 4,48 lít khí duy nhất NO (đktc). Kim loại M là:
A. Mg
B. Cu.
C. Fe.
D. Zn.
-
Bài tập 3 trang 159 SGK Hóa học 12
Cho 7,68 gam Cu tác dụng hết với dung dịch HNO3 loãng thấy có khí NO (sản phẩm khử duy nhất) thoát ra. Khối lượng muối nitrat sinh ra trong dung dịch là:
A. 21,56 gam.
B. 21,65 gam.
C. 22,56 gam.
D. 22,65 gam.
-
Bài tập 4 trang 159 SGK Hóa học 12
Đốt 12,8 gam Cu trong không khí, hòa tan chất rắn thu được trong dung dịch HNO3 0,5M thấy thoát ra 448ml khí NO duy nhất (đktc).
a) Viết phương trình phản ứng hóa học xảy ra.
b) Tính thể tích tối thiểu dung dịch HNO3 cần dùng để hòa tan chất rắn.
- VIDEOYOMEDIA
-
Bài tập 5 trang 159 SGK Hóa học 12
Hòa tan 58 gam muối CuSO4.5H2O vào nước được 500 ml dung dịch A.
a) Xác định nồng độ mol của dung dịch A?
b) Cho dần dần bột sắt vào 50 ml dung dịch A, khuấy nhẹ cho tới khi dung dịch hết màu xanh. Tính lượng sắt đã tham gia phản ứng?
-
Bài tập 6 trang 159 SGK Hóa học 12
Một thanh đồng có khối lượng 140,8 gam được ngâm trong dung dịch AgNO3 nồng độ 32% (D = 1,2 g/ml) đến phản ứng hoàn toàn. Khi lấy thanh đồng ra thì nó có khối lượng là 171,2 gam. Tính thể tích dung dịch AgNO3 đã dùng để ngâm thanh đồng (giả thiết toàn bộ lượng Ag tạo ra bám hết vào thanh đồng).
-
Bài tập 1 trang 213 SGK Hóa 12 Nâng cao
Phản ứng nào sau đây xảy ra?
A. Cu2+ + 2Ag → Cu + 2Ag+
B. Cu + Pb2+ → Cu2+ + Pb
C. Cu + 2Fe3+ → Cu2+ + 2Fe2+
D. Cu + 2Fe3+ → Cu2+ + 2Fe
-
Bài tập 2 trang 213 SGK Hóa 12 Nâng cao
Cho sơ đồ phản ứng sau: Cu + HNO3 → Cu(NO3)2 + NO + H2O
Sau khi lập phương trình hoá học của phản ứng, ta có số nguyên tử Cu bị oxi hoá và số phân tử HNO3 bị khử là:
A. 1 và 6
B. 3 và 6
C. 3 và 2
D. 3 và 8
-
Bài tập 3 trang 213 SGK Hóa 12 Nâng cao
a) Từ Cu và những hoá chất cần thiết khác, hãy giới thiệu các phương pháp điều chế dung dịch CuCl2. Viết các phương trình hoá học.
b) Từ hỗn hợp các kim loại Ag và Cu, hãy trình bày 3 phương pháp hoá học tách riêng Ag và Cu. Viết các phương trình hoá học.
-
Bài tập 4 trang 213 SGK Hóa 12 Nâng cao
Hỗn hợp bột A có 3 kim loại là Fe, Ag, Cu. Ngâm hỗn hợp A trong lượng dư dung dịch của một chất B, khuấy kĩ cho đến khi phản ứng kết thúc, nhận thấy chỉ có sắt và đồng trong hỗn hợp tan hết, khối lượng Ag đúng bằng khối lượng của Ag vốn có trong hỗn hợp.
a) Hãy dự đoán chất B.
b) Nếu sau khi phản ứng kết thúc, thu được khối lượng Ag nhiều hơn khối lượng Ag vốn có trong hỗn hợp A thì chất có trong dung dịch B có thể là chất nào? Viết tất cả các phương trình hoá học.
-
Bài tập 5 trang 213 SGK Hóa học 12 nâng cao
a. Cho một ít bột sắt vào dung dịch đồng (II) sunfat. nhận thấy màu xanh của dung dịch nhạt dần. Nhưng cho một ít bột đồng vào dung dịch sắt (III) sunfat nhận thấy màu vàng nâu của dung dịch nhạt dần và sau đó lại có màu xanh. Hãy giải thích hiện tượng và viết các phương trình hóa học.
b. Điện phân dung dịch đồng (II) sunfat bằng điện cực trơ (graphit) nhận thấy màu xanh của dung dịch nhạt dần cho đến không màu. Nhưng thay các điện cực graphit bằng các điện cực đồng, nhận thấy màu xanh của dung dịch hầu như không thay đổi. Hãy giải thích hiện tượng và viết các phương trình hóa học.
-
Bài tập 6 trang 213 SGK Hóa 12 Nâng cao
Hợp kim Cu-Al được cấu tạo bằng tinh thể hợp chất hoá học, trong đó có 13,2% Al về khối lượng. Hãy xác định công thức hoá học của hợp chất.
-
Bài tập 7 trang 213 SGK Hóa 12 Nâng cao
Hãy xác định hàm lượng Sn có trong hợp kim Cu-Sn. Biết rằng trong hợp kim này, ứng với 1 mol Sn thì có 5 mol Cu.
-
Bài tập 35.1 trang 83 SBT Hóa học 12
Trong phòng thí nghiệm, để điểu chế CuSO4 người ta cho Cu tác dụng với dung dịch nào sau đây
A. H2SO4 đậm đặc
B. H2SO4 loãng.
C. Fe2(SO4)3 loãng.
D. FeSO4 loãng.
-
Bài tập 35.2 trang 83 SBT Hóa học 12
Có các dung dịch: HCl, HNO3, NaOH, AgNO3, NaNO3. Chỉ dùng thêm chất nào sau đây để nhận biết các dung dịch trên
A. Cu.
B. Dung dịch Al2(SO4)3.
C. Dung dịch BaCl2.
D. Dung dịch Ca(OH)2.
-
Bài tập 35.3 trang 84 SBT Hóa học 12
Ba hỗn hợp kim loại (1) Cu-Ag, (2) Cu- Al, (3) Cu -Mg
Dung dịch của cặp chất nào sau đây để nhận biết các hỗn hợp trên
A. HCl và AgNO3
B. HCl và Al(NO3)3
C. HCl và Mg(NO3)3
D. HCl và NaOH
-
Bài tập 35.4 trang 84 SBT Hóa học 12
Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (Giả sử hiệu suất của các phản ứng là 100%) là
A. 24 g.
B. 26 g.
C. 28 g.
D. 30 g.
-
Bài tập 35.5 trang 84 SBT Hóa học 12
Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muôi khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
A. 26,8 g.
B. 13,4 g.
C. 37,6 g.
D. 34,4 g.
-
Bài tập 35.6 trang 84 SBT Hóa học 12
Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí O2 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
-
Bài tập 35.7 trang 84 SBT Hóa học 12
Cho sơ đồ chuyển hoá quặng đồng thành đồng:
CuFeS2 → X → Y → Cu
Hai chất X, Y lần lượt là
A. Cu2O, CuO.
B. CuS, CuO.
C. Cu2S, CuO.
D. Cu2S, Cu2O
-
Bài tập 35.8 trang 85 SBT Hóa học 12
Cho hỗn hợp Fe, Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa một chất tan và kim loại dư. Chất tan đó là
A. Cu(NO3)2.
B. HNO3.
C. Fe(NO3)2.
D. Fe(NO3)3.
-
Bài tập 35.9 trang 85 SBT Hóa học 12
Cho các phản ứng :
(1) Cu2O + Cu2S →
(2) Cu(NO3)2 →
(3) CuO + CO →
(4) CuO + NH3 →
Số phản ứng tạo ra kim loại Cu là
A. 2
B. 3
C. 1
D. 4
-
Bài tập 35.10 trang 85 SBT Hóa học 12
Nhận định nào sau đây không đúng ?
A. Cu là kim loại chuyển tiếp, thuộc nhóm IB, chu kì 4, ô số 29 trong bảng tuần hoàn.
B. Cu là nguyên tố s, có cấu hình electron : [Ar]3d104s1.
C. Cấu hình electron của ion Cu+ là [Ar]3d10 và Cu2+ là [Ar]3d9.
D. So với kim loại nhóm IA, liên kết trong đơn chất đồng vững chắc hơn.
-
Bài tập 35.11 trang 85 SBT Hóa học 12
Khi Cu phản ứng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của NaNO3 trong phản ứng là
A. chất xúc tác.
B. chất oxi hoá.
C. chất khử.
D. môi trường.
-
Bài tập 35.12 trang 85 SBT Hóa học 12
Trong không khí ẩm (có chứa CO2), kim loại Cu thường bị bao phủ bởi một lớp màng màu xanh là
A. CuCO3
B. CuSO4
C. Cu(OH)2
D. CuCO3.Cu(OH)2
-
Bài tập 35.13 trang 85 SBT Hóa học 12
Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH dư rồi thêm tiếp dung dịch NH3 dư vào 4 dung dịch trên thì số chất kết tủa thu được là
A. 1.
B. 2.
C.3
D. 4.
-
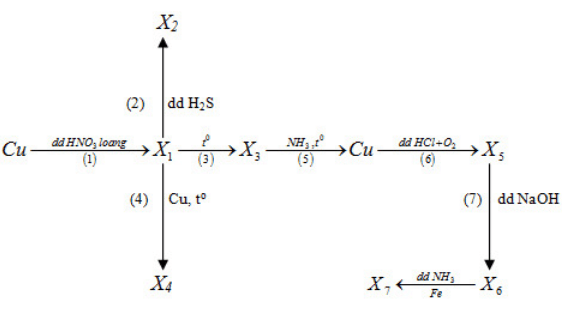
Bài tập 35.14 trang 86 SBT Hóa học 12
Cho sơ đồ sau :
Biết các chất từ X1 đến X7 đều là các hợp chất của đồng. Trong sơ đồ trên số phản ứng oxi hoá - khử là
A. 4
B. 5
C. 6
D. 7
-
Bài tập 35.15 trang 86 SBT Hóa học 12
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
A. 0,04.
B. 0,075.
C. 0,12.
D. 0,06.
-
Bài tập 35.16 trang 86 SBT Hóa học 12
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu đươc dung dich A và 224 ml khí NO duy nhât (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
A. 0,1M.
B. 0,25M.
C. 0,2M.
D. 0,5M.
-
Bài tập 35.17 trang 86 SBT Hóa học 12
Nguyên tử đồng có 1 electron ở lớp ngoài cùng nhưng tại sao đồng có hoá trị II ? Đồng tác dụng như thế nào với các axit ?
-
Bài tập 35.18 trang 86 SBT Hóa học 12
Bột đồng có lẫn tạp chất là bột thiếc, kẽm, chì. Hãy nêu phương pháp hoá học đơn giản để loại bỏ tạp chất. Viết phương trình hoá học của phản ứng dạng phân tử và ion thu gọn.
-
Bài tập 35.19 trang 86 SBT Hóa học 12
Malachit có công thức hoá học là CuCO3.Cu(OH)2. Trình bày các phương pháp điều chế Cu từ chất này.
-
Bài tập 35.20 trang 87 SBT Hóa học 12
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau
- Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H2
- Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2
Các thể tích khí đo ở đktc. Tính thành phần phần trăm khối lượng của từng kim loại trong hỗn hợp.
-
Bài tập 35.21 trang 87 SBT Hóa học 12
Thực hiện hai thí nghiệm :
1) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1M thoát ra V1 lít NO.
2) Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1M và H2SO4 0,5M thoát ra V2 lít NO.
Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Lập biểu thức biểu diễn mối quan hệ giữa V1 và V2.