Giải bài 2 tr 75 sách GK Hóa lớp 8
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2
a) Viết phương trình hóa học của phản ứng lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh đioxit tham gia phản ứng là 1,6 g. Hãy tìm:
- Thể tích khí lưu huỳnh đioxit sinh ra ở đktc
- Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí.
Hướng dẫn giải chi tiết bài 2
Câu a:
Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Câu b:
Số mol của S tham gia phản ứng:
nS = 16 : 32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
⇒ Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2 = 22,4.n = 22,4.0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . n = 22,4.0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
⇒ Vkk = 5.VO2 = 5.1,12 = 5,6 lít
-- Mod Hóa Học 8 HỌC247
Bài tập SGK khác
-


Cho 5,6 g sắt tác dụng hết với dung dịch axit clohiđric loãng thu được \({\text{FeC}}{{\text{l}}_{\text{2}}}\) và Hidro. Sau phản ứng thu được bao nhiêu lít khí Hidro (đktc)?
bởi Bao Nhi
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


ể thu được 2,24 lít CO2 (đktc) thì số mol \({\text{CaC}}{{\text{O}}_{\text{3}}}\) cần dùng là bao nhiêu?
bởi Nguyễn Anh Hưng
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V?
bởi Nguyễn Thanh Thảo
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
bởi Lam Van
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -
ADMICRO


Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a?
bởi Co Nan
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2. Biết khối lượng lưu huỳnh tham gia phản ứng là 1,6 gam. Tính khối lượng khí lưu huỳnh đioxit sinh ra.
bởi hi hi
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 27 gam Al trong khí oxi thu được Al2O3. Tính thể tích khí oxi (đktc) đã dùng trong phản ứng.
bởi Hong Van
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cacbon cháy trong khí oxi sinh ra khí cacbon đioxit. Tính thể tích khí (đktc) sinh ra, nếu có 8 gam khí oxi tham gia phản ứng.
bởi Nguyễn Thị An
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


a) Lập phương trình hóa học của phản ứng.
b) Tính khối lượng ZnO thu được?
Theo dõi (0) 1 Trả lời -


Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng ?
bởi Ngoc Tiên
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Hòa tan hoàn toàn một lá kẽm vào dung dịch axit clohidric (HCl) sau phản ứng thu được muối kẽm clorua và 4,48 lít khí hidro
bởi Nguyễn Hiền
 15/01/2021
15/01/2021
a, Viết phương trình phản ứng
b, Tính khối lượng axit clohidric đã dùng
c, Tính khối lượng kẽm clorua sinh ra sau phản ứng
Theo dõi (0) 1 Trả lời -


Cho 0,2 mol NaOH phản ứng với 0,2 mol \({{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\) thu được dung dịch A. Tổng khối lượng chất tan trong A là bao nhiêu?
bởi Nguyễn Minh Hải
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 15,3 gam \(A{l_2}{O_3}\) tác dụng với dung dịch chứa 39,2 gam \({{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\), sản phẩm của phản ứng là \({\text{A}}{{\text{l}}_{\text{2}}}{{\text{(S}}{{\text{O}}_{\text{4}}}{\text{)}}_{\text{3}}}\) và \({{\text{H}}_{\text{2}}}{\text{O}}\). Tính khối lượng \({\text{A}}{{\text{l}}_{\text{2}}}{{\text{(S}}{{\text{O}}_{\text{4}}}{\text{)}}_{\text{3}}}\) thu được.
bởi bach dang
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Hòa tan hết 21,6 gam hỗn hợp Mg và Fe trong dung dịch HCl thu được dung dịch muối và 11,2 lít khí H2 (đktc). Phần trăm khối lượng Mg?
bởi Lê Bảo An
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Hòa tan hết 17,05 gam hỗn hợp Al và Zn cần vừa đủ 124,1 gam dung dịch HCl 25% thu được dung dịch muối và khí không màu. Phần trăm khối lượng Zn trong hỗn hợp đầu?
bởi Song Thu
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cần dùng V lít hidro (đktc) để khử hoàn toàn hỗn hợp gồm 10,8 gam FeO và 24 gam \({\text{F}}{{\text{e}}_2}{O_3}\) thu được kim loại và \({{\text{H}}_{\text{2}}}{\text{O}}\)?
bởi thùy trang
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hỗn hợp chứa 4,48 lít CH4 và 2,24 lít C2H4 thì cần V lít O2 (đktc) thu được sản phẩm CO2 và nước. Giá trị của V?
bởi Lê Minh Bảo Bảo
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Nếu có 12g Mg tham gia phản ứng axit clohiđric , em hãy tìm: a) Thể tích khí hiđro thu được ở đktc. b) Khối lượng axit clohiđric cần dùng.
bởi Thùy Nguyễn
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc)?
bởi Mai Đào
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a?
bởi Phạm Khánh Linh
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Nung 6,72 g Fe trong không khí thu được sắt (II) oxit. Tính mFeO và VO2?
bởi Nguyễn Hoài Thương
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Tính số mol khí khi đốt cháy 11,2 l CH4 trong không khí thu được khí và nước?
bởi Thu Hang
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Xác định thể tích thu được khi cho 98 g H2SO4 loãng 20% phản ứng với thanh nhôm
bởi Minh Hanh
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Tính khối lượng oxi sau phản ứng khi cho 13,7 g Ba tác dụng với 3,2 g oxi thu được hợp chất oxit.
bởi Tra xanh
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho 5,6 g sắt tác dụng với dung dịch axit clohidric loãng thu được bao nhiêu ml khí Hidro?
bởi Lê Minh Hải
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Để thu dược 4,16 g BaCl2 cần bao nhiêu mol HCl?
bởi Nguyễn Tiểu Ly
 15/01/2021
15/01/2021
Ba + 2HCl → BaCl2 + H2
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Cho thanh magie cháy trong không khí thu được hợp chất magie oxit. Biết mMg = 7,2 g. Tính khối lượng hợp chất?
bởi Hữu Trí
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -

Tìm công thức hoá học của hợp chất 2?
bởi Võ Lê Anh Minh
 19/07/2020
19/07/2020
Hợp chất 1 có 2 nguyên tử C, 1 nguyên tử O, còn lại là nguyên tử H với %mH =9,091%. Hợp chất 2 có %m các nguyên tử giống hợp chất 1 nhưng Mhợp chất 2 = 88. (mình đã tìm được hợp chất 1 là C2H4O). Tìm công thức hoá học của hợp chất 2.
Thanks!
Theo dõi (0) 9 Trả lời -

 Cách giải bài toán bằng cách tính theo phương trình hóa gọc
Cách giải bài toán bằng cách tính theo phương trình hóa gọc Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


Cân bằng PTHH?
bởi Võ Lê Anh Minh
 08/07/2020
08/07/2020
Mình muốn nhờ các bạn giúp câu hỏi cân bằng PTHH này. Tuy đã biết câu trả lời nhưng mình chưa biết cách giải. Giúp mình với nhé!
Mg + HNO3 ===> Mg(NO3)2 + N2O + H2O
Thanks!
Theo dõi (1) 20 Trả lời -


Tính thể tích khí thoát ra khi cho 6,5g Zn tác dụng với 100g dung dịch HCl 14,6%?
bởi Nguyễn Ngọc Hạnh
 29/06/2020
29/06/2020
Bài toán: Hòa tan 6.5g kẽm vào ống nghiệm có chứa 100g dung dịch Hcl 14.6%
a, viết phương trình phản ứng xảy ra
b, tính thể tích khí thoát ra (đktc)
c, tính nồng độ phần trăm các chất trong dung dịch sau phản ứng.
(các bạn giúp mình với ạ)
Theo dõi (0) 4 Trả lời -


Tính thể tích khí H2 phản ứng tạo thành?
bởi Lissa H
 27/06/2020
27/06/2020
Cho so Fe+2HCL------>FEO2+H2 cho bt 11,2g FE tac dung voi dung dich HCL
a) Tinh kl FECL2 tao thanh
b) Tinh the tich H2 tao thanh o dktc
Lam giup em voi cam on truoc ne
 Theo dõi (1) 3 Trả lời
Theo dõi (1) 3 Trả lời -


Cho 9,2g Na vào nước dư thì thu được dung dịch NaOH và khí H2 tính thể tích khí H2 thoát ra và khối lượng NaOH tạo thành?
bởi NM Quách
 22/06/2020
22/06/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


dẫn 1/2 lượng khí thoát ra qua ống nghiệm chứa 8g Fe2O3, Tính khối lượng kim loại thu được?
bởi Phương Thanh
 22/06/2020
Cho a(g) Zn vào dung dịch HCl thoát ra 13,44l khí ở đktc a. Tính a b. Dẫn 1/2 lượng khí thoát ra qua ống nghiệm chứa 8g Fe2O3 . Tính khối lượng kim loại thu đượcTheo dõi (0) 0 Trả lời
22/06/2020
Cho a(g) Zn vào dung dịch HCl thoát ra 13,44l khí ở đktc a. Tính a b. Dẫn 1/2 lượng khí thoát ra qua ống nghiệm chứa 8g Fe2O3 . Tính khối lượng kim loại thu đượcTheo dõi (0) 0 Trả lời -

 Giải pt bốn bước gồm cacd. Bước nàoTheo dõi (0) 2 Trả lời
Giải pt bốn bước gồm cacd. Bước nàoTheo dõi (0) 2 Trả lời -


Hoà tan 11g hỗn hợp X gồm Al và Fe bằng dung dịch axit sunfuric loãng dư. Sau khi phản ứng kết thúc thu được 8,96 lít khí (đktc)?
bởi Lee Thuỳ Anh
 13/06/2020
a) Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp X b) Tính khối lượng muối khan thu được c) Lượng khí Hidro ở trên khử vừa đủ 23,2g oxit của kim loại M . Xác định công thức của oxit kim loại MTheo dõi (0) 0 Trả lời
13/06/2020
a) Tính thành phần % về khối lượng mỗi kim loại trong hỗn hợp X b) Tính khối lượng muối khan thu được c) Lượng khí Hidro ở trên khử vừa đủ 23,2g oxit của kim loại M . Xác định công thức của oxit kim loại MTheo dõi (0) 0 Trả lời -


A. 1,344 gam và 0,684 lít
B. 2,688 lít và 0,864 gam
C. 1,344 lít và 8,64 gam
D. 8,64 gam và 2,234 ml
Theo dõi (0) 2 Trả lời -


Đốt cháy 11,2 lít CH4 trong không khí thu được khí và nước. Xác định khí và cho biết số mol
bởi Nguyễn Thanh Trà
 29/05/2020
29/05/2020
A. CO và 0,5 mol
B. CO2 và 0,5 mol
C. C và 0,2 mol
D. CO2 và 0,054 mol
Theo dõi (0) 2 Trả lời -


Nhiệt phân 2,45 g KClO3 thu được O2. Cho Zn tác dụng với O2 vừa thu được. Tính khối lượng chất thu được sau phản ứng
bởi Nguyễn Thị Trang
 28/05/2020
28/05/2020
A. 2,45 g
B. 5,4 g
C. 4,86 g
D. 6,35 g
Theo dõi (0) 2 Trả lời -


Cho 8,45 g Zn tác dụng với 5,376 l khí Clo (đktc). Hỏi chất nào sau phản ứng còn dư
bởi hoàng duy
 29/05/2020
29/05/2020
A. Zn
B. Clo
C. Cả 2 chất
D. Không có chất dư
Theo dõi (0) 2 Trả lời -


Cho 98 g H2SO4 loãng 20% phản ứng với thanh nhôm thấy có khí bay lên. Xác định thể tích khí đó
bởi Chai Chai
 28/05/2020
28/05/2020
A. 4,8 lít
B. 2,24 lít
C. 4,48 lít
D. 0,345 lít
Theo dõi (0) 2 Trả lời -


Cho 13,7 g Ba tác dụng với 3,2 g oxi thu được hợp chất oxit. Tính khối lượng oxi sau phản ứng
bởi hi hi
 29/05/2020
29/05/2020
A. 3,2 g
B. 1,6 g
C. 6,4 g
D. 0,8 g
Theo dõi (0) 2 Trả lời -


Cho 5,6 g sắt tác dụng với dung dịch axit clohidric loãng thu được bao nhiêu ml khí H2
bởi Lê Thánh Tông
 28/05/2020
28/05/2020
A. 2,24 ml
B. 22,4 ml
C. 2,24.10−3 ml
D. 0,0224 ml
Theo dõi (0) 2 Trả lời -


A. 0,04 mol
B. 0,01 mol
C. 0,02 mol
D. 0,5 mol
Theo dõi (0) 2 Trả lời -


Cho phương trình CaCO3 → CO2 + H2O. Để điều chế 2,24lít CO2 thì số mol CaCO3 cần dùng là
bởi Lê Gia Bảo
 28/05/2020
28/05/2020
A. 1 mol
B. 0,1 mol
C. 0,001 mol
D. 2 mol
Theo dõi (0) 2 Trả lời -


Cho thanh magie cháy trong không khí thu được hợp chất magie oxit. Biết mMg = 7,2 g. Tính khối lượng hợp chất
bởi Nguyễn Thủy
 29/05/2020
29/05/2020
A. 2,4 g
B. 9,6 g
C. 4,8 g
D. 12 g
Theo dõi (0) 2 Trả lời -


Khi phân hủy thuốc tím KMnO4 (chất rắn, màu tím đậm) ở nhiệt độ cao, thuốc tím phân hủy thành kali mangannat K2MnO4 (rắn), mangan đioxit MnO2 (rắn) và khí oxi.
bởi Spider man
 20/05/2020
20/05/2020
a) Viết phương trình hoá học của phản ứng trên.
b) So sánh khối lượng của chất rắn thu được sau phản ứng với khối lượng của chất rắn ban đầu. Giải thích.
Theo dõi (0) 1 Trả lời -


Viết PTHH của phản ứng xảy ra?
bởi Phạm Bắc
 20/05/2020
20/05/2020
 Theo dõi (1) 2 Trả lời
Theo dõi (1) 2 Trả lời -


Tính khối lượng Al đã phản ứng?
bởi Nguyen Thom
 12/05/2020
Đun nóng KClO3 thu được 6,72 lít O2 a) Viết phương trình phản ứngb) Tính khối lượng KCl cần dùngc) O2 sinh ra đem đốt cháy Al. Tính khối lượng Al đã phản ứngTheo dõi (1) 0 Trả lời
12/05/2020
Đun nóng KClO3 thu được 6,72 lít O2 a) Viết phương trình phản ứngb) Tính khối lượng KCl cần dùngc) O2 sinh ra đem đốt cháy Al. Tính khối lượng Al đã phản ứngTheo dõi (1) 0 Trả lời -


Khí chủ yếu nào gây ra hiện tượng mưa axit?
bởi Đinh Thống
 07/05/2020
Giải như thế nàoTheo dõi (0) 1 Trả lời
07/05/2020
Giải như thế nàoTheo dõi (0) 1 Trả lời -


Viết phương trình hóa học xảy ra khi đốt cháy hoàn toàn 4,8 g lưu huỳnh trong bình đựng oxi ?
bởi Thảo Quế
 29/04/2020
29/04/2020
 Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -

 Cần điều chế 448 ml khí O2 ở đktc . Dùng chất nào để có số m nhỏ nhất? m là bao nhiêu? a. KClO3, b. KMnO4, c. HgOTheo dõi (0) 0 Trả lời
Cần điều chế 448 ml khí O2 ở đktc . Dùng chất nào để có số m nhỏ nhất? m là bao nhiêu? a. KClO3, b. KMnO4, c. HgOTheo dõi (0) 0 Trả lời -


Xác định khối lượng chất dư sau phản ứng?
bởi Phương Duyên
 12/04/2020
Mọi người giúp em với được không ạ?
12/04/2020
Mọi người giúp em với được không ạ? Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


A là kim loại hóa trị 2.Để oxi hóa hoàn toàn 20g chất A người ta dùng 9,6g oxi.Xác định tên kim loại A biết họ đã dùng oxi dư 20% so với lượng cần thiết?
bởi Trần Anh
 11/04/2020
11/04/2020
Help meeeeee
Theo dõi (0) 0 Trả lời -


Tính thể tích khí oxi tối thiểu (ở đktc) cần dùng để đốt hết 1,6g bột lưu huỳnh?
bởi Yeu Yeu
 08/04/2020
08/04/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Tính khối lượng KMnO4 cần thiết để điều chế một lượng khí oxi đủ để cháy hết :a) 0,05 mol CH4?
bởi phùng quang quân
 02/04/2020
02/04/2020
 Theo dõi (0) 2 Trả lời
Theo dõi (0) 2 Trả lời -


Hòa tan hoàn toàn 8,1g Al trong dung dịch H2SO4. Tính thể tích H2 thu được ở đktc; Tính khối lượng H2SO4 cần dùng?
bởi Hoàng Ngọc
 30/03/2020
30/03/2020
Hòa tan hoàn toàn 8,1g Al trong dd H2SO4 . Tính thể tích H2 thu được ở đktc ; Tính khối lượng H2SO4 cần dùng ? Biết Al+H2SO4 ----> Al2(SO4)3+H2
Theo dõi (0) 2 Trả lời -


Cho 23 gam Na tác dụng hết với H2O. Khối lượng m của NaHO thu được sau phản ứng là?
bởi Lệ Mỹ
 24/03/2020
24/03/2020
 Theo dõi (0) 3 Trả lời
Theo dõi (0) 3 Trả lời -


Tính khối lượng Fe để điều chế ,644g Fe3O4?
bởi anh thư
 24/03/2020
giải ra đáp án bài 4
24/03/2020
giải ra đáp án bài 4 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


So sánh đặc điểm khác nhau giữa phản ứng hóa hợp và phản ứng phân hủy?
bởi Doramon Doramon
 22/03/2020
22/03/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Cho 5,6 gam sắt tác dụng với dung dịch có chứa 0,4 mol axit clohiđric thu được muối sắt 2 clorua và hiđro?
bởi Doramon Doramon
 22/03/2020
Cho 5,6 gam sắt tác dụng với dung dịch có chứa 0,4mol axit clohiđric thu được muối sắt 2 clorua và hiđroTheo dõi (0) 0 Trả lời
22/03/2020
Cho 5,6 gam sắt tác dụng với dung dịch có chứa 0,4mol axit clohiđric thu được muối sắt 2 clorua và hiđroTheo dõi (0) 0 Trả lời -


Viết phương trình hoá học và tính phần trăm khối lượng mỗi kim loại trong hỗn hợp?
bởi phạm Hương
 20/03/2020
Giúp tớ với , tớ đang cần gấpTheo dõi (1) 1 Trả lời
20/03/2020
Giúp tớ với , tớ đang cần gấpTheo dõi (1) 1 Trả lời -


Lọc bỏ các chất rắn rồi đem cô cạn dung dịch thì thu được bao nhiêu gam muối khan?
bởi Thu Hà
 20/03/2020
Khi cho Al tác dụng với muối CuSO4 thu được Al2(SO4)3 và kim loại Cua. Viết PTHH b. Nếu cho 12,15g Al vào dung dịch có chứa 54g CuSO4. Chất nào còn dư sau phản ứng và có khối lượng là bao nhiêu? c. Lọc bỏ các chất rắn rồi đem cô cạn dung dịch thì thu được bao nhiêu gam muối khan?Theo dõi (0) 0 Trả lời
20/03/2020
Khi cho Al tác dụng với muối CuSO4 thu được Al2(SO4)3 và kim loại Cua. Viết PTHH b. Nếu cho 12,15g Al vào dung dịch có chứa 54g CuSO4. Chất nào còn dư sau phản ứng và có khối lượng là bao nhiêu? c. Lọc bỏ các chất rắn rồi đem cô cạn dung dịch thì thu được bao nhiêu gam muối khan?Theo dõi (0) 0 Trả lời -


Thể tích oxi cần dùng là?
bởi Phước Toàn
 13/03/2020
13/03/2020
Đốt cháy hoàn toàn 6, 72 lít khí C2H2 trong bình chứa khí oxi. Thể tích oxi cần dùng là:
Theo dõi (3) 6 Trả lời -


Hòa tan hoàn toàn 65g kẽm =dung dịch axit clohidric(HCl),phản ứng kết thúc thu được muối kẽmclorua (ZnCl2)và khí hidro?
bởi Ly Tran
 10/03/2020
HhhhhhhhhhjTheo dõi (0) 0 Trả lời
10/03/2020
HhhhhhhhhhjTheo dõi (0) 0 Trả lời -


Tính khối lượng FeSO4?
bởi Ly Khánh
 09/03/2020
09/03/2020
 Theo dõi (1) 1 Trả lời
Theo dõi (1) 1 Trả lời -


Xác định tên kim loại?
bởi Tín Nguyễn Trọng
 05/03/2020
Oxi hoá hoàn toàn 5,6g một kim loại chưa rõ hoá trị, sau phản ứng thu được 8g một oxit. Xác định kim loại đó.Theo dõi (0) 0 Trả lời
05/03/2020
Oxi hoá hoàn toàn 5,6g một kim loại chưa rõ hoá trị, sau phản ứng thu được 8g một oxit. Xác định kim loại đó.Theo dõi (0) 0 Trả lời -


Tính khối lượng sản phẩm (P2O5) tạo thành?
bởi Phạm Quynh Anh
 02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16)
02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16) Theo dõi (1) 1 Trả lời
Theo dõi (1) 1 Trả lời -


Tính thể tích khí oxi cần dùng (đktc) ?
bởi Phạm Quynh Anh
 02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16)
02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16) Theo dõi (1) 0 Trả lời
Theo dõi (1) 0 Trả lời -


Viết phương trình phản ứng ?
bởi Phạm Quynh Anh
 02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16)
02/03/2020
Đốt cháy hoàn toàn 6,2 gam photpho trong bình đựng khí oxi tinh khiết. a) Viết phương trình phản ứng ? b) Tính thể tích khí oxi cần dùng (đktc) ? c) Tính khối lượng sản phẩm (P2O5) tạo thành ? (P = 31, O = 16) Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -

 Đốt bột nhôm trong bình chứa khí clo,người ta thu được muối nhôm clorua alcl3.A,lập phương trình hóa học của phản ứng.B,Tính thể tích clo (đktc) cần dùng nếu có 1,35g nhôm tham gia phản ứng.C,Tính khối lượng và số phân tử muối nhôm clorua thu đượcTheo dõi (0) 0 Trả lời
Đốt bột nhôm trong bình chứa khí clo,người ta thu được muối nhôm clorua alcl3.A,lập phương trình hóa học của phản ứng.B,Tính thể tích clo (đktc) cần dùng nếu có 1,35g nhôm tham gia phản ứng.C,Tính khối lượng và số phân tử muối nhôm clorua thu đượcTheo dõi (0) 0 Trả lời -


Phân hủy 6,3g, KMnO4 thu đc bao nhiêu lít khí O2(đkc), tính khối lượng các sản phẩm?
bởi Phạm Nguyễn Tường Nguyên
 17/02/2020
17/02/2020
a)phân hủy 6,3g, KMnO4 thu đc bao nhiêu lít khí O2(đkc). tính khối lượng các sản phẩm
b) với lượng o2 trên có đủ để đốt 6,3 g photpho không?
Theo dõi (0) 0 Trả lời -


Cho 13,7 g a tác dụng với 3,2 g oxi thu được hợp chất oxi tính khối lượng oxi còn lại sau phản ứng?
bởi abc
 11/02/2020
JsjviddjjjvdjhvuddhvjsvjTheo dõi (0) 0 Trả lời
11/02/2020
JsjviddjjjvdjhvuddhvjsvjTheo dõi (0) 0 Trả lời -


Tính % khối lượng mỗi chất trong hỗn hợp đầu?
bởi Quang Hà
 07/02/2020
Cho hỗn hợp A (Al và Au) phản ứng với H2SO4 dư thu được 5,6 lít H2. Sau phản ứng có 3g chất rắn không tan. Tính % khối lượng mỗi chất trong hỗn hợp đầu. Biết cho A vào H2SO4 xẩy ra phản ứng: Al H2SO4--> Al2(SO4)3 H2Theo dõi (1) 0 Trả lời
07/02/2020
Cho hỗn hợp A (Al và Au) phản ứng với H2SO4 dư thu được 5,6 lít H2. Sau phản ứng có 3g chất rắn không tan. Tính % khối lượng mỗi chất trong hỗn hợp đầu. Biết cho A vào H2SO4 xẩy ra phản ứng: Al H2SO4--> Al2(SO4)3 H2Theo dõi (1) 0 Trả lời -


Hãy tính thể tích và khối lượng mỗi khí có trong 7,84 l khí A ở đktc?
bởi Nguyễn Hoàng Thảo
 27/01/2020
27/01/2020
Hỗn hợp khí A gồm khí H2 và CH4 có tỉ khối so với O2 là 0,25.Hãy tính thể tích và khối lượng mỗi khí có trong 7,84 l khí A ở đktc
Theo dõi (0) 1 Trả lời -


Tìm kim loại R?
bởi Sơn Nhung
 07/01/2020
Hoà tan hoàn toàn 7.56 gam kim loại R chưa rõ hoá trị vào dd HCl thu được 9.408 lit khí h2 ở đktc. Tìm kim loại R.E ra kết quả là Be và Al thì cái nào đúng ạTheo dõi (1) 7 Trả lời
07/01/2020
Hoà tan hoàn toàn 7.56 gam kim loại R chưa rõ hoá trị vào dd HCl thu được 9.408 lit khí h2 ở đktc. Tìm kim loại R.E ra kết quả là Be và Al thì cái nào đúng ạTheo dõi (1) 7 Trả lời -


Xác định công thức hóa học của sản phẩm tạo thành?
bởi Trâmm Võ
 02/01/2020
02/01/2020
Kim loại sắt hóa hợp với khí Oxi tạo ra 34,8g một oxit sắt có %mFe=72,41%
a.Xác định công thức hóa học của sản phẩm tạo thành.
b.Tính V khí Oxi (đktc) và khối lựơng sắt đã tham gia phản ứng
Theo dõi (0) 2 Trả lời -


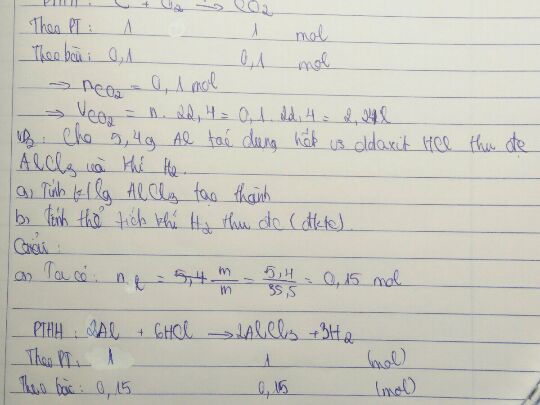 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính thể tích khí O2 tham gia phản ứng(đktc)?
bởi La Lisa
 28/12/2019
28/12/2019
cho m gam fe trong không khí thu được fe3o4 biết khi nung fe đã tác dụng với khí o2 /a. tính giá trị của x /b. tính vo2 tham gia phản ứng(đktc)
Theo dõi (0) 0 Trả lời -


Vì sao càng lên cao không khí càng loãng?
bởi Quỳnh Pham
 03/12/2019
Càng lên cao không khí càng loãng. Vì sao vậyTheo dõi (0) 5 Trả lời
03/12/2019
Càng lên cao không khí càng loãng. Vì sao vậyTheo dõi (0) 5 Trả lời -


Tính khối lượng Fe2O3 tham gia phản ứng?
bởi minhanh
 10/11/2019
người ta dùng h2 để khử a gam fe2o3 và thu được b gam fe cho lượng fe tác dụng với dung dịch h2 SO4 dư thu được 4,2 lít h2 ở điều kiện tiêu chuẩn tìm giá trị a và bTheo dõi (0) 0 Trả lời
10/11/2019
người ta dùng h2 để khử a gam fe2o3 và thu được b gam fe cho lượng fe tác dụng với dung dịch h2 SO4 dư thu được 4,2 lít h2 ở điều kiện tiêu chuẩn tìm giá trị a và bTheo dõi (0) 0 Trả lời -


Nếu cho 11,2g Fe tác dụng với 18,25g HCl, sau phản ứng sẽ thu được những chất nào?
bởi Lê Thanh Nhàn
 01/11/2019
Nếu cho 11,2g Fe tác dụng với 18,25g HCl, sau phản ứng sẽ thu được những chất nào? Bao nhiêu g?Theo dõi (0) 2 Trả lời
01/11/2019
Nếu cho 11,2g Fe tác dụng với 18,25g HCl, sau phản ứng sẽ thu được những chất nào? Bao nhiêu g?Theo dõi (0) 2 Trả lời -


Viết PTHH và tính số mol, số phân tử của NaOH đã cho?
bởi Dương Dương
 26/10/2019
26/10/2019
Cho 20g NaOH tác dụng với HNO3 dư
a/ Viết PTHH và tính số mol, số phân tử của NaOH đã cho?
b/ Tính số mol, khối lượng và số phân tử các chất tạo thành sau PƯ?
giải giùm mình, làm ơn giải chi tiết cho mình nha
cảm ơn nhiều ạ
Theo dõi (0) 0 Trả lời -

 Nung m (g) KMnO4 thu được V lít khí oxi ở đktc. Đem toàn bộ lượng khí oxi này để nung nóng 6,4g đồng thì thu được 7,6g chất rắn. Tính mTheo dõi (0) 0 Trả lời
Nung m (g) KMnO4 thu được V lít khí oxi ở đktc. Đem toàn bộ lượng khí oxi này để nung nóng 6,4g đồng thì thu được 7,6g chất rắn. Tính mTheo dõi (0) 0 Trả lời -


Xác định X biết cho m gam X tác dụng với HCl sinh ra V lít khí và cũng m gam X đun nóng phản ứng hết với V lít O2?
bởi Sang Thạch
 01/06/2019
01/06/2019
Hòa tan hoàn toàn m gam kim loại X bằng dung dịch HCl sinh ra V lít khí (đktc); Cũng m gam X khi đun nóng phản ứng hết với V lít khí O2 (đktc). Kim loại đó là
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho Fe tác dụng với H2SO4?
bởi Bi Ken
 10/05/2019
10/05/2019
Bài tập:Cho 22,4g Fe tác dụng vừa đủ với dung dịch axit H2SO4 có nồng độ 0,5M
a)Viết phương trình
b)Tính khí sinh ra
c)Tính thể tích dung dịch axit đã dùng để hoà tan hết lượng sắt trên
d)Nếu dẫn toàn bộ lượng khí thu được ở trên qua bình đựng 8g Đồng(II) oxit đun nóng thì thu được bao nhiêu gam chất rắn màu đỏ
Theo dõi (0) 2 Trả lời -


Xác định tên kim loại trong phản ứng oxi hóa?
bởi Lê Ngọc Anh
 30/04/2019
30/04/2019
Hoà tan hoàn toàn 10.2g một oxit kim loại hoá trị 3 cần 331.8g dung dịch H2SO4 thì phản ứng vừa đủ. Dung dịch sau phản ứng có nồng độ 10%.
a. Tìm tên kim loại.
b. Tính C% của dung dịch axit.Theo dõi (0) 1 Trả lời -


Cho 5 6g fe vào 100 g HCl .
a) Tính thể tích H2 thu đc ở đktc.
b) tính nồng độ phần trăm của dung dịch HCl .
c) Tính nồng độ phần trăm của muối sau phản ứng.
Theo dõi (0) 1 Trả lời -


Tính khối lượng Zn cần dùng để điều chế 1,12l H2 ?
bởi Anh Trần
 08/04/2019
08/04/2019
1. Chất hòa tan trong nước tạo dung dịch bazo nhưng không tạo khí là :
Na CaO P2O5 CuO
2. Cho 140kg vôi sống chứa 90% CaO tác dụng hết với nước thì khối lượng vôi tôi Ca(OH)2 thu được là bao nhiêu ?
3. Khối lượng Zn cần dùng để điều chế 1,12l H2 ở đktc là bao nhiêu ?
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho (Al, Fe) tác dụng với HCl ?
bởi Lê Nguyễn Hạ Anh
 09/04/2019
09/04/2019
Cho 11g hỗn hợp gồm Al và Fe tan hoàn toàn trong dung dịch HCl dư thu được 8.96 lít khí hiđro (đktc).
a. Viết các phương trình phản ứng xảy ra.
b. Tính phần trăm và khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
Theo dõi (0) 1 Trả lời -


Nêu các bước giải bài toán bằng phương trình hóa học?
bởi Mai Vàng
 09/04/2019
09/04/2019
PHƯƠNG TRÌNH HÓA HỌC : Có mấy bước để giải bài toán đó.
Bài tập 1: Hiđro clorua (HCl) là một chất khí được dùng để sản xuất axit clohiđric (một trong các axit được dùng phổ biến trong phòng thí nghiệm). Trong công nghiệp, hiđro clorua được điều chế bằng cách đốt khí hiđro trong khí clo. Tính thể tích khí clo (ở điều kiện tiêu chuẩn) cần dùng để phản ứng vừa đủ với 67,2 lít khí hiđro (ở điều kiện tiêu chuẩn) và khối lượng khí hiđro clorua thu được sau phản ứng. Nêu các bước giải bài toán tính theo phương trình hóa học.
Saccarozơ (C12H22O11) là thành phần chính của đường kính (loại đường phổ biến nhất), saccaroơ có nhiều trong cây mía, củ cải đường và hoa thốt nốt, nó được ứng dụng nhiều trong công nghiệp thực phẩm (làm bánh, kẹo, nước giải khác,....). Hãy tính thành phần phần trăm theo khối lượng của các nguyên tố có trong phân tử saccaroơ.
Bài tập 3: Chất khí X có trong thành phần của khí hóa lỏng,dùng cho bếp gas để đun nấu.... Khí X có thành phần phần trăm về khối lượng các nguyên tố như sau: 81,82o/oC; 18,18o/oH. Xác định công thức hóa học của X, biết khí X nặng hơn khí hiđro 22 lần.
Bài tập 4: Lưu huỳnh cháy trong không khí tạo ra khí sunfurơ (SO2).Đây là một chất khí độc, có mùi hắc, gây ho và là một trong các khí gây ra hiện tượng mưa axit. a) Viết phương trình hóa học của phản ứng xảy ra. b) Tính thể tích khí SO2 tạo ra và thể tích không khí cần dùng để đốt cháy hết 3,2 gam lưu huỳnh (biết các thể tích khí đo ở điều kiện tiêu chuẩn; trong không khí oxi chiếm 20o/o về thể tích). Mk đg cần gấp giúp mk nha. Mk đg cần rất gấp.
Theo dõi (0) 1 Trả lời -


Tìm V biết 5,4 g Al tác dụng vừa đủ với V lít khí Cl2?
bởi Sam sung
 10/04/2019
10/04/2019
cho 5,4 g Al tác dụng vừ đủ với V lít khí Cl2 ở đktc tạo ra AlCl3. tìm V . tìm khối lượng sản phẩm
Theo dõi (0) 1 Trả lời -


cho 6.5 gam kẽm tác dụng vừa đủ với dd HCl 1M
a. viết PTHH
b.tính thể tích khí hiđrô thu được (đktc)
c tính thể tích dd HCl 1M đã dùng
Theo dõi (0) 1 Trả lời -


Tính VH2 khi cho 5,6g Fe tác dụng với 300ml HCl và 1M?
bởi My Hien
 11/04/2019
11/04/2019
cho 5,6g Fe tác dụng vs 300ml HCl và 1M , tạo ra muối và H2. lượng khí H2 đó tiếp tục tác dụng vs 16g Fe2O3 tạo ra sản phẩm
a) tính thể tích H2 (đktc)
b) tính khối lượng sản phẩm tạo thành
Theo dõi (0) 1 Trả lời -


1/ cho m gam Al phản ứng vừa đủ vs dung dịch axit sunfuric thu được 6,84 gam muối và v lít H2 ở đktc
a/ tính khối lượng axit đã phản ứng
b/ tính m và v
2/ viết công thức hóa học của các muối tạo nên từ kim loại kali vs các gốc axit đã cho
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho 6,9g Na vào 90g H2O?
bởi Nguyễn Hiền
 11/04/2019
11/04/2019
cho 6,9 gam Na vào 90 gam nước lấy dư, sau phản ứng hoàn toàn. viết PTHH của phản ứng và tính nồng độ phần trăm của dung dịch thu được
Theo dõi (0) 1 Trả lời -


cho 2,4 g Mg vào dung dịch HCL dư .Tính thể tích hidro thu đc ở đ/k chuẩn (chonMg=24)
Theo dõi (0) 1 Trả lời -


Tính thể tích H2 thoát ra khi cho 4g kim loại tác dụng với 170ml HCl 2M?
bởi Nguyễn Quang Minh Tú
 11/04/2019
11/04/2019
hòa tan hoàn toàn 4g Hỗn hợp gồm kim loại hóa trị II và 1 kim loại hóa trị III cần dùng hết 170ml đ HCl 2M
a) tính thể tích H2 thoats ra ( đktc)
b) cô cạn dd thu đc bao nhiêu gam muối khan
c) nếu biết kim laoij hóa trị III là Al và số mol bằng 5 lần số mol kim laoij hóa trị II thì kim loại hóa trị II là kim loại nào
Theo dõi (0) 1 Trả lời -


Cho 32,5 gam kẽm tác dụng vừa đủ với 150g dung dịch HCl. Thì thu được muối kẽm clorua và khí hidro thoát ra (đktc)
a) Viết pt phản ứng
b) Tính khối lượng muối kẽm clorua
c) Tính thể tích khí hidro sinh ra
d) Tính nồng độ phần trăm dung dịch muối thu được
Theo dõi (0) 1 Trả lời -


Cho 13 gam kẽm hòa tan trong dung dịch HCl dư
a, Tính thể tích H2 thoát ra(đktc)
b,Lượng dung dịch HCl cần dùng là bao nhiêu biết C% bằng 20%
Theo dõi (0) 1 Trả lời -


Tính khối lượng kim loại thu được sau phản ứng khi cho 6,5g Zn vào CuSO4?
bởi Bình Nguyen
 11/04/2019
11/04/2019
cho 6,5g bột kẽm vào dung dịch CuSO4 .Tính khối lượng kim loại thu được sau phản ứng
help me mai có tiết r
Theo dõi (0) 1 Trả lời -


5) Cho 5,6 gam Fe tác dụng hết với dd HCl 14,6 % a) phản ứng trên thuộc loại gì ? b) Tính khối lượng của dung dịch HCl đã dùng và thể tích H2 thu được
Theo dõi (0) 1 Trả lời -


Tính khối lượng A thu được khi cho H2 tác dụng với 16 gam CuO nung nóng, H%=70%?
bởi Trieu Tien
 11/04/2019
11/04/2019
Cho luồng khí H2 đi qua ống chứa 16 gam CuO nung nóng với H% = 70% thu được hỗn hợp chất rắn A. Tính khối lượng chất rắn A.?
Theo dõi (0) 1 Trả lời -


Tính m mỗi kim loại trong hỗn hợp biết cho 11g (Al, Fe) vào HCl thu được 8,96 l khí H2?
bởi A La
 11/04/2019
11/04/2019
cho 11 g hỗn hợp Al và Fe tan hoàn toàn trong dung dịch HCl dư thu được 8,96 l khí H2 ( đkc) . tính khối lượng mỗi kim loại trong hỗn hợp .
Theo dõi (0) 2 Trả lời -


Tính VH2 thoát ra khi hòa tan 12g Mg trong HCl?
bởi Mai Anh
 11/04/2019
11/04/2019
HÒA tan hoàn toàn 12 gam magie trong dung dịch clohidro:Tính
a thể tích khí hidro thoát ra ở đktc
b khối lượng magie clorua thu được
Theo dõi (0) 1 Trả lời -


Tính VO2 khi nhiệt phân hoàn toàn 40g CaCO3?
bởi My Le
 12/04/2019
12/04/2019
Nhiệt phân hoàn toàn 40g \(CaCO_3\)
\(CaCO_3\rightarrow CaO+CO_2\)
Tính \(V_{CO_2}\)(đktc)
Theo dõi (0) 1 Trả lời -


cho 20,4 g dung dịch mươi ZnCL2 tác dụng với 22,4g dung dịch KOH
a. tính số lượng kết tủa thu được
b. sau phản ứng chất nào chừa dư bao nhiêu gam
Theo dõi (0) 1 Trả lời -


Tính a biết khi hòa tan a gam nhôm bằng dung dịch H2SO4 2M thì thu được 6,72(l) H2?
bởi Nguyễn Anh Hưng
 12/04/2019
12/04/2019
hòa tan A gam nhôm bằng dung dịch H2SO4 2M ( vừa đủ ). Sau phản ứng thu đc 6,72 lít khí ở đktc
a, tính gía trị của A
b, tính thể tích dd H2SO4đã dùng
giúp với ạ, 12:45 em đi học rồi plssssTheo dõi (0) 1 Trả lời -


Tính % khối lượng kim loại biết hòa tan 12,4g (Na, K) vào 500g H2O thu được 4,48(l) H2?
bởi Nguyễn Lệ Diễm
 12/04/2019
12/04/2019
1) Hòa tan hoàn toàn 12,4 gam hỗn hợp Na và K trong 500gam H2O thu được 4,48 lít khí ở dktc
a) Tính thành phần % theo khối lượng của mỗi kim loại có trong hỗn hợp ban đầu
b) Tính nồng độ % của chất có trong dung dịch sau phản ứng
2) Cho 800 ml dung dịch HCl 1M tác dụng hết với A gam hỗn hợp Fe, Al thu được 8,96 lít khí ở dktc
a) Tính A
b) Tính nồng độ mol của muối có trong dung dịch sau phản ứng ( cho rằng thể tích thay đổi không đáng kể)
GIÚP MÌNH VỚI!!! THANKS TRƯỚC NHÉ <3
Theo dõi (0) 1 Trả lời -


Tính VHCl 1M cần dùng để trung hoà 16g NaOH?
bởi Lê Minh
 12/04/2019
12/04/2019
-Một dd chứa 16g NaOH. tính thể tích dd HCl 1M cần dùng để trung hoà dd trên
- Cho 1 mẩu quỳ tím vào dd NaOH nói trên rồi nhỏ từ từ HCl vào dd đó tới dư. Hãy cho biết hiện tượng quan sát được. Giải thích
Theo dõi (0) 1 Trả lời -


Xác định tên kim loại biết hòa tan 3,6g kim loại hóa trị 2 bằng HCl thu được 3.36(l) H2?
bởi Trịnh Lan Trinh
 12/04/2019
12/04/2019
hòa tan hoàn toàn 3,6 g kim loại hóa trị 2 bằng dung dịch axit clohidric thu đc 3.36 l khí đktc. xác định kim loại đã dùng
Theo dõi (0) 2 Trả lời -


Xác định tên kim loại biết để hòa tan 8g oxit của kim loại hóa trị II cần dùng 200ml HCl 1M?
bởi Nguyễn Thanh Thảo
 12/04/2019
12/04/2019
hòa tan hoàn toàn 8 g oxit của kim loại hóa trị 2 cần dùng 200 ml dung dịch 1M. xác định kim loại và oxit tương ứng
Theo dõi (0) 1 Trả lời -


Phân hủy 53g natri cacbonat.
a) Tính khối lượng chất rắn thu đc sau phản ứng
b) Tính V khí thu được( đktc)
Theo dõi (0) 1 Trả lời -


Mọi ng giúp e với ạ!E cảm ơn nhiều
Cho các kim loại Na,Ca lần lượt tác dụng với nước.Để thu được cùng một thể tích khí hidro thì kim loại nào đã phản ứng với khối lượng nhỏ nhất.
Theo dõi (0) 1 Trả lời -


Tính V biết đốt cháy V lít khí H2 bằng khí O2 thu được 3,6ml H2O ở 4 độ C?
bởi Choco Choco
 16/04/2019
16/04/2019
Đốt cháy hoàn toàn V lít khí H2 ở đktc bằng khí O2 sau phản ứng rồi làm lạnh sản phẩm thu được 3,6ml H2O ở 4*C. Gía trị của V là?
Theo dõi (0) 1 Trả lời -


Cho một lượng kẽm dư vào 50ml dung dịch HCL thu được 22,4 l khí hidro
a tính khối lượng kẽm tham gia phản ứng
B xác định nồng độ mol củ HCL
C tính thể tích dung dịch KOH 1 M cần đung để trung hòa ãit HCL trên
Theo dõi (0) 1 Trả lời -


Để đốt cháy 4,8g Mg cần bao nhiêu (l) O2?
bởi Mai Bảo Khánh
 16/04/2019
16/04/2019
Đốt cháy hoàn toàn 4,8g Mg
a) Cần bao nhiêu (l) O2 ở đktc? Sinh ra bao nhiêu g MgO?
b) Nếu sau PƯ tạo thành 16g MgO thì có bao nhiêu gam Mg PƯ?
Theo dõi (0) 1 Trả lời -


Tính m1 và m2 biết hòa tan m1 gam bột Zn vào m2 gam HCl 14.6% thu được 8,96(l) H2?
bởi Tay Thu
 16/04/2019
16/04/2019
Hòa tan m1 gam bột Zn vào m2 gam dung dịch 14.6 phần trăm vừa đủ, thu được 8,96 lít khí \(H_2\) (ở ĐKTC)
a) Tính m1 và m2
b) tính nồng độ phần trăm của dung dịch thu được sau phản ứng
Theo dõi (0) 1 Trả lời -


Đốt 11 lít khí A cần 5 lít khí oxi sau phản ứng thu được 3 lít khí CO2 và 4 lít H2O . Xác đinhm CTPT của A
Theo dõi (0) 1 Trả lời -


Đốt cháy 6,2g P thu được a(g) điphotphopenta oxit(P2O5) . Tính a
Theo dõi (0) 1 Trả lời -


Tính khối lượng axit đã phản ứng khi cho 7g canxi oxit tác dụng với axit nitric?
bởi Nguyễn Tiểu Ly
 17/04/2019
17/04/2019
Cho 7 g canxi oxit tác dụng với axit nitric có dư . Tính khối lượng axit đã phản ứng và khối lượng muối tạo thành.
Theo dõi (0) 1 Trả lời -


Tính m HCl đã dùng biết khi hòa tan Zn vào HCl thì thu được ZnCl2 và 14,33(l) H2?
bởi Hương Lan
 17/04/2019
17/04/2019
1) người ta điều chế vôi sống bằng cách nung đá vôi lượng vôi sống thu đc 90% đá vôi 9.5tấn. tính PƯ hiệu suất.
2) hòa tan hoàn toàn 1 lá Zn và HCl sau PƯ thu đc ZnCl và 14,33lít H2 (đktc)
a) mHCl=? b)mZnCl2=? c) nếu H%= 80% hãy tính mHCl và Zn tham gia
Theo dõi (0) 1 Trả lời -


Tính thể tích H2 và khí O2 cần thiết để tác dụng với nhau tạo thành 1,8 gam H2O?
bởi Naru to
 17/04/2019
17/04/2019
Tính thể tích khí hiđro và khí oxi ( đktc ) cần thiết để tác dụng với nhau tạo thành 1,8 gam H2O .
Theo dõi (0) 1 Trả lời -


Tính VH2 sinh ra khi cho 67,2g Zn vào dung dịch HCl?
bởi minh dương
 17/04/2019
17/04/2019
Cho sơ đồ sau:
Zn + HCl -----> ZnCl2 + H2
a) Tính thể tích H2 sinh ra (đktc) khi cho 67,2g Zn vào dung dịch HCl
b) Khi cho 25,2g Fe tác dụng vs axit. Tính khối lượng HCl tham gia và thể tích H2 sinh ra (đktc)
c) Muốn thu 26,88l H2 (đktc) cần phải dùng khối lương HCl bao nhiêu?
GIÚP MK VS
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Cho 5,6g Fe tác dụng hết với HCL thu được FeCL2 và khí H2. A) viết pthh xảy ra.. B) tính số mol các chất trong phản ứng... C) tính thể tích hidro thoát ra ở dktc.... M.n giúp mk giùm ạ mk ms hc mol còn chưa qen
Theo dõi (0) 1 Trả lời -


cho 5,4g Al vào 500ml dd NaOH 1M được dd A và V1 lít H2
a;Tính V1 và CM dd A
b;Cho V2 lít dd HCl 1M vào dd A
+Tính V để m kết tủa max
(Mọi người nghĩ kết tủa ở câu b là j là dc thôi,còn lại để em tự làm)
Theo dõi (0) 1 Trả lời -


Cho 11,2 g Fe vào 400g dung dịch H2SO4 9,8%
a.Chất nào còn thừa và thừa bao nhiêu g
b.Tính C% của dung dịch thu được sau phản ứng
Theo dõi (0) 1 Trả lời -


Tính VCO2 thu được khi đốt cháy 18g C trong không khí?
bởi Bo Bo
 23/04/2019
23/04/2019
Đốt cháy hoàn toàn 18g cacbon trong k2 thu được khí co2
A.tính tt khí co2 thu được ở đkp
B.tính tt ko khí cần dùng.biết oxi chiếm 1 phần 5 tt ko khí
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn 5.6l khí axêtilen ở đktc trong k2 thu được sp co2 và nước
A.tính tt co2 thuđược ở đktc
B.tính tt k2 cần dùng biết o2 chiếm 1 phần 5 tt k2
Theo dõi (0) 1 Trả lời -


Tính VCO2 thu được khi cho Na2CO3 tác dụng với HCl?
bởi Tran Chau
 23/04/2019
23/04/2019
Cho 10.6g natri cacbonat vào dung dịch axit cloric thu được natri clorua, khí co2 và nước
A.tính tt khí co2 thu được ở đktc
B.tính kl natri clorua tạo thành
C. Tính kl axit cloric cần dùng
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho H2SO4 tác dụng với NaOH?
bởi Nguyễn Quang Minh Tú
 23/04/2019
23/04/2019
Trung hòa 20ml dd H2SO4 1M bằng dd NaOH 20%
a. Viết PTHH
b. Tính khối lượng dd NaOH can dùng
c. Nếu trung hòa dd H2SO4 trên bang dd KOH 5.6% ( D= 1.045g/ml) thì cân bao nhiêu ml dung dịch KOH
Theo dõi (0) 1 Trả lời -


bột nhôm cháy trong oxi tao ra nhôm oxit, khối lượng nhôm đã phản ứng là 54g, khối lượng nhôm oxit sinh ra 102g. Khối lượng oxi đã phản ứng là gì ?
Theo dõi (0) 1 Trả lời -


cho kim loại nhôm phản ứng vừa đủ với 7,3g axit clohidric HCL, sau phản ứng thu được 8,9g chất nhôm clorua (AlCl3) và giải phóng 0,2g khí H2. Tính khối lượng kim loại nhôm đã tham gia phản ứng.
Theo dõi (0) 1 Trả lời -


Tính V HCl thu được khi cho 2,8g Fe vào dung dịch HCl 2M?
bởi het roi
 23/04/2019
23/04/2019
Hòa tan 2,8g Fe vào dung dịch HCl 2M vừa đủ
a. Tính thể tích HCl
b. Tính thể tích khí thoát ra (ĐKTC)
c. Tính nồng độ mol của dung dịch sau phản ứng
Giúp em với ạ. Em cảm ơn nhiều ạTheo dõi (0) 1 Trả lời -


Xác định X biết 4,8g X tác dụng đủ với 200ml HCl 2M?
bởi thuy tien
 23/04/2019
23/04/2019
Hòa tan hoàn toàn 4,8g kim loại X cần dùng vừa đủ 200ml dung dịch HCl 2M. xác định kim loại X
Theo dõi (0) 1 Trả lời -


Cần dùng bao nhiêu g quặng pirit sắt cso chứa 90% FeS2 dể khi đốt cháy sinh ra 80g Fe2O3 . Biết H% = 80 %
Theo sơ đồ sau : FeS2 + O2 -------> Fe2O3 + SO2
Theo dõi (0) 1 Trả lời -


Tính m đá vôi đã dùng biết nung 170kg đá vôi được 84kg vôi sống và 66kg CO2?
bởi trang lan
 23/04/2019
23/04/2019
Nung nóng 170 kg đá vôi thu được 84 kg vôi sống và 66 kg khí cacbonic. Tính khối lượng đá vôi đem nung - Tính khối lượng tạp chất và % tạp chất.
Theo dõi (0) 1 Trả lời -


Cho 22,2 g \(CaCl_2\) , tác dụng vừa đủ với \(AgNO_3\)
a) Tính khối lượng \(AgNO_3\)
b) tính khối lượng các chất còn lại trong phản ứng
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho Zn tác dụng với HCl?
bởi Bin Nguyễn
 24/04/2019
24/04/2019
ngâm một lá kẽm vào dd HCl , chờ phản ứng xong lấy lá kẽm rửa sạch lao khô cân thì thấy khối lượng lá kẽm giảm 3.25 g.
a) viết PTHH
b)tính khối lượng kẽm clorua
c) tính thể tích của khí \(H_2\)
Theo dõi (0) 1 Trả lời -


Cho 19,5g một kim loại X hóa trị II tác dụng với axit clohiđric có dư, tạo ra được 40g muối clorua và 0,6g khí hiđro.
a, Xác định khối lượng HCl đã phản ứng
b, Xác định kim loại X
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho kẽm tác dụng với dung dịch HCl?
bởi Bo Bo
 24/04/2019
24/04/2019
Cho 13 gam Kẽm vào dung dịch HCL có trong ống nghiệm
a) Viết phương trình hóa học xẩy ra
b) Tính thể tích
Làm ơn cứu mới
 .tặng lời cảm ơn một cách chân thành nhất cho ai trả lời được
.tặng lời cảm ơn một cách chân thành nhất cho ai trả lời được
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


A là hợp chất khí so với hidro là 17 , đốt cháy hoàn toàn 4,48 lít khí A ở đktc thì thu được 12.8 khí lưu quỳnh dioxit và 3.6g nước
a/ xác định công thức hóa học của A
b/ phải dùng bao nhiêu g kali MKcl03 để điều chế trênoxi cho thí ngiệm
Theo dõi (0) 1 Trả lời -


Tính mH2SO4 đã dùng để phản ứng với 10,8g Al?
bởi Bánh Mì
 24/04/2019
24/04/2019
cho 10,8 (g) Al t/d vơi dung dịch H2SO4 thu được Al2(SO4)3 và H2
a. tính Khối lượng H2SO4 đã dùng
b. tính Thể tích H2 (đktc)
c. tính mAl2(SO4)3 tạo thành theo 2 cách
Theo dõi (0) 1 Trả lời -


Bài 1:Điện phân 0,225 lít nước (D = 1 g/ml) thu được khí hidro và khí oxi. Khí hidro sinh ra cho phản ứng hoàn toàn với CuO dư nung nóng thu được 640 gam Cu. Tính hiệu suất phản ứng khử đồng CuO
Bài 2: Hòa tan hoàn toàn 2(g) hh một KL hóa trị II và một KL hóa trị III cần dùng 31,025 g d2 HCl 20%
a) Tính thể tích khí H2 thoát ra ở đktc
b) Tính khối lượng muối khan tạo thành
Theo dõi (0) 1 Trả lời -


Viết PTHH khi cho Zn tác dụng với H2SO4?
bởi Nguyễn Thị Thúy
 24/04/2019
24/04/2019
cho 6,5 gam Zn hòa tan vàodung dịch chứa 0,2 mol H2SO4
a) viết phản ứng hóa học
b) chất nào dư? khối lượng là bao nhiêu?
c) tính thể tích khí H2thu được
Theo dõi (0) 1 Trả lời -


Tính m khi cho 11,2g Fe vào HCl và m(g) Al vào H2SO4 biết Fe, Al ở vị trí cân bằng?
bởi bala bala
 08/04/2019
08/04/2019
Đặt cốc A đựng dung dịch HCl và cốc B đựng dung dịch H2SO4 loãng vào 2 đĩa cân sao cho cân ở vị trí cân bằng. Sau đó làm thí nghiệm như sau:
- Cho 11,2g Fe vào cốc đựng dung dịch HCl.
- Cho m gam Al vào cốc đựng dung dịch H2SO4.
Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m?Theo dõi (0) 1 Trả lời -


Tính % hỗn hợp đầu biết cho 11g Al, Fe tác dụng với HCl tạo thành 8,96 lít H2?
bởi can chu
 25/04/2019
25/04/2019
Cho 11 g dung dịch Al và Fe tác dụng vừa đủ với HCl tạo thành 8,96 lít H2 thoát ra (đktc).Tính thành phần % theo khối lượng có trong hỗn hợp ban đầu
Theo dõi (0) 1 Trả lời -


Tính V không khí cần dùng để đốt cháy 11,5g Na?
bởi Nhat nheo
 25/04/2019
25/04/2019
1. Đốt cháy hoàn toàn 11,5 gam Natri (Na) bằng oxi không khí. Tính thể tích không khí cần dùng (ở điều kiện tiêu chuẩn) biết Vkhông khí = 5VO2
2. Tính thể tích của oxi (điều kiện tiêu chuẩn) khi đốt cháy hoàn toàn 60 gam C2H6.
3. Tính thể tích không khí cần dùng để đốt cháy hết 8 lít C3H8. Các khí ở cùng điều kiện, oxi chiếm 20% không khí.
4. Đốt cháy hoàn toàn a gam CxHy sinh ra 88 gam CO2 và 36 gam H2O. Tìm công thức hoá học của CxHy biết tỉ khối của CxHy đối với khí Hidro là 14.
Theo dõi (0) 1 Trả lời -


cho 5,4g nhôm tác dụng với 36,5g axit clohiđric tạo thành khí hiđro và muối nhôm clorua
a) Tính thể tích khí hiđro thu đc ở đktc
b) Tính khối lượng muối nhôm clorua tạo thành
GIÚP MK VS
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính thể tích H2SO4 cần dùng để hòa tan hết 13 gam Zn?
bởi thu phương
 18/04/2019
18/04/2019
cho 13g Zn hạt nhỏ tác dụng hoàn toàn với dd H2so4 loãng.Cho toàn bộ lượng khí hiđrô được tạo thành đi chậm qua ống sứ đựng 20g bột Cuo nung nóng,thu được hh rắn A trong ống.Hỏi để hoà tan hết A cần dùng bao nhiêu mL dd h2so4 đặc,nồng độ 85% và đun nóng ?Biết rằng dung dịch axit có khối lượng riêng =1,28g/ml
Theo dõi (0) 1 Trả lời -


X là 1 loại rượu etylic 92 % . cho 10 ml rượu X tác dụng với Natri thì thu được bap nhiêu lít khí h2 , biết d rượu = 0,8 g/mol l d nước = 1 g, mol
Giúp nha
Theo dõi (0) 1 Trả lời -


Tính mCO2 thu được khi đốt cháy 1kg than?
bởi hồng trang
 25/04/2019
25/04/2019
đốt cháy 1 kg than có chứa 5% tạp chất không cháy a)tính khối lượng kí cacbonic
Theo dõi (0) 1 Trả lời -


Cân bằng phương trình C2H4+O2 --> CO2 + H2O?
bởi Dương Quá
 25/04/2019
25/04/2019
Cân bằng
C2H4+O2 -> CO2 + H2O
C2H6 + O2 -> CO2 + H2O
Theo dõi (0) 1 Trả lời -


Ngâm 1 lá Zn trong 50ml dung dịck AgNO3 0,2M. Sau khi phản ứng xảy ra xong lấy Zn ra sấy khô, đem cân thì khối lượng lá Zn thay đổi như thế nào ?
Theo dõi (0) 1 Trả lời





