Nội dung bài học đưa ra phần kiến thức về thành phần, tính chất và ứng dụng từ hợp kim của Sắt như Gang, thép. Nắm bắt được nguyên tắc và quy trình sản xuất Gang, thép.
Tóm tắt lý thuyết
2.1. Gang
a. Khái niệm
Gang là hợp kim của sắt với các bon trong đó có từ 2 đến 5% khối lượng các bon, ngoài ra còn một lượng nhỏ các nguyên tố Si, Mn, S,…
b. Phân loại
- Gang xám:
+ Là gang chứa cacbon ở dạng than chì.
+ Dùng để đúc bên máy, ống dẫn nước, cánh cửa,...
- Gang trắng:
+ Là gang chứa ít các bon hơn, chủ yếu ở dạng Xementit (Fe3C)
+ Dùng để luyện thép.
c. Sản xuất Gang
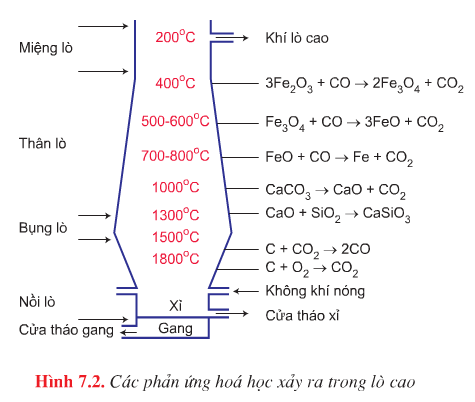
- Nguyên tắc: Khử quặng sắt oxit bằng than cốc trong lò cao.
- Nguyên liệu: Quặng sắt oxit (quặng hematit đỏ Fe2O3), than cốc, chất chảy (CaCO3 hoặc SiO2).
- Các phản ứng xảy ra trong quá trình luyện gang:
+ Phản ứng tạo chất khử CO
Phần trên của nồi lò: C + O2 \(\overset{t^{0}}{\rightarrow}\) CO2
Khí CO2 đi lên bị khử thành CO: CO2 + C \(\overset{t^{0}}{\rightarrow}\) 2CO
+ Phản ứng khử sắt oxit:
Phần thân lò có nhiệt độ khoảng 4000C:
3Fe2O3 + CO \(\overset{t^{0}}{\rightarrow}\) 2Fe3O4 + CO2\(\uparrow\)
Phần giữa thân lò nhiệt độ khoảng 500 – 6000C:
Fe3O4 + CO \(\overset{t^{0}}{\rightarrow}\) 3FeO + CO2\(\uparrow\)
Phần dưới thân lò nhiệt độ khoảng 700 – 8000C:
FeO + CO \(\overset{t^{0}}{\rightarrow}\) Fe + CO2\(\uparrow\)
+ Phản ứng tạo xỉ.
CaCO3 \(\overset{t^{0}}{\rightarrow}\) CaO + CO2\(\uparrow\)
CaO + SiO2 \(\overset{t^{0}}{\rightarrow}\) CaSiO3
Video 1: Thí nghiệm ảo mô phỏng quá trình sản xuất gang
d. Sự tạo thành gang
Ở phần bụng lò có nhiệt độ khoảng 15000C Sắt nóng chảy từ thân lò đi xuống bụng lò hoà tan một phần C và một lượng nhỏ Mn, Si….tạo thành gang ( có d = 6,9) chìm xuống dưới, xỉ nhẹ hơn nổi lên trên bảo vệ gang khôing bị oxi hoá. Sau một thời gian tháo xỉ và gang ra.
2.2. Thép
a. Khái niệm
Thép là hợp kim của sắt chứa từ 0,01 – 2% khối lượng các bon, cùng với một số nguyên tố khác (Si, Mn, Cr, Ni,,…)
b. Phân loại
- Thép thường (hay thép cacbon):
+ Thép mềm : chứa không quá 0,1% C. Dễ gia công. ⇒ Ứng dụng kéo sợi, cán thành thép lá dùng để chế tạo các vận dụng trong đời sống, sây dựng nhà cửa,..
+ Thép cứng: Chứa trên 0,9%C ⇒ Dùng để chế tạo các công cụ, các chi tiết máy,…
- Thép đặc biệt: Đưa thêm vào thép thường một số nguyên tố làm cho thép có tính chất đặc biệt.
+ Thép chứa 13%Mn rất cứng ⇒ Dùng làm máy nghiền đá.
+ Thép chứa khoảng 20%Cr và 10%Ni rất cứng không gỉ ⇒ Dùng làm dụng cụ gia đình, y tế…
+ Thép chứa 18%W và 5% Cr rất cứng ⇒ Dùng để chế tạo máy căt, máy phay,…
c. Sản xuất Thép
- Nguyên tắc: Giảm hàm lượng các tạp chất Si, Mn, S, P, C… chất trong gang bằng cách Oxi hoá các tạp đó thành oxit, rồi biến thành sỉ và tách ra khỏi thép.
- Các phương pháp luyện Thép
|
Đặc điểm |
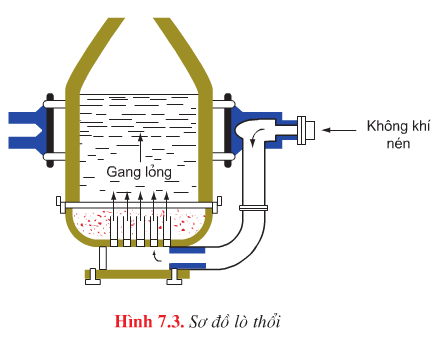
Phương pháp Bet – xơ – me |
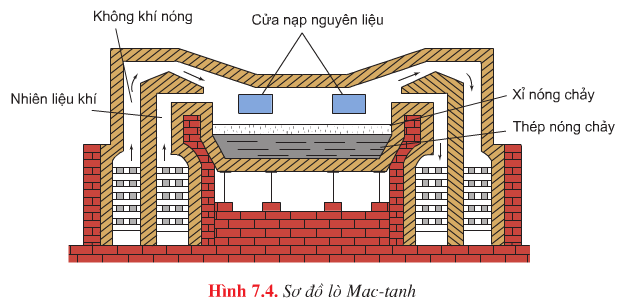
Phương pháp Mactanh |
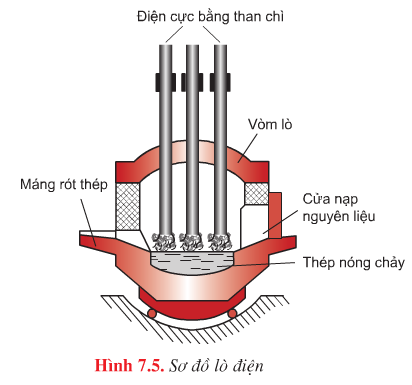
Phương pháp lò điện |
|
Sơ đồ |
Luyện thép trong lò hình quả lê, vỏ bằng thép bên trong lát gạch chịu lửa. |
- Nạp vào lò: gang, thép phế liệu, chất chảy - Đốt lò bằng dầu madut hoặc khí đốt, không khí giàu oxi, nhiệt độ 17000C. Khí oxi, gỉ sắt oxi hoá các chất trong gang Fe2O3 + 3C \(\overset{t^{0}}{\rightarrow}\) 2Fe + 3CO |
Nhiệt lượng sinh ra trong lò hồ quang điện giữa các điện cực bằng than chì và của gang lỏng |
|
Ưu điểm |
- Thời gian luyện thép nhanh (15’), khoảng cách giữa 2 lần luyện ngắn ( 30 – 40 phút) - Thiết bị đơn giản, vốn đầu tư ít - Không cần nhiên liệu. |
- Tận dụng được thép phế liệu đề luyện thép. - Luyện được những loại thép chất lượng cao, có thành phần như ý muốn - Khối lượng thép mỗi mẻ lớn ( 100 – 200 tấn) |
- Luyện được những loại thép đặc biệt, thành phần có những kim loại khó nóng chảy như W, Mo, Cr, và không chứa các tạp chất có hại |
|
Nhược điểm |
- Không luyện được thép từ gang. - Thời gian luyện thép nhanh,không luyện được thép theo ý muốn - Chất lượng thép không cao chứa nhiều phốt pho. |
- Tốn nhiên liệu - Thời gian luyện thép mỗi mẻ dài ( 10 – 12 giờ) |
- Dung tích lò nhỏ, khối lượng mỗi mẻ thép không lớn. |
Bài tập minh họa
3.1. Bài tập Hợp kim của Sắt - Cơ bản
Bài 1:
Cho các phát biểu sau:
(1) Gang là hợp kim của sắt từ 1 đến 3,1% là các nguyên tố C, Si, Mn và S còn lại là Fe.
(2) Thép là hợp kim của sắt trong đó hàm lượng cacbon chiếm 2%.
(3) Thép được sử dụng trong ngành chế tạo máy và máy bay.
(4) Để luyện thép, người ta oxi hóa gang nóng chảy để loại khỏi gang phần lớn các nguyên tố C, P, Si, Mn và S.
(5) Thép đặc biệt là loại thép ngoài những nguyên tố có sẵn như thép thường, còn thêm các nguyên tố được đưa vào là Cr, Ni, Mo, W, Mn...
Các phát biểu nào đúng? Phát biểu nào sai? Giải thích tại sao?
Hướng dẫn:
Các phát biểu đúng là (1), (2), (4), (5)
Phát biểu sai là (3). Do thành phần của Thép có chứa 18% W và 5%Cr nên rất cứng, ứng dụng để chế tạo cách máy cắt gọt, phay,...
Bài 2:
Để luyện được 800 tấn gang có hàm lượng sắt 95% , cần dùng x tấn quặng manhetit chứa 80% Fe3O4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt bị hao hụt trong quá trình sản xuất là 1%. Giá trị của x là:
Hướng dẫn:
\(Fe_3O_4\rightarrow 3Fe\)
\(mFe=800.\frac{95}{100}=760\) (tấn)
\(mFe_3O_4=\frac{760.232}{3.56}.\frac{100}{99}.\frac{100}{80}=1325,16\) (tấn)
Bài 3:
Nung một mẫu Thép thường có khối lượng 10 gam trong oxi thu được 0,1568 lít khí CO2. Thành phần phần trăm theo khối lượng của Cacbon có trong mẫu Thép là:
Hướng dẫn:
Bảo toàn nguyên tố Cacbon ta có:
nC (trong Thép) = nCO2 = 0,007 (mol)
\(\% C = \frac{{0,07.12}}{{10}}.100 = 84\%\)
3.2. Bài tập Hợp kim của Sắt - Nâng cao
Bài 1:
Đem nung nóng một lượng quặng hematit (chứa Fe2O3, có lẫn tạp chất trơ) và cho luồng khí CO đi qua, thu được 300,8 gam hỗn hợp các chất rắn, đồng thời có hỗn hợp khí thoát ra. Cho hấp thụ hỗn hợp khí này vào bình đựng lượng dư dung dịch xút thì thấy khối lượng bình tăng thêm 52,8 gam. Nếu hòa tan hết hỗn hợp chất rắn trong lượng dư dung dịch HNO3 loãng thì thu được 387,2 gam một muối nitrat. Hàm lượng Fe2O3 (% khối lượng) trong loại quặng hematit này là:
Hướng dẫn:
Hỗn hợp rắn + HNO3 → Fe(NO3)3
\(\Rightarrow n_{Fe(NO_3)_3} = \frac{387,2}{242} = 1,6\ mol\)
Bảo toàn nguyên tố Fe ta có
\(\begin{matrix} Fe_2O_3 & \rightarrow & 2Fe(NO_3)_3\\ 0,8 & & 1,6 & mol \end{matrix}\)
\(\Rightarrow m\) bình xút tăng \(= m_{CO_2} = 58,2 \Rightarrow n_{CO_2}=0,2\ mol\)
Bảo toàn C:
Quặng + CO → hh rắn + CO2
1,2 1,2 mol
Áp dụng định luật bảo toàn khối lượng ta có
m quặng + mCO = m rắn + mCO2
\(\Rightarrow m\) quặng \(= 300,8 + 44\times 1,2-28\times 1,2 = 320\ g\)
\(\%m_{Fe_2O_3}=0,8\times 160\times \frac{100}{320}=40\%\)
4. Luyện tập Bài 33 Hóa học 12
Sau bài học cần nắm:
- Thành phần, tính chất và ứng dụng từ hợp kim của Sắt như Gang, thép.
- Nguyên tắc và quy trình sản xuất Gang, thép.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hoá học 12 Bài 33 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Dùng khí CO khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
- B. Dùng khí CO2 khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
- C. Dùng khí hiđro khử oxit sắt ở nhiệt độ cao trong lò luyện kim
- D. Dùng cacbon khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
-
- A. Zn
- B. Cu
- C. Fe
- D. Al
-
- A. 5,6 lit
- B. 8,96 lit
- C. 6,72 lit
- D. 3,36 lit
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hoá học 12 Bài 33.
Bài tập 1 trang 151 SGK Hóa học 12
Bài tập 2 trang 151 SGK Hóa học 12
Bài tập 3 trang 151 SGK Hóa học 12
Bài tập 4 trang 151 SGK Hóa học 12
Bài tập 5 trang 151 SGK Hóa học 12
Bài tập 6 trang 151 SGK Hóa học 12
Bài tập 1 trang 208 SGK Hóa 12 Nâng cao
Bài tập 2 trang 208 SGK Hóa học 12 nâng cao
Bài tập 3 trang 208 SGK Hóa học 12 nâng cao
Bài tập 4 trang 208 SGK Hóa học 12 nâng cao
Bài tập 5 trang 208 SGK Hóa 12 Nâng cao
Bài tập 6 trang 208 SGK Hóa 12 Nâng cao
Bài tập 33.1 trang 77 SBT Hóa học 12
Bài tập 33.2 trang 78 SBT Hóa học 12
Bài tập 33.3 trang 78 SBT Hóa học 12
Bài tập 33.4 trang 78 SBT Hóa học 12
Bài tập 33.7 trang 78 SBT Hóa học 12
Bài tập 33.5 trang 78 SBT Hóa học 12
Bài tập 33.6 trang 78 SBT Hóa học 12
Bài tập 33.8 trang 78 SBT Hóa học 12
Bài tập 33.9 trang 79 SBT Hóa học 12
Bài tập 33.11 trang 79 SBT Hóa học 12
Bài tập 33.10 trang 79 SBT Hóa học 12
Bài tập 33.12 trang 79 SBT Hóa học 12
Bài tập 33.13 trang 79 SBT Hóa học 12
Bài tập 33.14 trang 79 SBT Hóa học 12
Bài tập 33.15 trang 80 SBT Hóa học 12
5. Hỏi đáp về Bài 33 Chương 7 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.