Đề cương ôn tập HK1 môn Hóa học 10 KNTT năm 2022-2023 được HOC247 biên soạn chi tiết nhằm phục vụ cho các em học sinh trong quá trình ôn thi môn Hóa học 10 KNTT. Nội dung tài liệu gồm tóm tắt các kiến thức trọng tâm và các câu hỏi trắc nghiệm liên quan đến kiến thức đã học sẽ giúp các em rèn luyện các kỹ năng và chuẩn bị cho kỳ thi học kì 1 sắp tới. Mời các em cùng tham khảo!
1. TÓM TẮT LÝ THUYẾT
1.1. CẤU TẠO NGUYÊN TỬ
A. THÀNH PHẦN CỦA NGUYÊN TỬ
Cấu tạo nguyên tử
- Thành phần cấu tạo của nguyên tử gồm:
+ Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp ).
+ Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
Chú ý: Trong nguyên tử, số proton bằng số electron.
Kích thước và khối lượng nguyên tử
- Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử
- Khối lượng nguyên tử tập trung ở hạt nhân (do khối lượng của electron rất nhỏ so với khối lượng của proton và neutron).
B. NGUYÊN TỐ HÓA HỌC
Số khối
Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Kí hiệu nguyên tử
Đồng vị
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ) của hỗn hợp các đồng vị của nguyên tố đó.
\(\bar A = \frac{{\left( {X.a} \right) + \left( {Y.b} \right) + ...}}{{100}}\)
C. CẤU TRÚC LỚP VỎ ELECTRON NGUYÊN TỬ
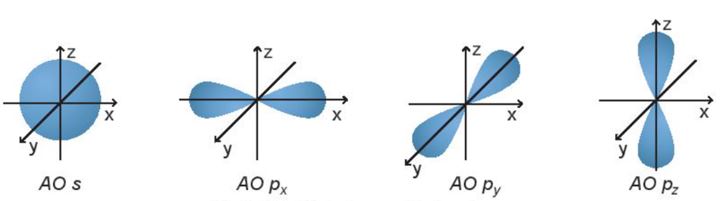
Hình dạng orbital nguyên tử
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
Lớp và phân lớp electron
|
n |
1 |
2 |
3 |
4 |
|
Lớp electron |
K |
L |
M |
N |
|
Phân lớp |
1s |
2s, 2p |
3s, 3p, 3d |
4s, 4p, 4d, 4f |
|
Số AO (n2) |
1 |
4 |
9 |
16 |
|
Số electron tối đa (2n2) |
2 |
8 |
18 |
32 |
Chú ý:
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Trong lớp electron thứ n có n2 AO (n ≤ 4).
D. CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ
- Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
- Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
- Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s2s2p3s3p4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
|
Đặc điểm của lớp electron ngoài cùng |
|||||
|
Số electron |
1, 2, 3 |
4 |
5, 6, 7 |
8 |
|
|
Loại nguyên tố |
Kim loại |
Kim loại hoặc phi kim |
Phi kim |
Khí hiếm (trừ He) |
|
1.2. BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
A. CẤU TẠO BẢNG TUẦN HOÀN
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron → cùng chu kì (hàng).
- Cùng số electron hóa trị → cùng nhóm (cột).
Trong bảng tuần hoàn (đến năm 2016) có 118 nguyên tố, 7 chu kì và 18 nhóm.
Chú ý:
Số proton = số electron = số hiệu nguyên tử = số Z
Số thứ tự chu kì = số lớp electron
Số thứ tự nhóm A = số electron lớp ngoài cùng
B. XU HƯỚNG BIẾN ĐỔI TRONG BẢNG TUẦN HOÀN
Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
C. ĐỊNH LUẬT TUẦN HOÀN
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
1.3. LIÊN KẾT HÓA HỌC
A. QUY TẮC OCTET
- Liên kết hoá học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- Quy tắc octet: Khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
B. LIÊN KẾT CỘNG HÓA TRỊ
- Liên kết cộng hóa trị: Hình thành do một hay nhiều cặp electron dùng chung giữa 2 nguyên tử
+ Liên kết cộng hóa trị không cực
+ Liên kết cộng hóa trị có cực
+ Liên kết cho – nhận
- Sự xen phủ orbital theo trục liên kết tạo ra liên kết \(\sigma \). Sự xen phủ bên của các orbital tạo ra liên kết \(\pi \)
- Các liên kết cộng hoá trị đơn đều là liên kết \(\sigma \), 1 liên kết đôi gồm 1 liên kết \(\sigma \) và 1 liên kết \(\pi \), 1 liên kết ba gồm \(\sigma \) liên kết ở và 2 liên kết \(\pi \)
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hoá học trong phân tử ở thể khi thành các nguyên tử ở thể khí. Năng lượng liên kết đặc trưng cho độ bền của liên kết.
C. LIÊN KẾT ION
- Liên kết ion hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
- Liên kết ion thường tạo thành từ các nguyên tử kim loại điển hình và phi kim điển hình, phân tử thu được là hợp chất ion.
- Các hợp chất ion thường là chất rắn có nhiệt độ nóng chảy và nhiệt độ sôi cao, có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.
- Dựa trên hiệu độ âm điện xác định loại liên kết hóa học:
|
Hiệu độ âm điện (∆x) |
Loại liên kết |
|
0 ≤ ∆x < 0,4 |
Cộng hóa trị không cực |
|
0,4 ≤ ∆x < 1,7 |
Cộng hóa trị có cực |
|
≥ 1,7 |
Ion |
→ Trị tuyệt đối giá trị hiệu âm điện càng lớn thì liên kết càng phân cực (hay liên kết ion có độ phân cực lớn nhất, liên kết cộng hóa trị không phân cực có độ phân cực nhỏ nhất
D. LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hoá trị chưa tham gia liên kết.
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
2. BÀI TẬP
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự phân chia của tế bào.
B. Sự hô hấp của sinh vật.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự quang hợp của cây xanh.
Câu 2: Nguyên tử chứa các hạt mang điện là
A. proton và hạt nhân.
B. proton và neutron.
C. electron và neutron.
D. proton và electron.
Câu 3: Kí hiệu hóa học của phosphorus (số proton = 15 và số neutron = 16) là
A. \({}_{{\rm{15}}}^{{\rm{32}}}{\rm{P}}\)
B. \({}_{{\rm{15}}}^{{\rm{31}}}{\rm{P}}\)
C. \({}_{{\rm{16}}}^{{\rm{31}}}{\rm{P}}\)
D. \({}_{{\rm{15}}}^{{\rm{30}}}{\rm{P}}\)
Câu 4: Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là chiếm 73% và . Nguyên tử khối trung bình của nguyên tố Cu là
A. 63,54.
B. 64,54.
C. 64,00.
D. 64,50.
Câu 5: Lớp thứ M có số phân lớp là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6: Số electron tối đa chứa trong lớp L là
A. 2.
B. 8.
C. 18.
D. 32.
Câu 7: Cấu hình electron của nguyên tử có Z = 15 là
A. 1s23s22p63s23p2.
B. 1s23s22p63s23p4.
C. 1s23s22p63s23p3.
D. 1s23s22p53s23p4.
Câu 8: Cho các nguyên tố sau: X (Z = 11); Y (Z = 19); T (Z = 20); Q (Z = 17). Nguyên tố phi kim là
A. X (Z = 11).
B. Q (Z = 17).
C. Y (Z = 19).
D. T (Z = 20).
Câu 9: Ion X2+ có 10 electron. Trong bảng tuần hoàn, X thuộc ô số
A. 10.
B. 12.
C. 8.
D. 9.
Câu 10: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
A. s.
B. d.
C. f.
D. p.
Câu 11: Nguyên tố X có số hiệu nguyên tử bằng 15. Hydroxide cao nhất của nó có tính chất gì?
A. Acid.
B. Base.
C. Trung tính.
D. Lưỡng tính.
Câu 12: Bán kính nguyên tử của các nguyên tố: Li (Z = 3), O (Z = 8), F (Z = 9), Na (Z = 11) được xếp theo chiều tăng dần từ trái sang phải là
A. F, O, Li, Na.
B. Li, Na, O, F.
C. F, Na, O, Li.
D. F, Li, O, Na.
Câu 13: Nguyên nhân của sự biến đổi tuần hoàn tính chất các nguyên tố là sự biến đổi tuần hoàn
A. của điện tích hạt nhân.
B. của số hiệu nguyên tử.
C. cấu hình electron lớp ngoài cùng của nguyên tử.
D. cấu trúc lớp vỏ electron của nguyên tử.
Câu 14: Độ âm điện của các nguyên tố biến đổi như thế nào trong bảng hệ thống tuần hoàn?
A. Tăng dần trong một chu kì.
B. Giảm dần trong một phân nhóm chính.
C. Biến thiên giống tính phi kim.
D. Tăng dần theo tính kim loại.
Câu 15: Nguyên tố X thuộc chu kì 3, nhóm VIA. Cấu hình electron của nguyên tử X là
A. 1s22s22p4.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p1.
D. 1s22s22p63s23p3.
ĐÁP ÁN
|
1 - C |
2 - D |
3 - B |
4 - A |
5 - C |
6 - B |
7 - C |
8 - B |
9 - B |
10 - D |
|
11 - A |
12 - A |
13 - C |
14 - C |
15 - B |
16 - A |
17 - C |
18 - B |
19 - D |
20 - A |
|
21 - B |
22 - C |
23 - A |
24 - A |
25 - A |
26 - B |
27 - C |
28 - B |
29 - D |
30 - C |
Trên đây là một phần trích đoạn nội dung Đề cương ôn tập HK1 môn Hóa học 10 KNTT năm 2022-2023. Để xem toàn bộ nội dung các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Mời các em tham khảo tài liệu có liên quan:
- Đề cương ôn tập HK1 môn Lịch sử 10 KNTT năm học 2022-2023
- Đề cương ôn tập HK1 môn Địa lí 10 KNTT năm 2022-2023
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Tài liệu liên quan
Tư liệu nổi bật tuần
-
Đề cương ôn tập giữa HK1 môn Vật lý 12 năm 2023 - 2024
09/10/20231708 -
Đề cương ôn tập giữa HK1 môn Ngữ văn 12 năm 2023-2024
09/10/20231104 -
100 bài tập về Dao động điều hoà tự luyện môn Vật lý lớp 11
14/08/2023659 - Xem thêm






.JPG?enablejsapi=1)