Chúng ta đã làm quen với một hợp chất vô cơ có tên là oxít. Trong các hợp chất vô cơ còn có các loại hợp chất khác: Axít, bazơ, muối. Chúng là những chất như thế nào?, có công thức hoá học, tên gọi ra sao?. Được phân loại như thế nào?. Tiết học này các em sẽ tìm hiểu qua nội dung bài giảng: Axit - Bazơ - Muối.
Tóm tắt lý thuyết
1.1. Axit
1.1.1. khái niệm
- Phân tử axít gồm một hay nhiều nguyên tử hiđrô liên kết với gốc axít, các nguyên tử hiđrô này có thể thay thế bằng các nguyên tử kim loại.
- Ví dụ: HCl (1 nguyên tử H + gốc axit -Cl); H2SO4 (2nguyên tử H và gốc axit =SO4)
1.1.2. Công thức của axít
Công thức: CHnA
- n: là chỉ số của nguyên tử H
- A: là gốc axít
1.1.3. Phân loại
- Axit không có oxi: HCl, H2S...
- Axit có oxi: HNO3, H2SO4, H3PO4 …
1.1.4. Tên gọi
*Axít có oxi
- Cách gọi tên: Tên axit: axit + tên Phi kim +ic
- Ví dụ: HNO3 (Axit nitric), H2SO4 (Axit sunfuric)...
*Axít không có oxi
- Cách gọi tên: axit + tên phi kim +hiđic
- Ví dụ: H2S (axit sunfuhiđric), HCl (axit clohiđric)...
*Axít có ít oxi
- Cách gọi tên: axit + PK + ơ
- Ví dụ: H2SO3 (axit sunfurơ). Gốc =SO3 có tên là sunfit
1.2. Bazơ
1.2.1. Khái niệm
- Ví dụ một số bazơ: NaOH, KOH, Ca(OH)2, Al(OH)3...
- Nhận xét:
- Có một nguyên tử kim loại.
- Một hay nhiều nhóm OH (hidroxit).
- Vì nhóm - OH luôn có hoá trị I.
- Số nhóm - OH được xác định bằng hoá trị của kim loại.
- Kết luận: Bazơ là một phân tử gồm một nguyên tố kim loại liên kết một hay nhiều nhóm hiđroxit(-OH).
1.2.2. Công thức hóa học
Công thức: M(OH)n
- M: là nguyên tố kim loại
- n: là chỉ số của nhóm (-OH)
1.2.3. Phân loại bazơ
- Bazơ tan (kiềm), tan được trong nước: NaOH; Ca(OH)2...
- Bazơ không tan, không tan được trong nước: Fe(OH)3; Cu(OH)2…
1.2.4. Tên gọi
- Tên bazơ = Tên kim loại( nếu kim loại có nhiều hoá trị gọi tên kèm theo tên hoá trị) + hiđroxit.
- Ví dụ: Ca(OH)2 Canxi hidroxit; Fe(OH)3 sắt (III) hiđroxit.
1.3. Muối
1.3.1. Khái niệm
- Phân tử muối gồm có một hay nhiều nguyên tử kim loại liên kết một hay nhiều gốc axít.
- Ví dụ: NaCl, KBr, Na2SO4, Fe(NO3)3
1.3.2. Công thức hóa học
Công thức: MxAy
- M: là nguyên tố kim loại
- x: là chỉ số của M
- A: là gốc axít
- y: là chỉ số của gốc axít
1.3.3. Cách đọc tên muối
- Tên muối = tên kim loại (kèm hoá trị kim loại có nhiều hoá trị) + tên gốc axít
- Tên một số gốc muối: -Cl (clorua), =SO4 (sunfat), -NO3 (Nitrat), =CO3 (Cacbonat), -HCO3 (Hiđrocacbonat), -HSO4 (Hiđrosunfat)
- Ví dụ: NaCl (Natri clorua), CaCO3 (Canxi cacbonat), Fe2(SO4)3 Sắt (III) sunfat, KHCO3 (Kali hiđrocacbonat)...
1.3.4. Phân loại muối
- Muối trung hoà: Là muối mà trong gốc axít không có nguyên tử “ H” có thể thay thế bằng nguyên tử kim loại như ZnSO4; Cu(NO3)2…
- Muối axít: Là muối mà trong đó gốc axít còn nguyên tử “H” chưa được thay thế bằng nguyên tử kim loại như NaHCO3; Ca(HCO3)2…
1.4. Tổng kết
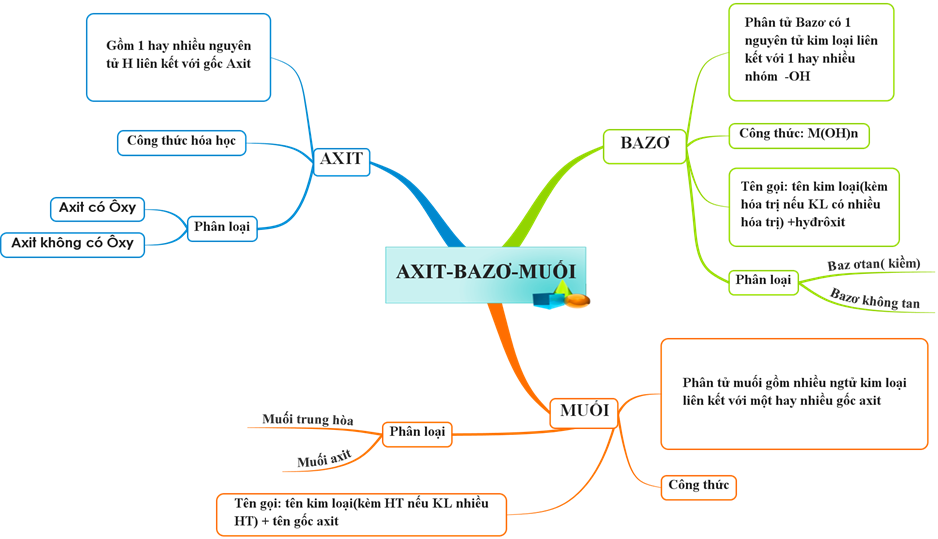
Hình 1: Sơ đồ tư duy bài Axit - Bazơ - Muối
Bài tập minh họa
Bài 1:
Lấy ví dụ về một số axit đã biết. Em hãy nhận xét điểm giống và khác nhau trong các thành phần phân tử trên.
Hướng dẫn:
Một số axit là: HCl, H2SO4, HNO3, H3PO4
- Giống: đều có nguyên tử H.
- Khác: các nguyên tử H liên kết với các nhóm nguyên tử (gốc axit) khác nhau.
Bài 2:
Viết công thức hoá hóa học của các axit sau:
a) axit sunfuhidric.
b) axit cacbonic.
c) axit photphoric.
Hướng dẫn:
a) axit sunfuhidric có công thức là H2S
b) axit cacbonic có công thức là H2CO3
c) axit photphoric có công thức là H3PO4
Bài 3:
Viết công thức hoá học của các axít có gốc axít cho dưới đây và cho biết tên của chúng. (-Cl, = SO3, = SO4, = S, -NO3.)
Hướng dẫn:
Các axit với công thức và tên gọi tương ứng là:
- Ứng với gốc -Cl ta có axit clohiđric HCl
- Ứng với gốc = SO3 ta có axit sunfurơ H2SO3
- Ứng với gốc = SO4 ta có axit sunfuric H2SO4
- Ứng với gốc = S ta có axit sunfuhiđric H2S
- Ứng với gốc -NO3 ta có axit nitric HNO3
Bài 4:
Viết công thức hoá học bazơ tương ứng với các oxít sau: BaO; MgO; FeO và đọc tên các Bazơ trên.
Hướng dẫn:
Các bazơ tương ứng là: Ba(OH)2; Mg(OH)2; Fe(OH)2
Tên gọi của bazơ Ba(OH)2 là: Bari hiđroxit
Tên gọi của bazơ Mg(OH)2 là: Magie hiđroxit
Tên gọi của bazơ Fe(OH)2 là: Sắt (II) hiđroxit
Bài 5:
Công thức hóa học ứng với các tên gọi sau là:
Kẻm clorua, Nhôm sunfat, Sắt (III) nitrat, Kalihiđrocacbonat, Natrihiđrosunfat.
Hướng dẫn:
- Kẽm clorua: ZnCl2
- Nhôm sunfat: Al2(SO4)3
- Sắt (III) nitrat: Fe(NO3)3
- Kalihiđrocacbonat: KHCO3
- Natrihiđrosunfat: KHSO4
Bài 6:
Trong các muối sau muối nào là muối axit, muối nào là muối trung hoà:
NaH2PO4, BaCO3, Na2SO4, Na2HPO4, K2SO4, Fe(NO3)3
Hướng dẫn:
- Muối trung hoà: Là muối mà trong gốc axít không có nguyên tử “ H” có thể thay thế bằng nguyên tử kim loại là: BaCO3, Na2SO4, K2SO4, Fe(NO3)3
- Muối axít: Là muối mà trong đó gốc axít còn nguyên tử “H” chưa được thay thế bằng nguyên tử kim loại là: NaH2PO4, Na2HPO4
3. Luyện tập Bài 37 Hóa học 8
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 37 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Trong các chất sau: NaCl, HCl, CaO, CuSO4 , Ba(OH)2 , KHCO3 . Số chất thuộc hợp chất muối là :
- A. 2.
- B. 3.
- C. 4.
- D. 1.
-
- A. 2.
- B. 3.
- C. 4.
- D. 1.
-
- A. AlCl
- B. Al3Cl
- C. AlCl3
- D. Al3Cl2
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 37.
Bài tập 1 trang 130 SGK Hóa học 8
Bài tập 2 trang 130 SGK Hóa học 8
Bài tập 3 trang 130 SGK Hóa học 8
Bài tập 4 trang 130 SGK Hóa học 8
Bài tập 5 trang 130 SGK Hóa học 8
Bài tập 6 trang 130 SGK Hóa học 8
Bài tập 37.1 trang 50 SBT Hóa học 8
Bài tập 37.2 trang 50 SBT Hóa học 8
Bài tập 37.3 trang 50 SBT Hóa học 8
Bài tập 37.4 trang 50 SBT Hóa học 8
Bài tập 37.5 trang 50 SBT Hóa học 8
Bài tập 37.6 trang 51 SBT Hóa học 8
Bài tập 37.7 trang 51 SBT Hóa học 8
Bài tập 37.8 trang 51 SBT Hóa học 8
Bài tập 37.9 trang 51 SBT Hóa học 8
Bài tập 37.10 trang 51 SBT Hóa học 8
Bài tập 37.11 trang 51 SBT Hóa học 8
Bài tập 37.12 trang 51 SBT Hóa học 8
Bài tập 37.13 trang 51 SBT Hóa học 8
Bài tập 37.14 trang 51 SBT Hóa học 8
Bài tập 37.15 trang 51 SBT Hóa học 8
Bài tập 37.16 trang 52 SBT Hóa học 8
Bài tập 37.17 trang 52 SBT Hóa học 8
Bài tập 37.18 trang 52 SBT Hóa học 8
Bài tập 37.19 trang 52 SBT Hóa học 8
Bài tập 37.20 trang 52 SBT Hóa học 8
4. Hỏi đáp về Bài 37 Chương 5 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.