Qua bài học hiđro, các em đã hiểu tính chất của hiđro, ứng dụng của hiđro. Như vậy hiđro là chất đóng vai trò như thế nào trong phản ứng oxi hoá- khử? Để hiểu rõ hơn tiết học này các em sẽ tìm hiểu.
Tóm tắt lý thuyết
1.1. Sự khử và sự oxi hóa
1.1.1. Sự khử
- Sự khử là sự tách oxi ra khỏi hợp chất. (Chất khử là chất nhường electron, chất oxy hóa là chất nhận electron)
- Thí nghiệm: CuO + H2
Cu + H2O
-
Trong PTHH trên, ta thấy H2 đã kết hợp với nguyên tố oxi tạo thành H2O, hay H2 đã chiếm oxi của CuO.
-
-
Ở các nhiệt độ cao khác nhau, khí Hidro có thể chiếm được nguyên tố oxi của một số oxit kim loại khác như sắt (III), oxit Fe2O3, chì (II) oxit PbO, thủy ngân (II) oxit HgO...
1.1.2. Sự oxi hóa
- Sự oxi hóa là sự tác dụng của oxi với một chất.
- Ví dụ :
Zn + O2 .PNG)
1.2. Chất khử và chất oxi hóa
- Chất khử là chất chiếm oxi của chất khác.
- Chất oxi hóa là chất nhường oxi cho chất khác.
- Ví dụ: Trong phương trình hóa học: CuO + H2 → Cu + H2O
- CuO nhường oxi cho H2 → Cu
- H2 chiếm oxi của CuO → H2O
Vậy: CuO + H2 → Cu +H2O
(chất oxi hóa) (chất khử)
- Trong phản ứng C + O2
CO2 thì bản thân oxi cũng là chất oxi hóa
1.3. Phản ứng oxi hóa - khử
-
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời sự oxi hóa và sự khử.
-
Trong phương trình hóa học: CuO + H2
Cu + H2O
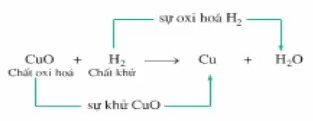
- Có thể biểu diễn quá trình khử và oxi hóa của phản ứng CuO + H2 như sau:
Hình 1: Sơ đồ biểu diễn quá trình khử và oxi hóa
⇒ Sự khử và sự oxi hóa là 2 quá trình trái ngược nhau, nhưng xảy ra đồng thời trong 1 phương trình hóa học.
? Phản ứng sau có phải là phản ứng oxi hoá – khử không ? Vì sao ?
2H2 + O2 .PNG)
Dựa vào dấu hiệu có sự nhường và chiếm oxi giữa các chất để phân biệt phản ứng oxi hóa với các loại phản ứng khác.
Bài tập minh họa
Bài 1:
Những câu phát biểu nào sau đây là đúng:
a) Chất nhường Oxi cho chất khác là chất khử
b) Chất nhường oxi cho chất khác là chất oxi hóa
c) Chất chiếm oxi của chất khác là chất khử
d) Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có xảy ra sự oxi hóa
e) Phản ứng oxi hóa - khử là phản ứng hóa học trong đó có xảy ra sự oxi hóa và sự khử
Hướng dẫn:
ý b, c, e là các phát biểu đúng
Bài 2:
Xác định tính chất của chất bằng cách đánh dấu (+) vào ô thích hợp:
|
Phương trình phản ứng |
Tính chất của chất |
||||
|
Chất tham gia |
Nhường oxi |
Chiếm oxi |
Chất oxi hóa |
Chất khử |
|
|
CuO + H2 → Cu + H2O |
CuO | ||||
| H2 | |||||
|
2H2 + O2 → 2H2O |
H2 | ||||
| O2 | |||||
Hướng dẫn:
|
Phương trình phản ứng |
Tính chất của chất |
||||
|
Chất tham gia |
Nhường oxi |
Chiếm oxi |
Chất oxi hóa |
Chất khử |
|
|
CuO + H2 → Cu + H2O |
CuO | + | + | ||
| H2 | + | + | |||
|
2H2 + O2 → 2H2O |
H2 | + | + | ||
| O2 | + | + |
|||
3. Luyện tập Bài 32 Hóa học 8
Sau bài học cần nắm:
- Phân biệt chất khử, chất oxi hóa, sự khử, sự oxi hóa trong những phản ứng oxi hóa – khử cụ thể
- Phân biệt phản ứng oxi hóa – khử với các loại phản ứng khác.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 32 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Số nguyên tử trong mỗi chất
- B. số nguyên tử của mỗi nguyên tố
- C. Số nguyên tố tạo ra chất
- D. Số phân tử của mỗi chất
-
-
A.
Photpho + điphotpho pentaoxit
khí oxi
-
B.
Photpho
khí oxi + điphotpho pentaoxit
-
C.
điphotpho pentaoxit
Khí oxi + photpho
-
D.
Photpho + khí oxi
điphotpho pentaoxit
-
A.
Photpho + điphotpho pentaoxit
-
- A. CuO + HCl → CuCl2 + H2O
- B. CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
-
C.
2Fe + 3Cl2
2FeCl3
- D. FeCl2 + 2NaOH → Fe(OH)2 + 20NaCl
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 32.
Bài tập 1 trang 113 SGK Hóa học 8
Bài tập 2 trang 113 SGK Hóa học 8
Bài tập 3 trang 113 SGK Hóa học 8
Bài tập 4 trang 113 SGK Hóa học 8
Bài tập 5 trang 113 SGK Hóa học 8
Bài tập 32.1 trang 44 SBT Hóa học 8
Bài tập 32.2 trang 45 SBT Hóa học 8
Bài tập 32.3 trang 45 SBT Hóa học 8
Bài tập 32.4 trang 45 SBT Hóa học 8
Bài tập 32.5 trang 45 SBT Hóa học 8
Bài tập 32.6 trang 45 SBT Hóa học 8
Bài tập 32.7 trang 46 SBT Hóa học 8
Bài tập 32.8 trang 46 SBT Hóa học 8
Bài tập 32.9 trang 46 SBT Hóa học 8
Bài tập 32.10 trang 46 SBT Hóa học 8
Bài tập 32.11 trang 46 SBT Hóa học 8
4. Hỏi đáp về Bài 32 Chương 5 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.