Hướng dẫn giải bài tập SGK Hoá học 12 Bài 34 Crom và hợp chất của Crom giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức môn hoá.
-
Bài tập 1 trang 155 SGK Hóa học 12
Viết phương trình hóa học của các phản ứng trong quá trình chuyển hóa sau:
Cr
Cr2O3
Cr2(SO4)3
Cr(OH)3
Cr2O3.
-
Bài tập 2 trang 155 SGK Hóa học 12
Cấu hình electron của Cr3+ là:
A. [Ar]3d5.
B. [Ar]3d4.
C. [Ar]3d3.
D. [Ar].
-
Bài tập 3 trang 155 SGK Hóa học 12
Số oxi hóa đặc trưng của Crom là:
A. +2, +4, +6.
B. +2, +3, +6.
C. +1, +2, +4, +6.
D. +3, +4, +6.
-
Bài tập 4 trang 155 SGK Hóa học 12
Hãy viết công thức của một số muối crom trong đó nguyên tố Crom:
a) Đóng vai trò cation.
b) Có trong thành phần của anion.
- VIDEOYOMEDIA
-
Bài tập 5 trang 155 SGK Hóa học 12
Khi nung nóng 2 mol natri đicromat người ta thu được 48 gam oxi và 1 mol crom(III) oxit. Hãy viết phương trình hóa học của phản ứng và xét xem natri đicromat đã bị nhiệt phân hoàn toàn hay chưa?
-
Bài tập 1 trang 190 SGK Hóa học 12 nâng cao
Hãy trình bày hiểu biết về:
a. Vị trí của crom trong bảng tuần hoàn.
b. Cấu hình electron của nguyên tử crom.
c. Khả năng tạo thành các số oxi hóa của crom.
-
Bài tập 2 trang 190 SGK Hóa học 12 nâng cao
Hãy so sánh tính chất hóa học của nhôm và crom viết phương trình hóa học minh hoạ.
-
Bài tập 3 trang 190 SGK Hóa học 12 nâng cao
Cho phản ứng:
...Cr + ...Sn2+ → Cr3+ + ...Sn
a, Khi cân bằng phản ứng trên, hệ số của ion Cr3+ sẽ là:
A. 1
B. 2
C. 3
D. 6
b, Pin điện hóa Cr-Cu trong quá trình phóng điện xảy ra phản ứng:
2Cr (r) + 3Cu2+(dd) → 2Cr3+ (dd) + 3Cu (r)
Suất điện động chuẩn của pin điện hóa là:
A. 0,04 V
B. 1,08 V
C. 1,25 V
D. 2,50 V.
-
Bài tập 4 trang 190 SGK Hóa 12 Nâng cao
Tính khối lượng bột nhôm cần dùng trong phòng thí nghiệm để có thể điều chế được 78 gam crom bằng phương pháp nhiệt nhôm.
-
Bài tập 5 trang 190 SGK Hóa 12 Nâng cao
Một hợp chất Ni-Cr có chứa 80% Ni và 20% Cr theo khối lượng. Hãy cho biết trong hợp chất này có bao nhiêu mol niken ứng với 1 mol crom.
-
Bài tập 1 trang 194 SGK Hóa học 12 nâng cao
Có nhận xét gì về tính chất hóa học của các hợp chất Cr(II), Cr(III) và Cr(VI)? Dẫn ra những phản ứng hóa học để chứng minh.
-
Bài tập 3 trang 194 SGK Hóa học 12 nâng cao
Người ta có thể điều chế Cr(III) oxit bằng cách phân hủy muối amoni đicromat ở nhiệt độ cao:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Hãy cho biết phản ứng trên thuộc loại phản ứng nào và lập phương trình hóa học?
-
Bài tập 4 trang 194 SGK Hóa học 12 nâng cao
Viết phương trình oxi hóa - khử (dạng phân tử và ion rút gọn) giữa kali đicròmat và natri sunfua khi có mặt axit sunfuric.
-
Bài tập 34.1 trang 80 SBT Hóa học 12
Cho biết Cr có Z = 24. Cấu hình electron của ion Cr3+ là .
A. [Arl3d6.
B. [Ar]3d5.
C. [Ar]3d4.
D. [Ar]3d3.
-
Bài tập 34.2 trang 80 SBT Hóa học 12
Muốn điều chế được 6,72 lít khí Cl2 (đktc) thì khối lượng K2Cr2O7 tối thiểu cần lấy để cho tác dụng với dung dịch HCl đặc, dư là
A. 26,4 g.
B. 27,4 g.
C. 28,4 g.
D. 29,4 g.
-
Bài tập 34.3 trang 80 SBT Hóa học 12
Khối lượng K2Cr2O7 cần lấy để tác dụng đủ với 0,6 moi FeSO4 trong dung dịch (có H2SO4 làm môi trường) là
A. 26,4 g.
B. 27,4 g.
C.28,4 g.
D. 29,4 g.
-
Bài tập 34.4 trang 80 SBT Hóa học 12
Hoà tan 58,4 g hỗn hợp mùối khan AlCl3 và CrCl3 vào nước, thêm dư dung dịch NaOH sau đó tiếp tục cho thêm nước clo, rồi lại thêm dư dung dịch BaCl2 thu được 50,6 g kết tủa. Thành phần phần trăm khối lượng của hỗn hợp muối ban đầu là
A. 45,7% AlCl3 và 54,3% CrCl3
B. 46,7% AlCl3 và 53,3% CrCl3
C. 47,7% AlCl3 và 52,3% CrCl3
D. 48,7% AlCl3 và 51,3% CrCl3
-
Bài tập 34.5 trang 81 SBT Hóa học 12
Nhận định nào dưới đây không đúng ?
A. Crom là kim loại chuyển tiếp, thuộc chu kì 4, nhóm VIB, ô số 24 trong bảng tuần hoàn.
B. Crom là nguyên tố d, có cấu hình electron : [Ar]3d54s1, có 1 electron hoá trị.
C. Khác với những kim loại nhóm A, Cr có thể tham gia liên kết bằng electron ở cả phân lớp 4s và 4d.
D. Trong các hợp chất, crom có số oxi hoá biến đổi từ +1 đến +6, trong đó phổ biến là các mức +2, +3, +6.
-
Bài tập 34.6 trang 81 SBT Hóa học 12
Trong các cấu hình electron của nguyên tử và ion crom sau đây, cấu hình electron nào đúng ?
A. 24Cr: [Ar]3d44s2
B. 24Cr2+: [Ar]3d34s1
C. 24Cr2+: [Ar]3d24s2
D. 24Cr2+: [Ar]3d3
-
Bài tập 34.7 trang 81 SBT Hóa học 12
Trong các câu sau, câu nào không đúng ?
A. Crom là kim loại có tính khử mạnh hơn sắt.
B. Crom là kim loại chỉ tạo được oxit bazơ.
C. Crom có những tính chất hoá học giống nhôm.
D. Crom có những hợp chất giống hợp chất của lưu huỳnh.
-
Bài tập 34.8 trang 81 SBT Hóa học 12
Phát biểu nào sau đây không đúng ?
A. Hợp chất Cr(II) có tính khử đặc trưng còn hợp chất Cr(VI) có tính oxi hoá mạnh.
B. Các hợp chất Cr2O3, Cr(OH)3, CrO, Cr(OH)2 đều có tính chất lưỡng tính.
C. Các hợp chất CrO, Cr(OH)2 tác dụng được với dung dịch HCl còn CrO3 tác dụng được với dung dịch NaOH.
D. Thêm dung dịch kiềm vào muối đicromat, muối này chuyển thành muối cromat.
-
Bài tập 34.9 trang 81 SBT Hóa học 12
Cho dung dịch chứa 0,5 mol NaOH vào dung dịch chứa 0,2 mol CrCl2 rồi để trong không khí đến phản ứng hoàn toàn. Khối lượng kết tủa cuối cùng thu được là
A. 10,3 g.
B. 20,6 g.
C. 8,6 g.
D. 17,2 g.
-
Bài tập 34.10 trang 82 SBT Hóa học 12
Hiện tượng nào dưới đây đã miêu tả không đúng ?
A. Thổi khí NH3 qua CrO3 đốt nóng thấy chất rắn chuyển từ màu đỏ sang màu lục thẫm.
B. Nung Cr(OH)2 trong không khí thấy chất rắn chuyển từ màu lục xám sang màu lục thẫm.
C. Thêm lượng dư NaOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng.
D. Thêm lượng dư NaOH và Cl2 vào dung dịch CrCl2 thì dung dịch màu xanh chuyển sang màu vàng.
-
Bài tập 34.11 trang 82 SBT Hóa học 12
Có các phương trình hoá học sau :
1. CrO + 2HCl → CrCl2 + H2O
2. CrClO + 2NaOH → Cr(OH)2 + 2NaCl
3. 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
4. Cr(OH)2 + 2HCl → CrCl2 + 2H2O
5. 4CrCl2 + 4HCl + O2 → 4CrCl3 + 2H2O
Những phản ứng minh hoạ tính khử của hợp chất crom (II) là
A. 1,2.
B. 3, 5.
C. 3,4.
D. 2, 4.
-
Bài tập 34.12 trang 82 SBT Hóa học 12
Thể tích của dung dịch K2Cr2O7 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư là
A. 100 ml.
B. 150 ml.
C. 200 ml.
D. 250 ml.
-
Bài tập 34.13 trang 82 SBT Hóa học 12
Để oxi hóa hoàn toàn 0,01 mol CrCl4 thành K2Cr2O4 bằng Cl2 khi có mặt KOH, lượng tối thiểu Cl2 và KOH tương ứng là
A. 0,03 mol và 0,04 mol
B. 0,03 mol và 0,08 mol
C. 0,015 mol và 0,08 mol
D. 0,015 mol và 0,04 mol
-
Bài tập 34.14 trang 82 SBT Hóa học 12
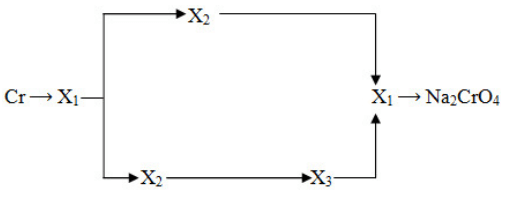
Cho sơ đồ các chuỗi phản ứng sau :
1) Cr2O3 → A1 → A2 → A3 → A4 → A5 → A6 → A7 → Cr2O3
2,
Biết rằng :
- A1... A7 là các đơn chất hoặc hợp chất của crom.
- X1... X3 là các hợp chất của crom.
Hãy viết PTHH (có ghi điều kiện) theo các chuỗi phản ứng trên.
-
Bài tập 34.15 trang 83 SBT Hóa học 12
Viết phương trình hoá học của các phản ứng trong quá trình chuyển hoá sau:
Cr → CrCl3 → Cr(OH)3 → NaCrO2 → Na2CrO4 → Na2Cr2O7
-
Bài tập 34.16 trang 83 SBT Hóa học 12
Cho từ từ dung dịch NaOH vào dung dịch chứa 9,02 g hỗn hợp muối Al(NO3)3 và Cr(NO3)3 cho đến khi lượng kết tủa thu được là lớn nhất. Tách kết tủa ra khỏi dung dịch, rửa và nung đến khối lượng không đổi thu được 2,54 g chất rắn. Tính phần trăm khối lượng các muối trong hỗn hợp ban đầu.