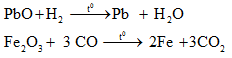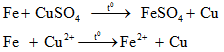Nôi dung bài học giúp các em hiểu về nguyên tắc điều chế kim loại cũng như các phương pháp để điều chế như phương pháp nhiệt luyện, thủy luyện, điện phân.
Tóm tắt lý thuyết
2.1. Nguyên tắc điều chế kim loại
- Là sự khử ion kim loại thành kim loại: \({M^{n + }} + ne \to M\)
2.2. Phương pháp điều chế kim loại
a. Phương pháp nhiệt luyện
- Dùng chất khử như C,CO,H2, hoặc kim loại hoạt động để khử ion kim loại ra khỏi hợp chất ở nhiệt độ cao.
- Chú ý:
+ Phương pháp này thường được sử dụng trong công nghiệp
+ Dùng để điều chế các kim loại trung bình, yếu như: Zn, Fe, Sn, Pb,...
b. Phương pháp thủy luyện
- Dùng chất khử mạnh Zn, Fe,..để khử kim loại có tính khử yếu hơn trong dung dịch ra khỏi hợp chất.
Chú ý:
+ Cơ sở phương pháp này là dùng những dung dịch thích hợp như H2SO4, NaOH, NaCN,..để hoà tan kim loại hoặc hợp chất kim loại và tách ra khỏi phần không tan.
+ Không dùng kim loại kiềm, kiềm thổ để khử.
c. Phương pháp điện phân
- Điện phân hợp chất nóng chảy: Dùng để điều chế các kim loại mạnh như Na, K, Mg, Ca, ...
Ví dụ: Điều chế NaCl nóng chảy thu được Na theo pthh
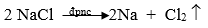
- Điện phân dung dịch: Dùng điều chế các kim loại trung bình, yếu bằng cách điện phân dung dịch muối của chúng.
Ví dụ: Điện phân dung dịch CuCl2 thu được Cu theo pthh
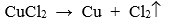
- Tính lượng chất thu được ở mỗi điện cực. Dựa vào định luật Faraday: \(m=\frac{A.I.t}{n.F}\)
+ m: Khối lượng chất thu được mỗi điện cực (gam)
+ A: Khối lượng mol nguyên tử của chất thu được ở điện cực
+ n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận
+ I: Cường độ dòng điện ampe kế (A)
+ t: Thời gian điện phân (giây)
+ F: hằng số Faraday (F = 96500)
Bài tập minh họa
3.1. Bài tập Điều chế kim loại - Cơ bản
Bài 1:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Sục khí Cl2 vào dung dịch FeCl2
(c) Dẫn khí H2 dư qua bột CuO nung nóng
(d) Cho Na vào dung dịch CuSO4 dư
(e) Nhiệt phân AgNO3
(f) Điện phân nóng chảy Al2O3
Sau khi kết thúc các phản ứng, những thí nghiệm thu được kim loại?
Hướng dẫn:
(a) Cho Mg vào dung dịch Fe3+(dư) tạo Fe2+
(b) \(C{l_2} + 2FeC{l_2} \overset{t^{0}}{\rightarrow} 2FeC{l_3}\)
(c) \({H_2} + CuO\overset{t^{0}}{\rightarrow}Cu + {H_2}O\)
(d) \(2Na + 2{H_2}O \to 2NaOH + {H_2};2NaOH + CuS{O_4} \to Cu{\left( {OH} \right)_2} + N{a_2}S{O_4}\)
(e) \(2AgN{O_3}\overset{t^{0}}{\rightarrow}2Ag + 2N{O_2} + {O_2}\)
(f) \(2A{l_2}{O_3}\overset{dpnc}{\rightarrow}4Al + 3{O_2}\)
Vậy có 3 thí nghiệm thu được kim loại là: (c); (e); (f)
Bài 2:
Trong các kim loại Cu; Ag; Na; K và Ba, số kim loại điều chế được bằng phương pháp thủy luyện là:
Hướng dẫn:
Phương pháp thủy luyện dùng để điều chế nững kim loại yếu, đứng sau H trong dãy hoạt động hóa học. Như vậy ta có các kim loại: Cu; Ag
Bài 3:
Bốn kim loại K, Al, Fe và Ag được ấn định không theo thứ tự là X, Y, Z, và T. Biết rằng X và Y được điều chế bằng phương pháp điện phân nóng chảy; X đẩy được kim loại T ra khỏi dung dịch muối; và Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. Các kim loại X, Y, Z và T theo thứ tự là:
Hướng dẫn:
Do X và Y điều chế bằng cách điện phân nóng chảy ⇒ đó là Al và K
Mà X đẩy được T ra khỏi muối ⇒ X là Al ⇒ Y là K
Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội ⇒ Z bị thụ động hóa trong H2SO4 đặc nguội.
⇒ Z là Fe ⇒ T là Ag.
Bài 4:
Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng, đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là:
Hướng dẫn:
Chất rắn gồm MgO và Cu (vì MgO không phản ứng với CO)
⇒ x = 20,8g
3.2. Bài tập Điều chế kim loại - Nâng cao
Bài 1:
Thổi rất chậm 2,24 lít (đktc) một hỗn hợp khí gồm CO và H2 qua một ống sứ đựng hỗn hợp Al2O3, CuO, Fe3O4, Fe2O3 có khối lượng là 24 gam dư đang được đun nóng. Sau khi kết thúc phản ứng khối lượng chất rắn còn lại trong ống sứ là:
Hướng dẫn:
\(n_{hh \ (CO + H_{2})} = \frac{2,24}{22,4} = 0,1 \ mol\)
Thực chất phản ứng khử các oxit là:
CO + O → CO2
H2 + O → H2O
Vậy: \(n_{O}=n_{CO}+n_{H_{2}} = 0,1 \ mol\)
Khối lượng chất rắn còn lại trong ống sứ là: 24 - 1,6 = 22,4 gam.
Bài 2:
Điện phân 10 ml dung dịch AgNO3 0,4M ( điện cực trơ ) trong thời gian 10 phút 30 giây với dòng điện có cường độ I = 2A, thu được m gam Ag. Giả sử hiệu suất phản ứng điện phân đạt 100%.
Hướng dẫn:
|
Tại catot |
Tại anot |
|
Ag+ + e → Ag 0,004 → 0,004 → 0,004 2H2O + 2e → H2 + 2OH- |
2H2O → 4H+ + O2 + 4e
|
Ta có: \({n_{e{\rm{ trao doi}}}} = \frac{{It}}{{96500}} = 0,013\,mol\)
Lớn hơn ne Ag nhường = 0,004 mol
\(\Rightarrow {m_{Ag}} = 0,004.108 = 0,432gam\)
4. Luyện tập Bài 21 Hóa học 12
Sau bài học cần nắm:
- Nguyên tắc điều chế kim loại
- Các phương pháp để điều chế như phương pháp nhiệt luyện, thủy luyện, điện phân
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 21 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Na, Ca, Al.
- B. Na, Ca, Zn.
- C. Na, Cu, Al.
- D. Fe, Ca, Al.
-
- A. Natri hiđroxit.
- B. Clorua vôi.
- C. Nước clo.
- D. Nước Gia-ven.
-
- A. 0,64 gam.
- B. 1,28 gam.
- C. 1,92 gam.
- D. 2,56 gam.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 21.
Bài tập 1 trang 98 SGK Hóa học 12
Bài tập 2 trang 98 SGK Hóa học 12
Bài tập 3 trang 98 SGK Hóa học 12
Bài tập 4 trang 98 SGK Hóa học 12
Bài tập 5 trang 98 SGK Hóa học 12
Bài tập 1 trang 140 SGK Hóa 12 Nâng cao
Bài tập 2 trang 140 SGK Hóa 12 Nâng cao
Bài tập 3 trang 140 SGK Hóa học 12 nâng cao
Bài tập 4 trang 140 SGK Hóa 12 Nâng cao
Bài tập 5 trang 140 SGK Hóa 12 Nâng cao
Bài tập 6 trang 140 SGK Hóa 12 Nâng cao
Bài tập 7 trang 140 SGK Hóa 12 Nâng cao
Bài tập 8 trang 140 SGK Hóa 12 Nâng cao
Bài tập 21.1 trang 46 SBT Hóa học 12
Bài tập 21.2 trang 46 SBT Hóa học 12
Bài tập 21.3 trang 46 SBT Hóa học 12
Bài tập 21.4 trang 46 SBT Hóa học 12
Bài tập 21.5 trang 46 SBT Hóa học 12
Bài tập 21.6 trang 47 SBT Hóa học 12
Bài tập 21.7 trang 47 SBT Hóa học 12
Bài tập 21.8 trang 47 SBT Hóa học 12
Bài tập 21.9 trang 47 SBT Hóa học 12
Bài tập 21.10 trang 47 SBT Hóa học 12
Bài tập 21.11 trang 47 SBT Hóa học 12
Bài tập 21.12 trang 47 SBT Hóa học 12
Bài tập 21.13 trang 48 SBT Hóa học 12
Bài tập 21.14 trang 48 SBT Hóa học 12
Bài tập 21.15 trang 48 SBT Hóa học 12
Bài tập 21.16 trang 48 SBT Hóa học 12
Bài tập 21.17 trang 48 SBT Hóa học 12
Bài tập 21.18 trang 48 SBT Hóa học 12
Bài tập 21.19 trang 48 SBT Hóa học 12
Bài tập 21.20 trang 49 SBT Hóa học 12
Bài tập 21.21 trang 49 SBT Hóa học 12
Bài tập 21.22 trang 49 SBT Hóa học 12
Bài tập 21.23 trang 49 SBT Hóa học 12
Bài tập 21.24 trang 49 SBT Hóa học 12
5. Hỏi đáp về Bài 21 Chương 5 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.