Giải bài 5 tr 98 sách GK Hóa lớp 12
Điện phân (điện cực trơ) dung dịch muối sunfat của một kim loại hoá trị II với dòng điện cường độ 3A. Sau 1930 giây điện phân thấy khối lượng catot tăng 1,92 gam.
a) Viết phương trình hoá học của phản ứng xảy ra tại mỗi điện cực và phương trình hoá học của sự ⇒điện phân.
b) Xác định tên kim loại.
Hướng dẫn giải chi tiết bài 5
Câu a:
Catot: M2+ + 2e → M
Anot: 2H2O → 4H+ + O2 + 4e
PTHH của phản ứng điện phân:
2MSO4 + 2H2O → 2M +O2 + 2H2SO4
Câu b:
\(\ m = \frac{Alt}{n.F} \Rightarrow A = \frac{2.96500.1,92}{3.1930} = 64\)
⇒ Kim loại Cu
-- Mod Hóa Học 12 HỌC247
Bài tập SGK khác
Bài tập 3 trang 98 SGK Hóa học 12
Bài tập 4 trang 98 SGK Hóa học 12
Bài tập 1 trang 140 SGK Hóa 12 Nâng cao
Bài tập 2 trang 140 SGK Hóa 12 Nâng cao
Bài tập 3 trang 140 SGK Hóa học 12 nâng cao
Bài tập 4 trang 140 SGK Hóa 12 Nâng cao
Bài tập 5 trang 140 SGK Hóa 12 Nâng cao
Bài tập 6 trang 140 SGK Hóa 12 Nâng cao
Bài tập 7 trang 140 SGK Hóa 12 Nâng cao
Bài tập 8 trang 140 SGK Hóa 12 Nâng cao
Bài tập 21.1 trang 46 SBT Hóa học 12
Bài tập 21.2 trang 46 SBT Hóa học 12
Bài tập 21.3 trang 46 SBT Hóa học 12
Bài tập 21.4 trang 46 SBT Hóa học 12
Bài tập 21.5 trang 46 SBT Hóa học 12
Bài tập 21.6 trang 47 SBT Hóa học 12
Bài tập 21.7 trang 47 SBT Hóa học 12
Bài tập 21.8 trang 47 SBT Hóa học 12
Bài tập 21.9 trang 47 SBT Hóa học 12
Bài tập 21.10 trang 47 SBT Hóa học 12
Bài tập 21.11 trang 47 SBT Hóa học 12
Bài tập 21.12 trang 47 SBT Hóa học 12
Bài tập 21.13 trang 48 SBT Hóa học 12
Bài tập 21.14 trang 48 SBT Hóa học 12
Bài tập 21.15 trang 48 SBT Hóa học 12
Bài tập 21.16 trang 48 SBT Hóa học 12
Bài tập 21.17 trang 48 SBT Hóa học 12
Bài tập 21.18 trang 48 SBT Hóa học 12
Bài tập 21.19 trang 48 SBT Hóa học 12
Bài tập 21.20 trang 49 SBT Hóa học 12
Bài tập 21.21 trang 49 SBT Hóa học 12
Bài tập 21.22 trang 49 SBT Hóa học 12
-


Để thu được Fe tinh khiết từ hỗn hợp của Fe và Al, có thể dùng lượng dư dung dịch:
bởi Bình Nguyen
 22/02/2021
Theo dõi (0) 1 Trả lời
22/02/2021
Theo dõi (0) 1 Trả lời -


Thực hiện các thí nghiệm sau: (a) Điện phân dung dịch \(CuSO_4\) bằng điện cực trơ.
bởi Nguyễn Quang Minh Tú
 21/02/2021
21/02/2021
(b) Nhúng thanh Fe vào dung dịch CuCl2.
(c) Thổi luồng khí CO đến dư qua ống sứ chứa CuO nung nóng.
(d) Đun nóng hỗn hợp gồm Al và CuO ở nhiệt độ cao.
(e) Cho hỗn hợp gồm Fe3O4 và Cu có tỉ lệ mol 1 : 1 vào dung dịch HCl loãng dư.
Sau khi kết thúc thí nghiệm, số thí nghiệm thu được Cu là
Theo dõi (0) 1 Trả lời -


Thực hiện các thí nghiệm sau: (a) Cho bột Cu vào lượng dư dung dịch \(FeCl_3\).
bởi Trần Thị Trang
 21/02/2021
21/02/2021
(b) Cho bột Fe vào lượng dư dung dịch CuCl2.
(c) Nung nóng hỗn hợp gồm ZnO và cacbon trong điều kiện không có không khí.
(d) Nhiệt phân NaNO3.
(e) Cho Na vào dung dịch CuSO4.
(g) Đốt cháy Ag2S trong oxi dư.
Số thí nghiệm thu được kim loại là
Theo dõi (0) 1 Trả lời -


Cho luồng khí \(H_2\) dư lần lượt qua các ống mắc nối tiếp đựng các oxit nung nóng như hình vẽ sau:
bởi Bảo khanh
 22/02/2021
22/02/2021
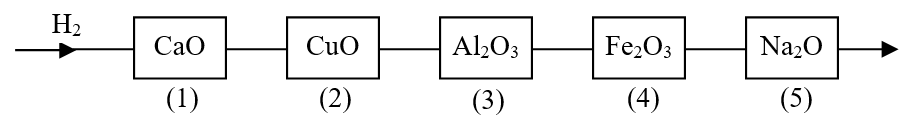
Các ống xảy ra phản ứng khử oxit kim loại thành kim loại là
Theo dõi (0) 1 Trả lời -
ADMICRO


Điện phân các dung dịch sau đây với điện cực trơ có màng ngăn xốp: (a) dung dịch NaCl; (b) dung dịch \(CuSO_4\); (c) dung dịch \(NaNO_3\); (d) dung dịch \(AgNO_3\). Sau quá trình điện phân, dung dịch có môi trường bazơ là
bởi Aser Aser
 22/02/2021
Theo dõi (0) 1 Trả lời
22/02/2021
Theo dõi (0) 1 Trả lời -


Cho các phản ứng sau: (a) 2Al + \(Cr_2O_3 → Al_2O_3\) + 2Cr. (b) Cu + 2\(AgNO_3\) → \(Cu(NO_3)_2\) + 2Ag.
bởi Long lanh
 21/02/2021
21/02/2021
(c) ZnO + C → Zn + CO. (d) 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3.
(d) Fe2O3 + 3H2 → 2Fe + 3H2O. (e) HgS + O2 → Hg + SO2.
Số phản ứng dùng để điều chế kim loại bằng phương pháp nhiệt luyện là
Theo dõi (0) 1 Trả lời -


Tiến hành điện phân dung dịch chứa \(CuSO_4\) và NaCl bằng điện cực trơ, màng ngăn xốp đến khi khí bắt đầu thoát ra ở cả hai cực thì dừng điện phân. Dung dịch sau điện phân hòa tan được \(Al_2O_3\). Nhận định nào sau đây là đúng?
bởi My Le
 22/02/2021
22/02/2021
A. Khí thoát ra ở anot gồm Cl2 và O2.
B. Khí thoát ra ở anot chỉ có Cl2.
C. H2O tham gia điện phân ở catot.
D. Ở catot có khí H2 thoát ra.
Theo dõi (0) 1 Trả lời





