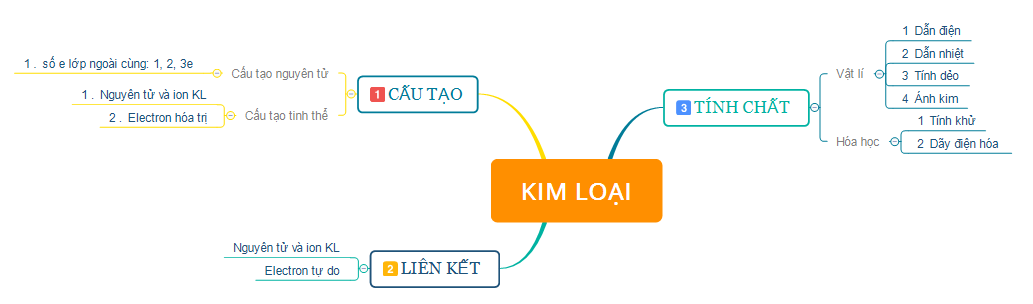
Tiết học ôn tập, hệ thống hóa kiến thức về tính chất vật lí, hóa học của kim loại và vận dụng vào việc giải các bài tập liên quan đến kim loại.
Tóm tắt lý thuyết
Bài tập minh họa
3.1. Bài tập Tính chất của kim loại - Cơ bản
Bài 1:
Các phát biểu sau đây Đúng hay Sai? Vì sao?
a. Kim loại có độ cứng lớn nhất là Cr.
b. Kim loại dẫn điện tốt nhất là Cu.
c. Kim loại có nhiệt độ nóng chảy cao nhất là W.
d. Kim loại có khối lượng riêng nhỏ nhất là Li.
Hướng dẫn:
a. Đúng. Kim loại cứng nhất là Cr, kim loại mềm nhất là Cs.
b. Sai. Độ dẫn điện giảm dần theo dãy: Ag > Cu > Au > Al > Fe.
c. Đúng. Kim loại có nhiệt độ nóng chảy cao nhất là W, kim loại có độ nóng chảy thấp nhất là Hg.
d Đúng. Kim loại có khối lượng riêng lớn nhất là Os, kim loại có khối lượng riêng nhỏ nhất là Li.
Bài 2:
Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là:
Hướng dẫn:
Theo thứ tự phản ứng thì Fe phản ứng trước
\(Fe + 4HN{O_3} \to Fe{(N{O_3})_3} + N{O^ \uparrow } + 2{H_2}O\)
X + HNO3 loãng nóng -> Y + chất rắn Z không tan
=> Z có Cu và có thể có Fe(dư)
Vì Z + H2SO4 loãng thấy có khí thoát => Z phải có Fe dư
\(F{e_{(du)}} + 2Fe{(N{O_3})_3} \to 3Fe{(N{O_3})_2}\)
=> trong Y chỉ có Fe(NO3)2
Bài 3:
Cho hỗn hợp gồm Fe và Mg vào dung dịch AgNO3 khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (gồm 2 muối) và chất rắn Y (gồm 2 kim loại). 2 muối trong X là:
Hướng dẫn:
(1) Mg + 2Ag+ → Mg2+ + 2Ag
(2) Fe + 2Ag+ → Fe2+ + 2Ag
(3) Fe2+ + Ag+ → Fe3+ + Ag
Vì Chất rắn Y gồm 2 kim loại ⇒ đó là Ag và Fe ⇒ không thể xảy ra (3) và Ag+ phải hết
⇒ X gồm Mg2+ và Fe2+
3.2. Bài tập Tính chất của kim loại - Nâng cao
Bài 1:
Lấy 14,3g hỗn hợp X gồm Mg, Al, Zn đem đốt nóng trong oxi dư, sau khi phản ứng xảy ra hoàn toàn thì nhận được 22,3g hỗn hợp Y gồm 3 oxit. Tính thể tích dung dịch HCl 2M tối thiểu cần dùng để hòa tan hỗn hợp Y.
Hướng dẫn:
Bảo toàn khối lượng : mX + mO (pứ) = mY => nO(pứ) = 0,5 mol
Phản ứng tổng quát : \(O + 2{H^ + } \to {H_2}O\)
\(\Rightarrow {n_{HCl}} = 2{n_{{O^{2 - }}}} = 2.0,5 = 1{\rm{ }}(mol)\)
=> Vdd HCl = 0,5 lit = 500 ml
Bài 2:
Cho a mol Fe phản ứng vừa đủ với b mol H2SO4 (đặc, nóng) thu được khí SO2 (sản phẩm khử duy nhất) và 5,04 gam muối. Biết tỉ lệ a : b = 3 : 7. Giá trị của a là:
Hướng dẫn:
Muối gồm: \(\left\{\begin{matrix} FeSO_{4}: \ x \ mol \ \ \ \ \\ Fe_{2}(SO_{4})_{3}: \ y \ mol \end{matrix}\right. \rightarrow 152x+400y = 5,04 \ \ (1)\)
Số mol e nhường = 2x + 6y → Số mol SO2 = x + 3y
→ Số mol H2SO4 phản ứng = 2x + 6y (mol)
Theo bài ra ta có:
\(\frac{n_{Fe}}{n_{H_{2}SO_{4}}} = \frac{3}{7} \Rightarrow \frac{x+2y}{2x+6y} = \frac{3}{7} \Rightarrow x - 4y = 0 \ \ (2)\)
Giải (1) và (2) ta được: \(\left\{\begin{matrix} x = 0,02 \ \\ y = 0,005 \end{matrix}\right. \Rightarrow a = x + 2y = 0,03 \ (mol)\)
4. Luyện tập Bài 22 Hóa học 12
Sau bài học cần nắm:
- Tính chất vật lí, hóa học của kim loại
- Vận dụng vào việc giải các bài tập liên quan đến kim loại.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 12 Bài 22 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Ag
- B. Cu
- C. Al
- D. Au
-
- A. NaOH
- B. Ag
- C. BaCl2
- D. Fe
-
- A. Thanh Fe có màu trắng và dung dịch nhạt dần màu xanh
- B. Thanh Fe có màu đỏ và dung dịch nhạt dần màu xanh
- C. Thanh Fe có màu xám và dung dịch nhạt dần màu xanh
- D. Thanh Fe có màu đỏ và dung dịch dần có màu xanh
-
- A. 12,18.
- B. 8,40.
- C. 7,31.
- D. 8,12.
-
- A. 0,10.
- B. 0,12.
- C. 0,4.
- D. 0,8.
-
- A. Fe(NO3)3
- B. Fe(NO3)2
- C. Fe(NO3)2 , Cu(NO3)2
- D. Fe(NO3)3 , Fe(NO3)2
-
- A. 2.
- B. 5.
- C. 3.
- D. 4.
Câu 8-20: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 12 Bài 22.
Bài tập 1 trang 100 SGK Hóa học 12
Bài tập 2 trang 100 SGK Hóa học 12
Bài tập 3 trang 100 SGK Hóa học 12
Bài tập 4 trang 100 SGK Hóa học 12
Bài tập 5 trang 101 SGK Hóa học 12
Bài tập 6 trang 101 SGK Hóa học 12
Bài tập 7 trang 101 SGK Hóa học 12
Bài tập 8 trang 101 SGK Hóa học 12
Bài tập 9 trang 101 SGK Hóa học 12
Bài tập 10 trang 101 SGK Hóa học 12
Bài tập 22.1 trang 49 SBT Hóa học 12
Bài tập 22.2 trang 49 SBT Hóa học 12
Bài tập 22.3 trang 49 SBT Hóa học 12
Bài tập 22.4 trang 50 SBT Hóa học 12
Bài tập 22.5 trang 50 SBT Hóa học 12
Bài tập 22.6 trang 50 SBT Hóa học 12
Bài tập 22.7 trang 50 SBT Hóa học 12
Bài tập 22.8 trang 50 SBT Hóa học 12
Bài tập 22.9 trang 50 SBT Hóa học 12
Bài tập 22.10 trang 50 SBT Hóa học 12
Bài tập 22.11 trang 51 SBT Hóa học 12
Bài tập 22.12 trang 51 SBT Hóa học 12
Bài tập 22.13 trang 51 SBT Hóa học 12
Bài tập 22.14 trang 51 SBT Hóa học 12
Bài tập 22.15 trang 51 SBT Hóa học 12
Bài tập 22.16 trang 51 SBT Hóa học 12
Bài tập 22.17 trang 52 SBT Hóa học 12
Bài tập 22.18 trang 52 SBT Hóa học 12
Bài tập 22.19 trang 52 SBT Hóa học 12
Bài tập 1 trang 125 SGK Hóa học 12 nâng cao
Bài tập 2 trang 125 SGK Hóa học 12 nâng cao
Bài tập 3 trang 125 SGK Hóa học 12 nâng cao
Bài tập 4 trang 125 SGK Hóa học 12 nâng cao
Bài tập 5 trang 126 SGK Hóa học 12 nâng cao
Bài tập 6 trang 126 SGK Hóa học 12 nâng cao
Bài tập 7 trang 126 SGK Hóa học 12 nâng cao
Bài tập 8 trang 126 SGK Hóa học 12 nâng cao
Bài tập 9 trang 126 SGK Hóa học 12 nâng cao
Bài tập 10 trang 126 SGK Hóa học 12 nâng cao
5. Hỏi đáp về Bài 22 Chương 5 Hoá học 12
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.