NŠĽôi dung b√†i hŠĽćc B√†i 7: Xu h∆įŠĽõng biŠļŅn ńĎŠĽēi th√†nh phŠļßn v√† mŠĽôt sŠĽĎ t√≠nh chŠļ•t cŠĽßa hŠĽ£p chŠļ•t trong mŠĽôt chu k√¨ m√īn H√≥a hŠĽćc ch∆į∆°ng tr√¨nh KŠļŅt nŠĽĎi tri thŠĽ©c sŠļĹ gi√ļp c√°c em hŠĽćc sinh giŠļ£i ńĎ√°p c√°c vŠļ•n ńĎŠĽĀ li√™n quan ńĎŠļŅn m√īn hŠĽćc nh∆į: Xu h∆įŠĽõng biŠļŅn ńĎŠĽēi th√†nh phŠļßn v√† t√≠nh acid ‚Äď base cŠĽßa c√°c oxide v√† c√°c hydroxide theo chu k√¨ cŇ©ng nh∆į biŠļŅt c√°ch viŠļŅt ńĎ∆įŠĽ£c ph∆į∆°ng tr√¨nh ho√° hŠĽćc minh hoŠļ°.
MŠĽĚi c√°c em c√Ļng tham khŠļ£o nŠĽôi dung chi tiŠļŅt ńĎ∆įŠĽ£c HOC247 bi√™n soŠļ°n v√† tŠĽēng hŠĽ£p b√™n d∆įŠĽõi ńĎ√Ęy!
T√≥m tŠļĮt l√Ĺ thuyŠļŅt
1.1. Th√†nh phŠļßn cŠĽßa c√°c Oxide v√† Hydroxide
- Ho√° trŠĽč cao nhŠļ•t cŠĽßa c√°c nguy√™n tŠĽĎ nh√≥m A trong hŠĽ£p chŠļ•t vŠĽõi oxygen tńÉng tŠĽę I ńĎŠļŅn VII khi ńĎi tŠĽę tr√°i qua phŠļ£i trong mŠĽôt chu k√¨ (trŠĽę chu k√¨ 1 v√† nguy√™n tŠĽĎ fluorine ŠĽü chu k√¨ 2), do ńĎ√≥ th√†nh phŠļßn cŠĽßa c√°c oxide v√† hydroxide c√≥ sŠĽĪ lŠļ∑p lŠļ°i theo chu k√¨.
BŠļ£ng 7.1. C√īng thŠĽ©c oxide, hydroxide ŠĽßng vŠĽõi ho√° trŠĽč cao nhŠļ•t cŠĽßa c√°c nguy√™n tŠĽĎ thuŠĽôc chu k√¨ 2, 3
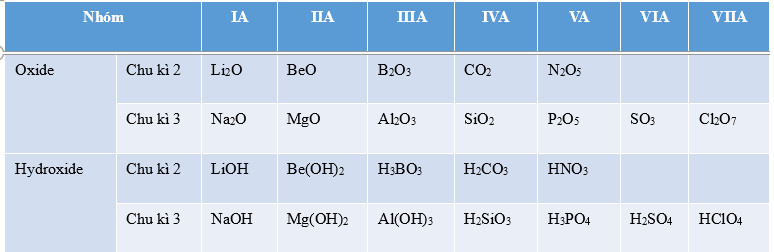
|
- H√≥a trŠĽč cao nhŠļ•t cŠĽßa vŠĽõi oxy cŠĽßa nguy√™n tŠĽĎ nh√≥m A tńÉng tŠĽę I ńĎŠļŅn VII tŠĽę tr√°i qua phŠļ£i trong mŠĽôt chu k√¨. - Th√†nh phŠļßn cŠĽßa c√°c oxide v√† hydroxide c√≥ sŠĽĪ lŠļ∑p lŠļ°i theo chu k√¨. |
|---|
1.2. T√≠nh chŠļ•t cŠĽßa Oxide v√† Hydroxide
- C√°c oxide khi t√°c dŠĽ•ng vŠĽõi n∆įŠĽõc tŠļ°o th√†nh hydroxide c√≥ t√≠nh base hoŠļ∑c acid. N√≥i chung. hydroxide cŠĽßa c√°c nguy√™n tŠĽĎ nh√≥m l√† thŠĽÉ hiŠĽán tinh base mŠļ°nh, hydroxide ŠĽ©ng vŠĽõi ho√° trŠĽč cao nhŠļ•t cŠĽßa c√°c nguy√™n tŠĽĎ nh√≥m VIIA (trŠĽę fluorine) thŠĽÉ hiŠĽán t√≠nh acid mŠļ°nh.
BŠļ£ng 7.2. T√≠nh acid - base cŠĽßa oxide v√† hydroxide ŠĽ©ng vŠĽõi ho√° trŠĽč cao nhŠļ•t
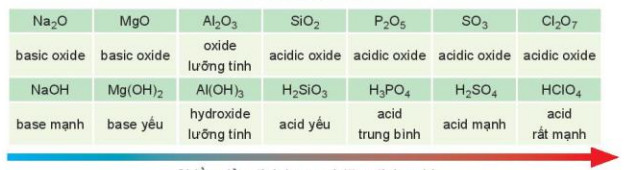
ChiŠĽĀu giŠļ£m tŠĽČnh base v√† tńÉng t√≠nh acid
| Trong mŠĽôt chu k√¨: theo chiŠĽĀu tńÉng dŠļßn cŠĽßa ńĎiŠĽán t√≠ch hŠļ°t nh√Ęn, tŠĽČnh base cŠĽßa oxide v√† hydroxide t∆į∆°ng ŠĽ©ng giŠļ£m dŠļßn, ńĎŠĽďng thŠĽĚi t√≠nh acid cŠĽßa ch√ļng tńÉng dŠļßn. |
|---|
B√†i tŠļ≠p minh hŠĽća
B√†i 1: Trong mŠĽôt chu k√¨ cŠĽßa bŠļ£ng tuŠļßn ho√†n, t√≠nh chŠļ•t cŠĽßa c√°c oxide v√† hydroxide biŠļŅn ńĎŠĽēi theo xu h∆įŠĽõng n√†o?
H∆įŠĽõng dŠļęn giŠļ£i
- ńźŠļßu chu k√¨ l√† mŠĽôt kim loŠļ°i mŠļ°nh ‚Üí tŠļ°o oxide c√≥ t√≠nh base v√† hydroxide mŠļ°nh.
- KŠļŅt th√ļc chu k√¨ l√† mŠĽôt phi kim mŠļ°nh ‚Üí tŠļ°o oxide c√≥ t√≠nh acid v√† acid mŠļ°nh ( hydroxide yŠļŅu)
Trong mŠĽôt chu k√¨, theo chiŠĽĀu tńÉng dŠļßn cŠĽßa ńĎiŠĽán t√≠ch hŠļ°t nh√Ęn, t√≠nh base cŠĽßa oxide v√† hydroxide t∆į∆°ng ŠĽ©ng giŠļ£m dŠļßn v√† t√≠nh acid cŠĽßa ch√ļng tńÉng dŠļßn.
B√†i 2: Trong c√°c chŠļ•t d∆įŠĽõi ńĎ√Ęy, chŠļ•t n√†o c√≥ t√≠nh acid yŠļŅu nhŠļ•t
A. H2SO4
B. HClO4
C. H3PO4
D. H2SiO3
D. H3‚ÄčPO4‚Äč
H∆įŠĽõng dŠļęn giŠļ£i
|
T√™n nguy√™n tŠĽĎ |
Si |
P |
S |
Cl |
|
Z |
14 |
15 |
16 |
17 |
Trong mŠĽôt chu k√¨, t√≠nh acid cŠĽßa c√°c hydroxide tńÉng dŠļßn theo chiŠĽĀu tńÉng dŠļßn cŠĽßa ńĎiŠĽán t√≠ch hŠļ°t nh√Ęn.
‚Üí ńź√°p √°n B
B√†i 3: NhŠĽĮng ńĎŠļ°i l∆įŠĽ£ng v√† t√≠nh chŠļ•t n√†o cŠĽßa nguy√™n tŠĽĎ h√≥a hŠĽćc cho d∆įŠĽõi d√Ęy kh√īng biŠļŅn ńĎŠĽēi tuŠļßn ho√†n theo chiŠĽĀu tńÉng cŠĽßa ńĎiŠĽán t√≠ch hŠļ°t nh√Ęn nguy√™n tŠĽ≠?
A. T√≠nh kim loŠļ°i v√† phi kim
B. T√≠nh acid ‚Äď base cŠĽßa c√°c hydroxide
C. KhŠĽĎi l∆įŠĽ£ng nguy√™n tŠĽ≠.
D. CŠļ•u h√¨nh electron lŠĽõp ngo√†i c√Ļng cŠĽßa nguy√™n tŠĽ≠.
H∆įŠĽõng dŠļęn giŠļ£i
C√°c ńĎŠļ°i l∆įŠĽ£ng biŠļŅn ńĎŠĽēi tuŠļßn ho√†n theo chiŠĽĀu tńÉng cŠĽßa ńĎiŠĽán t√≠ch hŠļ°t nh√Ęn:
+ T√≠nh kim loŠļ°i v√† phi kim
+ T√≠nh acid ‚Äď base cŠĽßa c√°c hydroxide
+ CŠļ•u h√¨nh electron lŠĽõp ngo√†i c√Ļng
‚Üí ńź√°p √°n C
LuyŠĽán tŠļ≠p B√†i 7 H√≥a 10 KNTT
Sau b√†i hŠĽćc n√†y, hŠĽćc sinh sŠļĹ:
- NhŠļ≠n x√©t ńĎ∆įŠĽ£c xu h∆įŠĽõng biŠļŅn ńĎŠĽēi th√†nh phŠļßn v√† t√≠nh acid ‚Äď base cŠĽßa c√°c oxide v√† c√°c hydroxide theo chu k√¨.
- ViŠļŅt ńĎ∆įŠĽ£c ph∆į∆°ng tr√¨nh ho√° hŠĽćc minh hoŠļ°.
3.1. TrŠļĮc nghiŠĽám B√†i 7 H√≥a 10 KNTT
C√°c em c√≥ thŠĽÉ hŠĽá thŠĽĎng lŠļ°i nŠĽôi dung kiŠļŅn thŠĽ©c ńĎ√£ hŠĽćc ńĎ∆įŠĽ£c th√īng qua b√†i kiŠĽÉm tra TrŠļĮc nghiŠĽám H√≥a hŠĽćc 10 KNTT B√†i 7 cŠĽĪc hay c√≥ ńĎ√°p √°n v√† lŠĽĚi giŠļ£i chi tiŠļŅt.
-
- A. X2Y3
- B. X2Y5
- C. X3Y2
- D. X5Y2
-
- A. NaCl
- B. NaF
- C. MgO
- D. B v√† C ńĎ√ļng
-
- A. Na, K
- B. Li, Be
- C. Li, Na
- D. K, Rb
C√Ęu 4-10: MŠĽĚi c√°c em ńĎńÉng nhŠļ≠p xem tiŠļŅp nŠĽôi dung v√† thi thŠĽ≠ Online ńĎŠĽÉ cŠĽßng cŠĽĎ kiŠļŅn thŠĽ©c vŠĽĀ b√†i hŠĽćc n√†y nh√©!
3.2. B√†i tŠļ≠p SGK B√†i 7 H√≥a 10 KNTT
C√°c em c√≥ thŠĽÉ xem th√™m phŠļßn h∆įŠĽõng dŠļęn GiŠļ£i b√†i tŠļ≠p H√≥a hŠĽćc 10 KNTT B√†i 7 ńĎŠĽÉ gi√ļp c√°c em nŠļĮm vŠĽĮng b√†i hŠĽćc v√† c√°c ph∆į∆°ng ph√°p giŠļ£i b√†i tŠļ≠p.
GiŠļ£i c√Ęu hŠĽŹi 1 trang 40 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
HoŠļ°t ńĎŠĽông 1 trang 41 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
HoŠļ°t ńĎŠĽông 2 trang 41 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i c√Ęu hŠĽŹi 2 trang 42 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i c√Ęu hŠĽŹi 3 trang 42 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i c√Ęu hŠĽŹi 4 trang 42 SGK H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.1 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.2 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.3 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.4 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.5 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.6 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.7 trang 18 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.8 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.9 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.10 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.11 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.12 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.13 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.14 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.15 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.16 trang 19 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.17 trang 20 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.18 trang 20 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.19 trang 20 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
GiŠļ£i b√†i 7.20 trang 20 SBT H√≥a hŠĽćc 10 KŠļŅt nŠĽĎi tri thŠĽ©c - KNTT
HŠĽŹi ńĎ√°p B√†i 7 H√≥a hŠĽćc 10 KNTT
Trong qu√° tr√¨nh hŠĽćc tŠļ≠p nŠļŅu c√≥ thŠļĮc mŠļĮc hay cŠļßn trŠĽ£ gi√ļp g√¨ th√¨ c√°c em h√£y comment ŠĽü mŠĽ•c HŠĽŹi ńĎ√°p, CŠĽông ńĎŠĽďng H√≥a hŠĽćc HOC247 sŠļĹ hŠĽó trŠĽ£ cho c√°c em mŠĽôt c√°ch nhanh ch√≥ng!
Ch√ļc c√°c em hŠĽćc tŠļ≠p tŠĽĎt v√† lu√īn ńĎŠļ°t th√†nh t√≠ch cao trong hŠĽćc tŠļ≠p!





