HOC247 xin giới thiệu đến quý phụ huynh và các em học sinh nội dung bài giảng Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm môn Hóa học 10 chương trình Kết nối tri thức bên dưới đây. Thông qua bài học này các em sẽ giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì, trong một nhóm, cũng như nhận xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử...Mời các em cùng theo dõi nội dung chi tiết sau.
Tóm tắt lý thuyết
1.1. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Bảng 6.1. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A
.jpg)
- Nhóm A gồm các nguyên tố s và p. Nguyên tử của các nguyên tố cùng một nhóm A có số electron lớp ngoài cùng (electron hoá trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hoá trị dẫn đến sự tương tự nhau về tính chất hoá học của các nguyên tố trong cùng nhóm A.
- Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn. Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
1.2. Bán kính nguyên tử
- Một cách gần đúng, bán kinh nguyên tử được xác định bằng nửa khoảng cách trung bình giữa hai hạt nhân nguyên tử gần nhau nhất trong chất rắn đon chất hoặc trong phân từ hai nguyên tử giống nhau.
.jpg)
Hình 6.1. Sự giảm bán kính nguyên tử của các nguyên tố trong chu kì 3
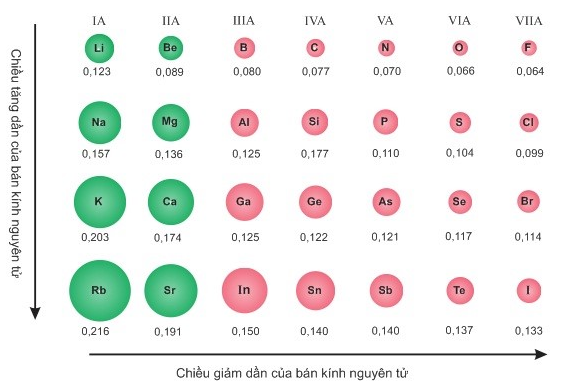
Hình 6.2. Giá trị bán kính nguyên tử (pm)
- Bán kinh nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng.
- Bán kinh giảm là do lực hút tăng và ngược lại, bán kinh tăng là do lực hút giảm.
- Xu hướng biến đổi bán kinh nguyên tử:
+ Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dân của điện tích hạt nhân.
+ Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
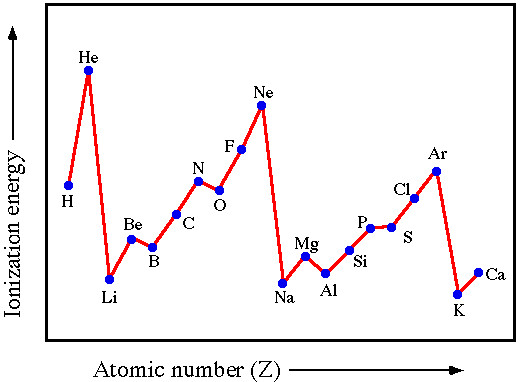
Hình 6.3. Sự biến đổi năng lượng ion hoá thứ nhất của các nguyên tố chu kì 2 và 3
- Năng lượng ion hoá thứ nhất của nguyên tử là năng lượng tối thiểu cần thiết để tách electron thử nhất ra khỏi nguyên tử ở thể khi, ở trạng thái cơ bản: X(g) → X*(g) + e
- Năng lượng ion hoá thứ nhất kí hiệu là I1, đơn vị là kJ/mol.
Ví dụ:
- Để tách một mol electron ra khỏi mộ mol nguyên tử hydrogen theo quá trình: H(g) → H+ (g) + e phải tiêu tốn một năng lượng là 1312 kJ, do đó I1 = 1312 kJ/mol.
- Trong một chu kì, năng lượng ion hoá thứ nhất có xu hướng tăng theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, năng lượng ion hoả thử nhất có xu hướng giảm theo chiều tăng dần của điện tích hạt nhân.
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử - Trong một chu kì: Bán kính nguyên tử giảm dần - Trong một nhóm A: Bán kính nguyên tử tăng dần |
|---|
1.3. Độ âm điện
- Độ âm điện của nguyên tử (\(\chi \)) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hoá học khi tạo thành liên kết hoá học.
- Khi tham gia liên kết hoá học, nguyên tử Có độ âm điện nhỏ dễ nhường electron, nguyên tử có độ âm điện lớn dễ nhận electron.
Dưới đây là bảng giá trị độ âm điện do nhà hoá học L. C. Pauling (Pau-linh) thiết lập vào năm 1932.
Bảng 6.2. Giá trị độ âm điện tương đối theo L. C. Pauling
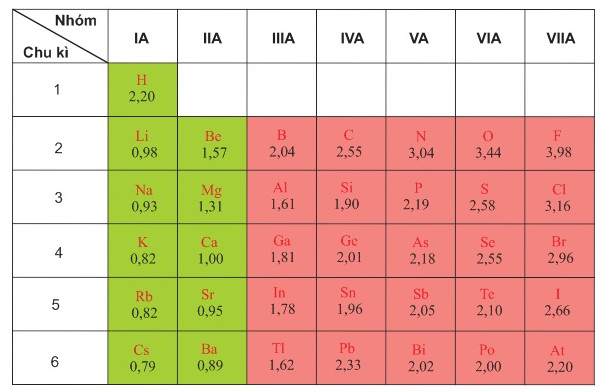
- Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu ki.
- Trong một chu kì, khi số electron lớp ngoài cũng tăng, điện tích hạt nhân tăng thị lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
- Trong một nhómA, khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm.
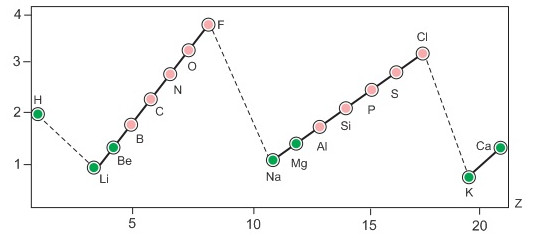
Hình 6.4. Sự biến đổi độ âm điện theo chu kì và nhóm
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử - Trong một chu kì: Độ âm điện tăng dần - Trong một nhóm A: Độ âm điện giảm dần |
|---|
1.4. Tính kim loại và tính phi kim
a. Khái niệm
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron. để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm, Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành con âm, tính phi kim của nguyên tố đó càng mạnh.
b. Sự biến đổi tính kim loại, tính phi kim
- Xu hướng biến đổi tính kim loại và tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần. Do bản kinh nguyên tử giảm, lực hút giữa hạt nhân với các electron lớp ngoài cùng tang, dẫn đến khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng.
+ Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tỉnh kim loại tăng dần và tính phi kim giảm dần. Tuy điện tích hạt nhân tăng dần, nhưng bản kinh nguyên tử tăng nhanh hơn, lực hút giữa hạt nhân với các electron lớp ngoài cũng giảm dẫn đến khả năng nhường electron tăng nên tính kim loại tầng, khả năng nhận electron giảm nên tính phi kim giảm.
|
Theo chiều tăng dần của điện tích hạt nhân nguyên tử - Trong một chu kì: + Tính kim loại giảm dần và tính phi kim tăng dần. + Số electron hoá trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8. - Trong một nhóm A: Tính kim loại tăng dần và tính phi kim giảm dần. |
|---|
Bài tập minh họa
Bài 1: Trong bảng tuần hoàn, một số tính chất của nguyên tử và đơn chất biến đổi theo xu hướng nào trong một chu kì, trong một nhóm A? Vì sao?
Hướng dẫn giải
- Trong một chu kì, khi đi từ trái sang phải:
+ Bán kính nguyên tử giảm dần, độ âm điện tăng dần.
+ Tính kim loại giảm dần và tính phi kim tăng dần.
+ Số electron hóa trị của nguyên tử các nguyên tố nhóm A tăng lần lượt từ 1 đến 8
- Trong một nhóm A, khi đi từ trên xuống dưới:
+ Bán kính nguyên tử tăng dần, độ âm điện giảm dần
+ Tính kim loại tăng dần và tính phi kim giảm dần.
+ Số lớp electron của nguyên tử các nguyên tố tăng dần
Bài 2: Viết cấu hình electron của nguyên tử magie (Z = 12). Để đạt được cấu hình electron nguyên tử của khí hiếm gần nhất trong bảng tuần hoàn, nguyên tử magie nhân hay nhường bao nhiêu electron? Magie thể hiện tính chất kim loại hay phi kim?
Hướng dẫn giải
- Cấu hình electron của nguyên tử Mg (Z = 12) là: 1s22s22p63s2.
- Để đạt cấu hình electron của khí hiếm gần nhất (Ne) trong Bảng tuần hoàn nguyên tử Mg nhường 2 electron để đạt 8e ở lớp ngoài cùng.
– Mg có tính kim loại: Mg – 2e → Mg2+
Bài 3: Độ âm điện của một nguyên tử là gì? Giá trị độ âm điện của nguyên tử các nguyên tố trong các nhóm A biến đổi như thế nào theo chiều điện tích hạt nhân tăng?
Hướng dẫn giải
- Độ âm điện của một nguyên tố đặc trưng cho khả năng hút electron của nguyên tử nguyên tố đó trong phân tử (những electron bị hút là những electron nằm trong liên kết giữa các nguyên tử trong phân tử).
- Độ âm điện của nguyên tử các nguyên tố trong các nhóm A giảm dần theo chiều tăng của điện tích hạt nhân.
* Ví dụ: Độ âm điện giảm theo chiều tăng điện tích hạt nhân
| Nhóm IA | 3Li | 11Na | 19K | 37Pb | 35Co |
| Độ âm điện | 1 | 0,9 | 0,8 | 0,8 | 0,7 |
Luyện tập Bài 6 Hóa 10 KNTT
Sau bài học này, học sinh sẽ:
- Giải thích được xu hướng biến đổi bán kính nguyên tử trong một chu kì, trong một nhóm (nhóm A) (dựa theo lực hút tĩnh điện của hạt nhân với electron ngoài cùng và dựa theo số lớp electron tăng trong một nhóm theo chiều từ trên xuống dưới).
- Nhận xét và giải thích được xu hướng biến đổi độ âm điện và tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A).
3.1. Trắc nghiệm Bài 6 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 KNTT Bài 6 cực hay có đáp án và lời giải chi tiết.
-
- A. Cs; F
- B. K; Cl
- C. F; Cs
- D. Cl; K
-
- A. Cs
- B. F
- C. Li
- D. I
-
- A. khả năng tham gia phản ứng mạnh hay yếu.
- B. khả năng nhường proton cho nguyên tử khác.
- C. khả năng nhường electron cho nguyên tử khác.
- D. khả năng hút electron của nguyên tử trong phân tử
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 6 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 KNTT Bài 6 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 35 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 35 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 36 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 37 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 37 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 39 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 7 trang 39 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.1 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.2 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.3 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.4 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.5 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.6 trang 15 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.7 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.8 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.9 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.10 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.11 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.12 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.13 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.14 trang 16 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.15 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.16 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.17 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.18 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.19 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.20 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.21 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.22 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.23 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 6.24 trang 17 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 6 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!


