Nhằm giúp các em có thêm đề thi tham khảo, chuẩn bị thật tốt cho kì thi sắp đến. Hoc247 đã biên soạn Bộ 5 đề thi HK2 môn Hóa học 10 năm 2021, đề thi gồm tuyển tập các câu hỏi trắc nghiệm và tự luận được chọn lọc từ đề thi của Trường THPT Trần Đại Nghĩa sẽ giúp các em làm quen với cấu trúc với đề thi. Đồng thời, kèm với mỗi đề thi đều có đáp án và gợi ý giải giúp các em vừa luyện tập vừa đối chiếu kết quả.
|
TRƯỜNG THPT TRẦN ĐẠI NGHĨA |
ĐỀ THI HỌC KÌ 2 NĂM 2021 MÔN LỊCH SỬ 10 THỜI GIAN 45 PHÚT |
ĐỀ SỐ 1
Câu 1. SO2 bị lẫn tạp chất SO3, dùng cách nào dưới đây để thu được SO2 nguyên chất?
A. dung dịch Na2CO3
B. sục hỗn hợp khí qua nước vôi trong dư
C. sục hỗn hợp khí từ từ qua cho hỗn hợp khí sục từ từ qua dung dịch nước brom.
D. sục hỗn hợp khí qua dung dịch BaCl2 loãng dư.
Câu 2. Cho phản ứng thuận nghịch ở trạng thái cân bằng:
4 NH3 (k) + 3 O2 (k) ⮀ 2 N2 (k) + 6 H2O(h) <0. Cân bằng sẽ chuyển dịch theo chiều thuận khi:
A. Giảm nhiệt độ B. Thêm chất xúc tác C. Tăng áp suất D. Thêm hơi nước
Câu 3. Hòa tan 100g SO3 vào 1 lít dung dịch H2SO4 17% (D = 1,12 g/ml) thu được dung dịch X. Nồng độ % của dung dịch X:
A. 30% B. 40% C. 47,47% D. 25,65%
Câu 4. Cho 3 bình riêng biệt đựng 3 dung dịch HCl, Ba(NO3)2 và H2SO4. Thuốc thử dùng thêm để phân biệt các dung dịch trên là:
A. Dung dịch NaNO3 B. Dung dịch NaOH C. Dung dịch NaCl D. Quì tím
Câu 5. Để m gam Fe ngoài không khí, sau một thời gian được 7,2 gam hỗn hợp X gồm FeO, Fe2O3, Fe3O4 và Fe. Hòa tan hết X vào dung dịch H2SO4 đặc nóng dư thu được V lít khí SO2 (ở đktc) sản phẩm khử duy nhất. Tính m và V biết số mol H2SO4 đã pứ là 0,2 mol.
A. 2,8 gam ;2,24 lít B. 11,2 gam ;4,48 lít C. 8,4, gam ;3,36 lít D. 5,6 gam ;1,12 lít
Câu 6. Bằng phương pháp hóa học chất dùng để phân biệt khí H2S và khí SO2 là
A. Dung dịch NaOH B. Dung dịch brom C. Dung dịch Pb(NO3)2 D. Dung dịch KOH
Câu 7. Ag để trong không khí bị biến thành màu đen do không khí bị nhiễm bẩn chất nào dưới đây?
A. HCl hoặc Cl2. B. SO2 và SO3.
C. H2 hoặc hơi nước. D. Ozon hoặc hiđrosunfua.
Câu 8. Hãy xác định công thức ôlêum tạo thành khi cho 180g dung dịch H2SO4 98% hấp thụ hết 22,4 l SO3 (đktc).
A. H2SO4.2SO3 B. H2SO4.1,4SO3 C. H2SO4.SO3 D. H2SO4.0,4SO3
Câu 9. Chỉ ra so sánh đúng
A. Tính axit: HF> HCl> HBr>HI B. Tính axit HCl>HClO > H2CO3
C. Tính khử: HF> HCl> HBr> HI D. Tinh oxi hóa : F2>Cl2> Br2>I2
Câu 10. Chất nào có tên gọi không đúng?
A. H2S (hiđrosunfua) B. S (lưu huỳnh) C. H2SO4 (axit sunfuric) D. SO3 (lưu huỳnh oxit)
Câu 11. Lớp ngoài cùng của nguyên tử các nguyên tố halogen có?
A. 7 electron ở lớp ngoài cùng B. 5 electron ở lớp ngoài cùng
C. 6 electron ở lớp ngoài cùng D. 2 electron ở lớp ngoài cùng
Câu 12. Tính nồng độ mol của150ml dung dịch HCl để phản ứng vừa đủ 200 ml dung dịch AgNO3 1,5M?
A. 1M B. 3M C. 2M D. 1,5M
Câu 13. Cho một lượng oxit của kim loại hóa trị II tác dụng vừa đủ với dung dịch H2SO4 20% thì thu được dung dịch muối có nồng độ 22,6% . xác định kim loại trong oxit ?
A. Mg B. Fe C. Zn D. Ca
Câu 14. Cần bao nhiêu lít khí clo (đktc) đủ để tác dụng với kim loại nhôm tạo ra 26,7 gam AlCl3?
A. 4,48 lít B. 3,36 lít C. 5,6 lít D. 6,72 lít
Câu 15. Khí có oxi lẫn hơi nước. Chất nào sau đây là tốt nhất để tách nước ra khỏi oxi?
A. Acid sunfuric đặc B. Nước vôi trong C. Nhôm oxit D. Dung dịch natri hidroxit
Câu 16. Phản ứng nào sau đây không thể xảy ra?
A. H2O + F2 → B. KBr + Cl2 → C. KBr dd + I2 → D. NaI + Br2 →
Câu 17. Từ dung dịch HCl đặc và MnO2 có thể điều chế trực tiếp được khí nào sau đây?
A. HCl và Clo B. Oxy C. Hydro D. Clo
Câu 18. Đặc điểm nào dưới đây là đặc điểm chung của các nguyên tố halogen?
A. Vừa có tính oxi hóa vừa có tính khử mạnh B. Tác dụng mạnh với nước
C. Ở điều kiện thường là chất khí D. Có tính oxi hóa mạnh
Câu 19. trong hợp chất H2SO4 lưu huỳnh có số oxi hóa là
A. +6 B. +4 C. -6 D. +1
Câu 20. Chỉ ra đâu không phải là ứng dụng của clorua vôi ?
A. Dùng trong tinh chế dầu mỏ.
B. Tẩy trắng vải, sợi, giấy , tẩy uế cống rãnh, chuồng trại....
C. Dùng làm chất khử chua cho đất nhiễm phèn.
D. Dùng để xử lí các chất độc, bảo vệ môi trường.
Câu 21. Tìm câu sai: Tại thời điểm cân bằng hóa học thiết lập thì :
A. Tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
B. Số mol các sản phẩm không đổi.
C. Số mol các chất tham gia phản ứng không đổi.
D. Phản ứng không xảy ra nữa.
Câu 22. Thuốc thử đặc trưng để nhận biết iot (I2)
A. Nước brom B. Qùy tím C. Hồ tinh bột D. khí oxi
Câu 23. Để pha loãng dung dịch H2SO4 đặc trong phòng thí nghiệm, người ta tiến hành theo cách nào dưới đây?
A.cho nhanh axit vào nước và khuấy đều. B.cho nhanh nước vào axit và khuấy đều
C. cho từ từ nước vào axit và khuấy đều D. cho từ từ axit vào nước và khuấy đều.
Câu 24. Kim loại nào sau đây cho cùng một sản phẩm muối khi cho tác dụng với H2SO4 loãng và với H2SO4 đặc dư:
A. Ag B. Cu C. Zn D. Fe
Câu 25. Trong công nghiệp axit sunfuric được điều chế theo sơ đồ : A→ SO2 →SO3 → H2SO4 . chất A có thể là
A. S hoặc FeS2 B. S C. FeS2 D. H2O
Câu 26. Hệ cân bằng sau được thực hiện trong bình kín : 2SO2 (k) + O2 (k) ⮀ 2 SO3 (k) <0.
Yếu tố nào sau đây không làm nồng độ các chất trong hệ cân bằng biến đổi?
A. Sự có mặt chất xúc tác
B. Biến đổi dung tích của bình phản ứng
C. Biến đổi áp suất
D. Biến đổi nhiệt độ
Câu 27. Khẳng định nào sai?
A. SO2 và SO3 đều là oxit axit
B. SO2 là khí không màu, mùi hắc, nặng hơn không khí.
C. SO2 và H2S đều có tính khử
D. SO3 làm mất màu dung dịch Brom
Câu 28. Cho các chất : Cl2, O2, S , SO2, SO3 , H2S , HCl , H2SO4 . Có mấy chất vừa có tính oxi hóa vừa có tính khử ? ?
A. 3 B. 5 C. 6 D. 4
Câu 29. Cho 2,81 gam hỗn hợp gồm 3 oxit MgO , ZnO , Fe2O3 hòa tan vừa đủ trong 300 ml dung dịch H2SO4 0,1M thu được dung dịch Y . Cô cạn dung dịch Y thu được m gam hỗn hợp các muối sunfat khan . tìm m?
A. 5,21 gam B. 5,12 gam C. 5,84 gam D. 5,48 gam
Câu 30. Hòa tan 32 gam X ( Fe, Mg, Al, Zn ) bằng dung dịch HCl dư thu được 2,24 lít H2 (đktc). Mặt khác 32 gam X tác dụng với H2SO4 đặc nóng dư thu được 3,36 lít SO2 ( đktc ). Tính %Fe về khối lượng ?
A. 35% B. 17,5% C. 8,75% D. 26,25%
Câu 31. Trong số các phản ứng hóa học sau, phản ứng nào sai?
A. Cl2 + 2NaOH → NaClO + NaCl + H2O B. Cl2 + Ca(OH)2 → CaOCl2 + H2O
C. 2HCl + Cu → CuCl2 + H2 D. 2KClO3 2KCl + 3O2
Câu 32. Khi bắt đầu phản ứng , nồng độ một chất là 0,024 mol/l . Sau 20 giây xảy ra phản ứng , nồng độ của chất đó là 0,022 mol/l. Tốc độ trung bình phản ứng trong trường hợp này là :
A. 0,0003 mol/l.s B. 0,00015 mol/l.s. C. 0,0001 mol/l.s. D. 0,0002 mol/l.s
ĐÁP ÁN ĐỀ SỐ 1
|
1D |
2A |
3D |
4D |
5D |
6A |
7D |
8D |
|
9D |
10D |
11A |
12C |
13A |
14D |
15A |
16C |
|
17D |
18D |
19D |
20C |
21D |
22C |
23D |
24C |
|
25A |
26A |
27D |
28D |
29A |
30B |
31C |
32C |
ĐỀ SỐ 2
A/ TRẮC NGHIỆM: (5,0 điểm)
Câu 1: Axit nào sau đây có trong dịch vị dạ dày, giúp tiêu hóa thức ăn?
A. H2SO4. B. HCl. C. HClO. D. H2S.
Câu 2: Lưu huỳnh đioxit là một trong những tác nhân chính gây ra hiện tượng mưa axit. Công thức hóa học của lưu huỳnh đioxit là
A. SO2. B. H2SO3. C. SO3. D. H2S.
Câu 3: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 đặc, nguội?
A. Mg. B. Fe. C. Cu. D. Na.
Câu 4: Cho phương trình hóa học: 2SO2 (k) + O2 (k) 2SO3 (k) ΔH < 0
Yếu tố nào sau đây không làm ảnh hưởng đến sự chuyển dịch cân bằng phản ứng trên?
A. Nồng độ. B. Áp suất.
C. Nhiệt độ. D. Chất xúc tác.
Câu 5: Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng?
A. Chất xúc tác. B. Thể tích của hệ. C. Diện tích bề mặt tiếp xúc. D. Nồng độ.
Câu 6: Sục khí SO2 từ từ đến dư vào dung dịch axit H2S, thấy
A. có kết tủa vàng. B. có kết tủa đen. C. có kết tủa trắng. D. có kết tủa nâu đỏ.
Câu 7: Thí nghiệm điều chế khí Z được mô tả ở hình bên.
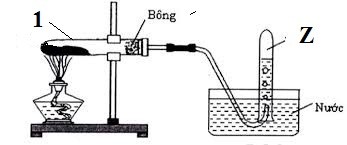
Phản ứng hóa học xảy ra trong ống nghiệm (1) có thể là
A. CaCO3 → CaO + CO2.
B. 2KClO3 → 2KCl + 3O2.
C. Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O.
D. Zn + H2SO4 → ZnSO4 + H2.
Câu 8: Hòa tan hoàn toàn 7,2 gam bột Mg vào dung dịch HCl dư, thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 13,44. B. 3,36. C. 4,48. D. 6,72.
Câu 9: Dãy nào sau đây gồm các chất đều tác dụng được với dung dịch HCl?
A. NaHCO3, KOH, NaCl. B. BaSO4, CuS, Cu.
C. CaCO3, AgNO3, CuO. D. NaOH, KNO3, HF.
Câu 10: Ở điều kiện thường, iot tồn tại ở trạng thái
A. khí. B. lỏng. C. rắn. D. plasma.
---(Nội dung đầy đủ, chi tiết phần còn lại của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
|
1 |
B |
6 |
A |
11 |
A |
|
2 |
A |
7 |
B |
12 |
B |
|
3 |
B |
8 |
D |
13 |
D |
|
4 |
D |
9 |
C |
14 |
C |
|
5 |
B |
10 |
C |
15 |
B |
ĐỀ SỐ 3
Bài 1 (2 điểm): Thực hiện chuỗi phản ứng sau đây: FeS → H2S → Na2S → FeS → Fe2(SO4)3
Bài 2: Nhận biết dung dịch các chất: Na2SO4; NaCl; Na2CO3; H2SO4; NaOH.
Bài 3: Dẫn 3,36 lít khí SO2 (đktc) vào 200ml dung dịch KOH 2M thu được dung dịch X. Cô cạn dung dịch X được chất rắn có khối lượng là bao nhiêu?
Bài 4: Cho 9,6 gam kim loại R tan hoàn toàn trong H2SO4 đặc nóng dư thu được 3,36 lít SO2 (đktc). Xác định kim loại R.
Bài 5: Cho 21,2 gam hỗn hợp Fe và Mg tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 12,32 lít khí H2 (đktc).
a. Tính % theo khối lượng mỗi kim loại trong hỗn hợp đầu.
b. Nếu cho 42,4 gam hỗn hợp kim loại trên tác dụng với H2SO4 đặc nóng dư rồi đem toàn bộ lượng khí SO2 thu được (sản phẩm khử duy nhất) cho hấp thụ vào bình đựng dung dịch Br2 2M. Tính thể tích dung dịch Br2 đã tham gia phản ứng.
Bài 6: Viết các phương trình chứng minh tính oxi hóa của O3 mạnh hơn O2.
Câu 7: Cho 7,7 gam hỗn hợp Mg, Zn tan hoàn toàn với dung dịch H2SO4 đặc nóng dư thu được dung dịch X và 0,1 mol SO2, 0,01 mol S và 0,005 mol H2S. Tính khối lượng mỗi kim loại trong hỗn hợp.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 4
Câu 1: Phát biểu nào sau đây không đúng?
A. Ozon tan trong nước ít hơn oxi
B. Ozon là chất khí màu xanh nhạt, mùi đặc trưng
C, Ozon là một dạng thù hình của oxi
D. Tầng ozon có khả năng hấp thụ tia tử ngoại.
Câu 2: Hiện tượng quan sát được khi sục khí SO2 vào H2S là?
A. không có hiện tượng gì xảy ra
B. Dung dịch bị vẩn đục màu vàng
C. Dung dịch chuyển thành màu nâu đen
D. Có bọt khí bay lên
Câu 3: Để pha loãng H2SO4 đặc, người ta dùng cách nào sau đây?
A. Rót từ từ nước vào axit H2SO4 đặc
B. Đổ nhanh nước vào axit đặc, khuấy đều
C. Rót từ từ axit H2SO4 đặc vào nước, khuấy đều
D. Đổ nhanh H2SO4 đặc vào nuóc
Câu 4: Ở điều kiện thường chất nào là chất rắn, màu vàng?
A. S
B. H2S
C. SO3
D. H2SO4
Câu 5: Khi tác dụng với phi kim có hoạt động mạnh hơn, S thể hiện tính chất hóa học nào?
A. +1, +6
B. -2, +6
C. -2, +4
D. +4, +6
Câu 6: Hidrosunfua là chất khí
A. Không độc
B. Có màu vàng
C. Nhẹ hơn không khí
D. có mùi trứng thối.
Câu 7: Phát biểu nào sau đây không đúng?
A. Oxi tan nhiều trong nước
B. Oxi có vai tro quyết định sự sống của con người và động vật
C. Oxi nặng hơn không khí
D. Oxi là chất khí không màu, không mùi, không vị
Câu 8: Cho 2,8 gam Fe tác dụng hết với S, sau phản ứng thu được bao nhiêu gam muối?
A. 5,5 g
B. 4,4 g
C. 2,2 g
D. 8,8 g
Câu 9: Chất khí nào sau đây có mùi hắc, tan nhiều trong nước?
A. O2
B. H2S
C. CO2
D. SO2
Câu 10: Oxi (Z =8) thuộc nhóm nào trong bảng hệ thống tuần hoàn?
A. V A
B. IV A
C. VI A
D. VII A
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 40 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
|
1.A |
2.B |
3.C |
4.A |
5.D |
6.D |
7.A |
8.B |
|
9.D |
10.C |
11.A |
12.D |
13.C |
14.B |
15.B |
16.C |
|
17.C |
18.C |
19.A |
20.B |
21.C |
22.B |
23.C |
24.D |
|
25.C |
26.D |
27.C |
28.A |
29.B |
30.D |
31.B |
32.D |
|
33.A |
34.D |
35.B |
36.C |
37.A |
38.B |
39.A |
40.D |
ĐỀ SỐ 5
Câu 1: Hoàn thành các phương trình hóa học sau (nếu xảy ra phản ứng)
a. Cl2 + O2
b. Cl2 + H2
c. Cl2 + NaOH(dd)
d. CuO + HCl
e. Fe + H2SO4 (loãng)
f. Ag + H2SO4 (loãng)
h. AgNO3 + NaF
Câu 2: Bằng phương pháp hóa học, không dùng chất chỉ thị hãy phân biệt 3 dung dịch: KCl, H2SO4, K2SO4 đựng trong các lọ mất nhãn.
Câu 3: Viết phương trình hóa học phản ứng điều chế Cl2, O2 trong phòng thí nghiệm
Câu 4: Sục từ từ 2,24 lít SO2 vào 200 ml dung dịch KOH 0,85M thu được m gam muối. Tính m
Câu 5: Hòa tan hoàn toàn hỗn hợp 2,44 gam X gồm FexOy và Cu bằng dung dịch H2SO4 đặc nóng (dư). Sau phản ứng thu được 0,504 lít khí SO2 (sản phẩm khử duy nhất ở đktc) và dung dịch chứa 6,6 gam hỗn hợp muối sunfat. Tính phần trăm khối lượng của Cu trong X
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Trên đây là một phần trích dẫn nội dung Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Trần Đại Nghĩa. Để xem toàn bộ nội dung các em đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng tài liệu này sẽ giúp các em học sinh ôn tập tốt và đạt thành tích cao trong học tập.
Ngoài ra các em có thể tham khảo thêm một số tư liệu cùng chuyên mục tại đây:
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Phan Đình Phùng
- Bộ 5 đề thi HK2 môn Hóa học 10 có đáp án năm 2021 Trường THPT Yên Lạc 2
Chúc các em học tốt!
Tài liệu liên quan
Tư liệu nổi bật tuần
- Xem thêm


