Giải bài 4 tr 79 sách GK Hóa lớp 8
Có phương trình hóa học sau:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
a) Tính khối lượng canxi clorua thu được khi cho 10 g canxi cacbonat tác dụng với axit clohiđric dư.
b) Tính thể tích khí cacbonic thu được trong phòng thí nghiệm, nếu có 5 g canxi cacbonat tác dụng hết với axit. Biết 1 mol khí ở điều kiện phòng có thể tích là 24 lít.
Hướng dẫn giải chi tiết bài 4
Câu a:
Số mol canxi cacbonat tham gia phản ứng
nCaCO3 = 10 : 1000 = 0,1 mol
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Theo phương trình hóa học, ta có:
nCaCl2 = nCaCO3 = 0,1 mol
Khối lượng của canxi clorua tham gia phản ứng:
mCaCl2 = 0,1.(40 + 71) = 11,1 g
Câu b:
Số mol canxi cacbonat tham gia phản ứng:
nCaCO3 = 5 : 100 = 0,05 mol
Theo phương trình hóa học, ta có:
nCO2 = nCaCO3 = 0,05 mol
Thể tích khí CO2 ở điều kiện phòng là:
VCO2 = 24.0,05 = 1,2 lít
-- Mod Hóa Học 8 HỌC247
Bài tập SGK khác
Bài tập 2 trang 79 SGK Hóa học 8
Bài tập 3 trang 79 SGK Hóa học 8
Bài tập 5 trang 79 SGK Hóa học 8
Bài tập 23.1 trang 30 SBT Hóa học 8
Bài tập 23.2 trang 30 SBT Hóa học 8
Bài tập 23.3 trang 31 SBT Hóa học 8
Bài tập 23.4 trang 31 SBT Hóa học 8
Bài tập 23.5 trang 31 SBT Hóa học 8
Bài tập 23.6 trang 31 SBT Hóa học 8
-


Ở nhiệt độ thích hợp H2 khử được?
bởi An Duy
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Hòa tan 1,2 gam muối ăn vào 10,8 gam nước. Dung dịch muối ăn có nồng độ % là?
bởi Suong dem
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Công thức tính nồng độ phần trăm của dung dịch là?
bởi Trong Duy
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Đốt hỗn hợp khí H2 và oxi sẽ nổ mạnh nhất nếu tỉ lệ về thể tích giữa O2và H2 là?
bởi Dương Quá
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -
ADMICRO


Thể tích mol của chất khí ở đktc là?
bởi Quynh Nhu
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


A. Hợp chất của kim loại và oxi.
B. Hợp chất của phi kim và oxi.
C. Hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi.
D. Hợp chất của hai nguyên tố, trong đó có một nguyên tố là hidro.
Theo dõi (0) 1 Trả lời -


Có 3 lọ bị mất nhãn đựng 3 hóa chất khác nhau: Fe2O3, K2O, P2O5 . Dùng thuốc thử nào sau đây để nhận biết các hóa chất trên?
bởi Sasu ka
 07/01/2022
07/01/2022
A. Dùng nước và quỳ tím.
B. Chỉ dùng axit.
C. Chỉ dùng kiềm.
D. Chỉ dùng muối.
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Cần thêm bao nhiêu gam NaOH để pha chế dung dịch NaOH 10% từ 200g dung dịch NaOH 5%
bởi Mai Trang
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Cho 1,2 gam kim loại magie tác dụng vừa đủ với 50g dung dịch axit clohidric (HCl) thu được magie clorua (MgCl2) và khí hiđro.a) Viết phương trình phản ứng.
bởi Nguyễn Thị Trang
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Trình bày phương pháp hóa học để nhận biết ba chất lỏng không màu sau: HCl, H2O, Ba(OH)2?
bởi Phan Thị Trinh
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí, phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hiđro, có làm thế được không? Vì sao?
bởi Anh Tuyet
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Nêu hiện tượng và viết phương trình phản ứng xảy ra khi cho mẩu kim loại Natri vào cốc chứa nước.
bởi Van Dung
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Công thức của muối sắt (III) sunfat là gì?
bởi thanh hằng
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Công thức hóa học của cacbon đioxit là gì?
bởi Meo Thi
 07/01/2022
07/01/2022
A. HNO3
B. CuO
C. CuCl2
D. CO2
Theo dõi (0) 1 Trả lời -


Phải thêm bao nhiêu gam nước vào 500g dung dịch NaCl 12% để thu được dung dịch NaCl 8%.
bởi Phí Phương
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Chất thuộc loại hợp chất muối?
bởi ngọc trang
 07/01/2022
07/01/2022
A. Na2O
B. NaOH
C. NaCl
D. HCl
Theo dõi (0) 1 Trả lời -


Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại Kẽm tác dụng với?
bởi can chu
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Nhóm chất nào sau đây đều là bazơ?
bởi Nguyễn Lê Thảo Trang
 07/01/2022
07/01/2022
A. Al(OH)3, K2SO4, Zn(OH)2, Fe(OH)2
B. Na2O, Fe2O3, PbO, SiO2
C. KOH, Fe(OH)3, Ba(OH)2
D. NaOH, Al2O3, Ca(OH)2, Ba(OH)2
Theo dõi (0) 1 Trả lời -


Thành phần của không khí gồm những gì?
bởi Duy Quang
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Chất thuộc loại hợp chất oxit bazơ?
bởi Nguyễn Hiền
 07/01/2022
07/01/2022
A. Ba(OH)2
B. Ba(HCO3)2
C. BaO
D. BaCO3
Theo dõi (0) 1 Trả lời -


Cần bao nhiêu lít khí H2 ở đktc để khử hoàn toàn 8,0g bột đồng oxit trong PTN?
bởi Nguyễn Thủy Tiên
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Hoàn thành sơ đồ phản ứng Al + HCl → AlCl3 + H2?
bởi Thúy Vân
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Hãy viết công thức tính khối lượng chất và thể tích chất khí ở đktc khi biết số mol.
bởi hoàng duy
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Phát biểu định nghĩa axit, bazơ. Mỗi chất cho 1 ví dụ.
bởi Bao Chau
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Hoàn thành sơ đồ phản ứng sau: H2O → H2 + O2
bởi Hoàng giang
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Phát biểu các định nghĩa: phản ứng hóa hợp, phản ứng thế, phản ứng phân hủy.
bởi Tuấn Huy
 07/01/2022
Theo dõi (0) 1 Trả lời
07/01/2022
Theo dõi (0) 1 Trả lời -


Tính khối lượng mỗi nguyên tố trong hợp chất Al2(SO4)3 biết khối lượng lưu huỳnh là 4,8 gam?
bởi Trungg Hiếw
 08/12/2021
08/12/2021
tính khối lượng mỗi nguyên tố trong hợp chất Al2(SO4)3 biết khối lượng lưu huỳnh là 4,8 gam
Theo dõi (0) 0 Trả lời -


Một bình phản ứng chứa 33,6 l khí oxi(đktc), với thể tích này có thể đốt cháy:
bởi Nguyễn Hiền
 27/07/2021
27/07/2021
a/ bao nhiêu g C
b/ bao nhiêu g H
c/ bao nhiêu g S
d/ bao nhiêu g P
Theo dõi (0) 1 Trả lời -


Lập phương trình hóa học a) \(Fe+ ? --> Fe_3O_4\)
bởi Đào Thị Nhàn
 27/07/2021
27/07/2021
b) KNO3 -->KNO2 + ?
c) Al + ? --> AlCl3
d) Na2O + ? --> NaOH
e) KClO3 --> ? + O2
Theo dõi (0) 1 Trả lời -


\(Fe_3O_4\) đọc là gì?
bởi Phạm Phú Lộc Nữ
 28/07/2021
Theo dõi (0) 1 Trả lời
28/07/2021
Theo dõi (0) 1 Trả lời -


Hòa tan hoàn toàn 32.5g khối lượng Zn vào dd HCl 10%
bởi Nguyễn Vân
 28/07/2021
28/07/2021
a.tính số g dd HCl 10% cần dùng
b.tính số g muối tạo thành và số g H2 thoát thân ra
c.tính nồng độ %dd muối sau pư .
Theo dõi (0) 0 Trả lời -


Tính khối lượng khí oxi cần dùng để đốt cháy hoàn toàn 9.62 g hỗn hợp khí metan (\(CH_4\))và khí butan (\(C_4H_1\)\(_0\)).biết rằng sau phản ứng dụng người ta thu được nước và 28.6 g khí \(CO_2\)
bởi ngọc trang
 28/07/2021
Theo dõi (0) 0 Trả lời
28/07/2021
Theo dõi (0) 0 Trả lời -


So sánh thể tích khí hiđro thu được khi cho cùng khối lượng Zn và Fe tác dụng lần lượt với dd HCl dư .
bởi Phung Hung
 28/07/2021
Theo dõi (0) 1 Trả lời
28/07/2021
Theo dõi (0) 1 Trả lời -


a. viết pthh
b. tính khối lượng của mỗi chất trong hỗn hợp ban đầu
c.tính thành phần% khối lượng mỗi chất trong hỗn hợp ban đầu.
Theo dõi (0) 1 Trả lời -


Cho một lượng \(Na_2O\) tác dụng với 500ml dung dịch \(H_2SO_4\) 0,5M (Biết khối lượng riêng dung dịch D=1,12 g/ml ), thu được 28,4 g Na2SO4 và nước
bởi Quynh Nhu
 28/07/2021
28/07/2021
a, viết phương trình phản ứng
b,tính khối lượng của Na2O tham gia phản ứng
c, tính nồng độ mol của dung dịch thu được
d,tính C% của các chất trong dung dịch thu được sau phản ứng kết thúc
Theo dõi (0) 1 Trả lời -


Đốt a gam sắt trong bình chứa 44,8l oxi ở đktc. Sau khi phản ứng kết thúc, thu đc 2,32g oxit sắt từ
bởi thùy trang
 28/07/2021
28/07/2021
a, Tính a
b, Oxi còn dư sau phản ứng không, nếu dư thì dư bao nhiêu
Theo dõi (0) 1 Trả lời -


Oxi hóa hoàn toàn 39,3 gam hỗn hợp magie, nhôm, sắt trong oxi dư thu đc 58,5 gam hỗn hợp 3 oxit. viết PTHH xảy ra và tính thể tích của khí oxi tham gia phản ứng ở đktc
bởi Nguyễn Tiểu Ly
 28/07/2021
Theo dõi (0) 1 Trả lời
28/07/2021
Theo dõi (0) 1 Trả lời -


Oxi hóa hoàn toàn 23,2 gam hỗn hợp đồng và sắt. sau phản ứng tháy khối lượng hỗn hợp tăng lên 8 gam. Tính thể tích không khí cần dùng
bởi Khanh Đơn
 27/07/2021
Theo dõi (0) 1 Trả lời
27/07/2021
Theo dõi (0) 1 Trả lời -


Tìm phân tử khối của 2 khí A, B biết
bởi Quế Anh
 27/07/2021
27/07/2021
a)Tỉ khối hơi của 1 hỗn hợp đồng thể tích cua A , B đối với khí Heli là 7,5 lần.
b)Tỉ khối hơi của 1 hỗn hợp đồng khối lượng của A , B đối với khí Oxi là 11/15(có nghĩa là 11 phần 15)
Theo dõi (0) 1 Trả lời -


Viết phương trình bảo toàn khối lượng. Đốt cháy hoàn toàn 9 gam kim loại \(Mg\) trong không khí thu được 15 gam magie oxit (\(MgO\)). Cho rằng chỉ xảy ra phản ứng giữa Mg với oxi (\(O_2\)) trong không khí.
bởi Hoang Viet
 28/07/2021
28/07/2021
a) Viết PTHH của phản ứng hóa học xảy ra.
b) Viết phương trình bảo toàn khối lượng.
c) Tính khối lượng của õi đã phản ứng
Theo dõi (0) 1 Trả lời -


Cân bằng phương trình hóa học? Phương trình hóa học nào dưới đây cân bằng đúng:
bởi Lê Nhật Minh
 27/07/2021
27/07/2021
A. Fe3O4 + 2H2 -> 3Fe + 2H2O
B. H2O -> H2 + O2
C. H2O -> H2O + O2
D. Mg(OH)2 -> MgO + H2O
Theo dõi (0) 1 Trả lời -


Xác định giá trị của m? Đặt cốc A đựng dung dịch \(HCl\) và cốc \(B\) đựng dung dịch \(H_2SO_4\) loãng vào 2 đĩa cân sao cho cân ở vị trí cân bằng. Sau đó làm thí nghiệm như sau:
bởi Mai Linh
 28/07/2021
28/07/2021
- Cho 11,2g Fe vào cốc đựng dung dịch HCl.
- Cho m gam Al vào cốc đựng dung dịch H2SO4.
Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m?
Theo dõi (0) 1 Trả lời -


Cho 20,4g oxit kim loại hóa trị III tác dụng với dung dịch HCl dư thu được 105,6g muối. Xác định kim loại hóa trị III đó?
bởi Đỗ Minh Phương
 21/05/2021
21/05/2021
Cho 20,4g oxit kim loại hóa trị III tác dụng với dung dịch HCl dư thu được 105,6g muối. Xác định kim loại hóa trị III đó
Theo dõi (0) 1 Trả lời -


Nhiệt phân 31,6 gam KMnO4, thu được V lít O2 (đktc), biết hiệu suất phản ứng 80% . Giá trị của V?
bởi Lê Minh Bảo Bảo
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 6,4g Cu tác dụng với oxi không khí thu được 6,4g CuO. Hiệu suất phản ứng?
bởi Quynh Anh
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho 13,6 gam hỗn hợp X gồm axit axetic và rượu etylic được trộn theo tỉ lệ mol tương ứng là 3 : 2.
bởi thu phương
 15/01/2021
15/01/2021
Đun nóng X với H2SO4 đặc một thời gian thu được m gam este CH3COOCH2CH3 với hiệu suất phản ứng là 80%. Giá trị của m ?
Theo dõi (0) 1 Trả lời -


Tính thể tích C2H4 (đktc) cần để điều chế được 6,9 gam rượu etylic. Biết hiệu suất phản ứng là 75%.
bởi Truc Ly
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Điều chế khí oxi bằng cách nhiệt phân 1 mol KClO3 thì thu được 43,2 g khí oxi và một lượng kali clorua (KCl). Tính hiệu suất phản ứng?
bởi Trung Phung
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Điều chế khí oxi bằng cách nhiệt phân 1 mol KClO3 thì thu được 43,2 g khí oxi và một lượng kali clorua (KCl). Tính hiệu suất phản ứng?
bởi Trung Phung
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 22,4 lít khí etilen \({{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\) (đktc) tác dụng với nước (dư) có axit sunfuric làm xúc tác, thu được 13,8 gam rược etylic \({{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}{\text{OH}}\). Tính hiệu suất phản ứng cộng nước của etilen.
bởi thanh hằng
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Một cơ sở sản xuất vôi tiến hành nung 4 tấn đá vôi (CaCO3) thì thu được 1,68 tấn vôi sống(CaO) và một lượng khí CO2. Tính hiệu suất của quá trình nung vôi.
bởi Lê Nguyễn Hạ Anh
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Trộn 10,8 g bột nhôm với bột lưu huỳnh dư. Cho hỗn hợp vào ống nghiệm và đun nóng để phản ứng xảy ra thu được 25,5 g Al2S3. Tính hiệu suất phản ứng ?
bởi Minh Thắng
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho luồng khí H2 đi qua ống thủy tinh chứa 20 gam bột CuO ở nhiệt độ cao. Sau phản ứng thu được 16,8 gam chất rắn. Hiệu suất của phản ứng?
bởi Nguyễn Trà Long
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Nung nóng kali nitrat KNO3, chất này bị phân hủy tạo thành kali nitrit KNO2 và O2. Tính khối lượng KNO3 cần dùng để điều chế được 2,4 gam O2. Biết hiệu suất phản ứng đạt 85%.
bởi Thùy Trang
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Người ta nung 4,9 gam KClO3 có xúc tác thu được 2,5 gam KCl và một lượng khí oxi.
bởi Ngoc Han
 15/01/2021
15/01/2021
a. Viết phương trình hóa học xảy ra.
b. Tính hiệu suất của phản ứng
Theo dõi (0) 2 Trả lời -


Đốt cháy 0,2 mol P trong bình chứa 6,72 lít khí O2 ở (đktc).Tính khối lượng P2O5 thu được?
bởi thanh hằng
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Nếu cho 0,2 mol sắt vào 0,25 mol CuSO4 thì khối lượng Cu thu được sau phản ứng là?
bởi Ngoc Nga
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho 0,15 mol \(A{l_2}{O_3}\)tác dụng với dung dịch chứa 0,4 mol \({{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\), sản phẩm của phản ứng là \({\text{A}}{{\text{l}}_{\text{2}}}{{\text{(S}}{{\text{O}}_{\text{4}}}{\text{)}}_{\text{3}}}\) và \({{\text{H}}_{\text{2}}}{\text{O}}\). Tính khối lượng \({\text{A}}{{\text{l}}_{\text{2}}}{{\text{(S}}{{\text{O}}_{\text{4}}}{\text{)}}_{\text{3}}}\) thu được.
bởi Nguyễn Thanh Hà
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Trộn dung dịch chứa 0,1 mol NaOH với dung dịch chứa 0,04 mol CuCl2 thu được NaCl và m gam kết tủa Cu(OH)2. Giá trị của m?
bởi Ha Ku
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 2,4 gam Mg vào dung dịch chứa 0,3 mol HCl. Tính thể tích khí thu được ở điều kiện tiêu chuẩn
bởi Lê Tường Vy
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 22,4 gam sắt tác dụng với 24,5 gam \({{\text{H}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}\). Tính thể tích khí hidro thu được ở đktc?
bởi Phan Quân
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho 8,1 gam ZnO tác dụng với 0,25 mol axit clohiđric HCl thu đươc \({\text{ZnC}}{{\text{l}}_{\text{2}}}\) và H2O. Tính khối lượng muối \({\text{ZnC}}{{\text{l}}_{\text{2}}}\) tạo thành sau phản ứng.
bởi Bo Bo
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Nếu cho 4 gam CuO tác dụng với 2,92 gam HCl thì sau phản ứng kết luận nào sau đây đúng?
bởi Duy Quang
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Nếu cho 11,2 gam sắt vào dung dịch chứa 40 gam CuSO4 thì sau phản ứng thu được khối lượng Cu là bao nhiêu?
bởi Lê Tấn Thanh
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Khi cho miếng nhôm tan hết vào dung dịch có chứa 0,5 mol HCl thì thu được muối AlCl3 và 3,36 lít khí hiđro (đktc).
bởi Nguyễn Hiền
 15/01/2021
15/01/2021
a. Tính khối lượng miếng nhôm đã phản ứng
b. Axit clohiđric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Theo dõi (0) 1 Trả lời -


Cho 6,5 gam kẽm tác dụng với 36,5 gam dung dịch HCl thu được \({\text{ZnC}}{{\text{l}}_{\text{2}}}\) và khí hidro . Tính khối lượng muối tạo thành sau phản ứng.
bởi Nguyễn Anh Hưng
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Tính khối lượng đã phản ứng của HCl khi cho 2,875 g Na tác dụng với nó để sinh ra khí hidro?
bởi Tuấn Tú
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Muốn thu khí NO vào bình ta phải làm như thế nào?
bởi Hong Van
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Cho 1,6 g S cháy trong không khí thấy có khí có khả năng làm mất màu cánh hoa hồng. Tính thể tích khí đó
bởi Lê Nguyễn Hạ Anh
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Kết luận đúng khi nói về khí clo và khí metan?
bởi Mai Bảo Khánh
 14/01/2021
14/01/2021
A. MCl2= MCH4
B. Khí clo nặng hơn 4,4375 lần khí metan
C. Khí metan nặng hơn khí clo 2,5 lần
D. Khí metan nặng hơn khí clo 4,4375 lần
Theo dõi (0) 1 Trả lời -


Tính %mMg trong 1 mol MgSO4?
bởi Suong dem
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Số mol phân tử Cl2 có trong 7,1 g Cl2?
bởi Nguyễn Thị Thanh
 15/01/2021
Theo dõi (0) 1 Trả lời
15/01/2021
Theo dõi (0) 1 Trả lời -


Tính số phân tử nước có trong 0,5 mol nước?
bởi khanh nguyen
 14/01/2021
Theo dõi (0) 1 Trả lời
14/01/2021
Theo dõi (0) 1 Trả lời -


Cho 0,25 mol hỗn hợp KHCO3 và CaCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch nước vôi trong dư, thu được a gam kết tủa. Hãy tính giá trị của a?
bởi Lê Ngân
 05/09/2020
Cho 0,25 mol hỗn hợp KHCO3 và CaCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch nước vôi trong dư, thu được a gam kết tủa. Hãy tính giá trị của a.Theo dõi (0) 0 Trả lời
05/09/2020
Cho 0,25 mol hỗn hợp KHCO3 và CaCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch nước vôi trong dư, thu được a gam kết tủa. Hãy tính giá trị của a.Theo dõi (0) 0 Trả lời -


Tính khối lượng HCl cần dùng?
bởi trần thanh Bình
 14/06/2020
14/06/2020
Cho 16,8gam sắt tác dụng với dung dịch axit clohidric
a) Tính khối lượng HCL cần dùng
b)tính khôi lượng muối tạo thành
c) tính thể tích khí hidro sinh ra (ĐKTC)
d)lượng khí hidro trên khử hết 14g sắt (III) oxit không
Theo dõi (0) 3 Trả lời -


Nhúng một thanh sắt và một thanh kẽm vào cùng một cốc chứa 500 ml dung dịch CuSO4. Sau một thời gian lấy hai thanh kim loại ra khỏi cốc thì mỗi thanh có thêm Cu bám vào, khối lượng dung dịch trong cốc bị giảm mất 0,22g. Trong dung dịch sau phản ứng, nồng độ mol của ZnSO4 gấp 2,5 lần nồng độ mol của FeSO4. Thêm dung dịch NaOH dư vào cốc, lọc lấy kết tủa rồi nung ngoài không khí đến khối lượng không đổi , thu được 14,5g chất rắn. Số gam Cu bám trên mỗi thanh kim loại và nồng độ mol của dung dịch CuSO4 ban đầu là bao nhiêu?
bởi Xuan Xuan
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Cho 7,8 gam hỗn hợp kim loại Al và Mg tác dụng với HCl thu được 8,96 lít H2 (ở đktc). Hỏi khi cô cạn dung dịch thu được bao nhiêu gam muối khan.
bởi Lê Chí Thiện
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Hoà tan hỗn hợp 2 muối Cacbonnat kim loại hoá trị 2 và 3 bằng dung dịch HCl dư thu được dung dịch A và 0,672 lít khí (đktc). Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khác nhau?
bởi Nguyễn Trọng Nhân
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Có 2 lá sắt khối lượng bằng nhau và bằng 11,2g. Một lá cho tác dụng hết với khí clo, một lá ngâm trong dung dịch HCl dư. Tính khối lượng sắt clorua thu được.
bởi Bo Bo
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Hoà tan hoàn toàn 3,22g hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lit hiđro (ở đktc) và dung dịch chứa m gam muối. Tính m?
bởi Đào Thị Nhàn
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Hoà tan hoàn toàn 3,22g hỗn hợp X gồm Fe, Mg và Zn bằng một lượng vừa đủ dung dịch H2SO4 loãng, thu được 1,344 lit hiđro (ở đktc) và dung dịch chứa m gam muối. Tính m?
bởi Đào Thị Nhàn
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Cho một luồng khí clo dư tác dụng với 9,2g kim loại sinh ra 23,4g muối kim loại hoá trị I. Hãy xác định kim loại hoá trị I và muối kim loại đó.
bởi Kim Ngan
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Hoà tan trong nước 0,325g một hỗn hợp gồm 2 muối Natriclorua và Kaliclorua. Thêm vào dung dịch này một dung dịch bạc Nitrat lấy dư - Kết tủa bạc clorua thu được có khối lượng là 0,717g. Tính thành phần phần trăm của mỗi chất trong hỗn hợp.
bởi Hoang Viet
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Đốt cháy một hỗn hợp 300ml hiđrocacbon và amoniac trong oxi có dư. Sau khi cháy hoàn toàn, thể tích khí thu được là 1250ml. Sau khi làm ngưng tụ hơi nước, thể tích giảm còn 550ml. Sau khi cho tác dụng với dung dịch kiềm còn 250ml trong đó có 100ml nitơ. Thể tích của tất cả các khí đo trong điều kiện như nhau. Lập công thức của hiđrocacbon
bởi Hong Van
 30/05/2020
Theo dõi (0) 1 Trả lời
30/05/2020
Theo dõi (0) 1 Trả lời -


Tính khối lượng đã phản ứng của HCl khi cho 2,875 g Na tác dụng với nó để sinh ra khí hidro
bởi Nguyễn Phương Khanh
 28/05/2020
28/05/2020
A. 9,2 g
B. 4,5625 g
C. 12,95 g
D. 1,123 g
Theo dõi (0) 2 Trả lời -


Muốn thu khí NO vào bình ta phải
bởi Nguyễn Sơn Ca
 28/05/2020
28/05/2020
A. Đặt đứng bình
B. Đặt úp bình
C. Cách nào cũng được
D. Lúc đầu để đứng bình rồi chuyển sang để ngang bình
Theo dõi (0) 2 Trả lời -


Cho 2,7 g nhôm tác dụng với 6,4 g O2 . Hỏi sau phản ứng thu được những chất nào, biết rằng hóa trị cao nhất của nhôm trong hợp chất là III
bởi nguyen bao anh
 28/05/2020
28/05/2020
A. Al2O3
B. Al
C. O2
D. Al2O3 và O2 dư
Theo dõi (0) 2 Trả lời -


Cho 1,6 g S cháy trong không khí thấy có khí có khả năng làm mất màu cánh hoa hồng. Tính thể tích khí đó
bởi Lê Nhi
 29/05/2020
29/05/2020
A. 1,12 ml
B. 0,102 lít
C. 11,2 ml
D. 1,12 lít
Theo dõi (0) 2 Trả lời -


Kết luận đúng khi nói về khí clo và khí metan
bởi Bánh Mì
 29/05/2020
29/05/2020
A. MCl2= MCH4
B. Khí clo nặng hơn 4,4375 lần khí metan
C. Khí metan nặng hơn khí clo 2,5 lần
D. Khí metan nặng hơn khí clo 4,4375 lần
Theo dõi (0) 1 Trả lời -


Số mol tương ứng của 4,8 g C; 8 g O; 0,56 g Fe
bởi Cam Ngan
 28/05/2020
28/05/2020
A. 0,04 mol, 0,5 mol, 0,1 mol
B. 0,4 mol, 0,5 mol, 0,01 mol
C. 4 mol, 5 mol, 1 mol
D. 0,4 mol, 0,1 mol, 0,3 mol
Theo dõi (0) 1 Trả lời -


Tính %mMg trong 1 mol MgSO4
bởi Bánh Mì
 28/05/2020
28/05/2020
A. 80%
B. 30%
C. 50%
D. 20%
Theo dõi (0) 1 Trả lời -


Số mol phân tử Cl2 có trong 7,1 g Cl2
bởi Hoang Viet
 29/05/2020
29/05/2020
A. 1 mol
B. 0,01 mol
C. 0,1 mol
D. 0,05 mol
Theo dõi (0) 1 Trả lời -


0,5 mol mol nước chứa số nguyên tử
bởi Thanh Truc
 29/05/2020
29/05/2020
A. 3,01.1023
B. 6,02.1023
C. 3.1023
D. 4.1023
Theo dõi (0) 1 Trả lời -


Cho các cặp chất: (a) Na2CO3 và BaCl2; (b) NaCl và Ba(NO3)2; (c) NaOH và H2SO4. Số cặp chất xảy ra phản ứng trong dung dịch thu được kết tủa là:
bởi Hương Lan
 23/05/2020
23/05/2020
A. 0
B. 3
C. 2
D. 1
Theo dõi (0) 2 Trả lời -


A. Xuất hiện kết tủa trắng
B. Ban đầu tạo kết tủa trắng, sau đó tan dần
C. Sau 1 thời gian mới xuất hiện kết tủa trắng
D. Không xuất hiện kết tủa
Theo dõi (0) 2 Trả lời -


Cho dung dịch chứa a mol Ca(HCO3)2 tác dụng với dung dịch chứa a mol chất tan X. Để thu được lượng kết tủa lớn nhất thì X là
bởi Thành Tính
 23/05/2020
23/05/2020
A. Ba(OH)2
B. Ca(OH)2
C. NaOH
D. Na2CO3
Theo dõi (0) 2 Trả lời -


Cho dd Ba(HCO3)2 lần lượt vào các dd: Ca(NO3)2, Na2CO3 , KHSO4, Ca(OH)2, HCl. Số trường hợp có tạo ra kết tủa là:
bởi hà trang
 22/05/2020
22/05/2020
A. 3
B. 2
C. 5
D. 4
Theo dõi (0) 2 Trả lời -


A. IA
B. IIIA
C. IVA
D. IIA
Theo dõi (0) 2 Trả lời -


Cho 6,5 gam kim loại X hoá trị II tác dụng hoàn toàn với khí oxi (đktc), sau phản ứng thu được 8,1 gam muối XO. Hỏi:
bởi Hồng Hạnh
 20/05/2020
20/05/2020
a) Viết PTHH.
b) Tính thể tích khí oxi (đktc) đã phản ứng với kim loại X.
c) Tìm kim loại X.
Theo dõi (0) 1 Trả lời -


Tính m(g) H2O khi cho 2,4(1)g H2 tác dụng với 7,6(1)g O2 (đktc)
Theo dõi (0) 1 Trả lời -


Tính thể tích O2 (đktc) cần dùng?
bởi Phạm Thị Thanh Trúc
 01/05/2020
Cần đốt hoàn toàn bao nhiêu g P trong bình đựng oxi a. Để tạo thành 71g P2O5b. 5,5 mol P2O5. Tính thể tích O2 (đktc) cần dùngTheo dõi (1) 0 Trả lời
01/05/2020
Cần đốt hoàn toàn bao nhiêu g P trong bình đựng oxi a. Để tạo thành 71g P2O5b. 5,5 mol P2O5. Tính thể tích O2 (đktc) cần dùngTheo dõi (1) 0 Trả lời -


Tính phân tử khối C12H22O11, Cu2S, Al2O3 ?
bởi Nguyễn Hoà
 14/04/2020
Tính phân tử khốiTheo dõi (0) 1 Trả lời
14/04/2020
Tính phân tử khốiTheo dõi (0) 1 Trả lời -


Đốt cháy 12 gram Cacbon trong khí O2 thể tích khí CO2 thu được ở đktc là?
bởi Phan Dương Khánh
 10/04/2020
10/04/2020
Đốt cháy 12 gram Cacbon trong khí O2 thể tích khí CO2 thu được ở đktc là
Theo dõi (0) 0 Trả lời -


Viết phương trình hóa học?
bởi Dark Devil
 08/04/2020
08/04/2020
đốt cháy hoàn toàn fe trong khí oxi thu được 69,6 gam oxit sắt từ(Fe3O4)
a.viết phương trình hóa học
b.tính khối lượng Fe tham gia phản ứng
c.tính thể tích khí oxi ở đktc cần dùng
d.để cps lượng oxit trên thì cần nung bao nhiêu gamTheo dõi (0) 0 Trả lời -


Câu 3: Cho FeO , Cu(OH)2 , Ag2O , KClO3 , P2O3 , PbO. Xác định oxit axit , oxit bazơ và đọc tên Câu 4: Nhận biết 2 lọ đựng khí mất nhãn sau: khí oxi và khí cacbonnic
Theo dõi (0) 0 Trả lời -


Chọn hệ số thích hợp để cân bằng các phản ứng sau?
bởi Đình Dương
 03/04/2020
Chọn hệ số thích hợp để cân bằng các phản ứng sau:1.AL O2-al2o3Theo dõi (0) 2 Trả lời
03/04/2020
Chọn hệ số thích hợp để cân bằng các phản ứng sau:1.AL O2-al2o3Theo dõi (0) 2 Trả lời -


Tính khối lượng Fe tham gia phản ứng?
bởi oanh Trần
 26/03/2020
26/03/2020
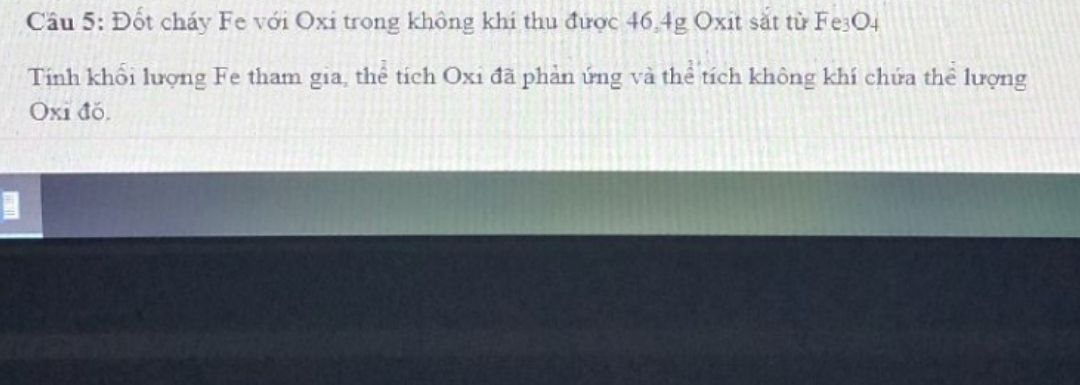 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Si và O lập công thức hóa học?
bởi Em's Nở's
 24/03/2020
24/03/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Tính tỉ lệ a/b?
bởi Hoang Kieu
 16/03/2020
16/03/2020
 Theo dõi (0) 0 Trả lời
Theo dõi (0) 0 Trả lời -


Cho 13.44 lít hỗn hợp x gồm hiđro và c2h2 có tỉ khối so vs nito bằng 0.5. Mặt khác đốt cháy hoàn toàn 5.6 gam hỗn hợp x có thành phần giống như trên trong bình kín chứa 28.8 gam oxi.phản ứng xong làm lạnh để ngưng tụ hết hơi nước thu được khí y. Tính thành phần phần trăm khối lượng và thể tích các khí trong y.
Theo dõi (0) 0 Trả lời -


Tính số mol nguyên tử của mỗi nguyên tố?
bởi Pham Nguyet
 26/02/2020
Làm giúp em với ạ
26/02/2020
Làm giúp em với ạ Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính khối lượng axit tạo thành?
bởi Goc hoc tap
 24/02/2020
24/02/2020
Đốt cháy hết 3,1 g phốt pho trong bình chứa khí oxi sau phản ứng thu được điphotphopentaoxit.
a) Tính khối lượng điphotphopentaoxit. Tính thể tích khí oxi( đktc)
b) Hòa tan hoàn toàn lượng sản phẩm trên trong nước dư. Tính khối lượng axit tạo thành
c) Nếu cho quỳ tím vào dung dịch thu được quỳ tím sẽ đổi màu như thế nào?Vì sao?
Giúp mình câu b, c với ạ ..
Theo dõi (0) 1 Trả lời -


Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m?
bởi Hồ Khắc Bảo Tuệ
 17/02/2020
17/02/2020
Đặt cốc A đựng HCl và cốc B đựng H2SO4 loãng vào 2 đĩa cân sao cho cân ở vị trí thăng bằng.Sau đó làm thí nghiệm như sau:
Cho 11,2 g Fe vào cốc đựng dung dịch HCl
Cho m gam Al vào cốc dựng dung dịch H2SO4
Khi cả Fe và Al đều tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m?
Theo dõi (0) 2 Trả lời -


Tìm công thức hóa học của A?
bởi Trần Thảo Vy
 24/12/2019
24/12/2019
Hợp chất A chứa nguyên tố: Fe và O . Trong phân tử A có 7 nguyên tử và MA = 232 (g/mol). Tìm công thức hoá học của A?
Theo dõi (0) 2 Trả lời -


Để đốt cháy hoàn toàn 6,4g photpho bằng oxi thu được p2o5. Tính thể tích khí oxi đã tham gia phản ứng ở đktc
Theo dõi (0) 1 Trả lời -


Tính phần trăm của R trong hợp chất?
bởi Nguyễn Thị Thu Hường
 20/12/2019
Please help meTheo dõi (1) 1 Trả lời
20/12/2019
Please help meTheo dõi (1) 1 Trả lời -


Câu 1: Cho 13g Zn tác dụng vừa đủ với dung dịch có chứa 14,6g axit clohiđric (HCl) thu được 27,2g kẽm clorua (ZnCl2) và khí hiđro.
a) lập PTHH của phản ứng trên.
b) Tính khối lượng và thể tích khí hiđro thoát ra (đktc). Tính số phân tử khí hiđro thu được. Muốn có số phân tử SO2 gấp đôi số phân tử H2 thì khối lượng SO2 là bao nhiêu?
Theo dõi (1) 1 Trả lời -


Tìm thể tích của 6.10^23 phân tử khí CO2 ở đktc?
bởi Gia Huệ
 16/12/2019
Tìm thể tích của 6.10^23 phân tử khí CO2 ở đktcGiúp mình với ạTheo dõi (1) 2 Trả lời
16/12/2019
Tìm thể tích của 6.10^23 phân tử khí CO2 ở đktcGiúp mình với ạTheo dõi (1) 2 Trả lời -


Tìm số mol của 672ml khí O2 ở đktc
bởi Gia Huệ
 16/12/2019
Tìm 672ml khí O2 ở đktcTheo dõi (0) 1 Trả lời
16/12/2019
Tìm 672ml khí O2 ở đktcTheo dõi (0) 1 Trả lời





