Hướng dẫn giải bài tập SGK Hóa học 10 Bài 39 Luyện tập Tốc độ phản ứng và cân bằng hóa học giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức môn Hoá.
-
Bài tập 1 trang 166 SGK Hóa học 10
Nội dung nào thể hiện trong các câu sau đây là sai:
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
B. Nước giải khát được nén CO2 vào ở áp suất cao hơn sẽ có độ chua (độ axit) lớn hơn.
C. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
D. Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong không khí.
-
Bài tập 2 trang 166 SGK Hóa học 10
Cho biết cân bằng sau được thực hiện trong bình kín:
PCl5 (k) \(\rightleftharpoons\) PCl3 (k) + Cl2 (k), ∆H > 0
Yếu tố nào sau đây tạo nên sự tăng lượng PCl3 trong cân bằng?
A. Lấy bớt PCl5 ra.
B. Thêm Cl2 vào.
C. Giảm nhiệt độ.
D. Tăng nhiệt độ.
-
Bài tập 3 trang 167 SGK Hóa học 10
Có thể dùng những biện pháp gì để tăng tốc độ của các phản ứng xảy ra chậm ở điều kiện thường?
-
Bài tập 4 trang 167 SGK Hóa học 10
Trong các cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn?
a)Fe + CuSO4 (2M) và Fe + CuSO4 (4M)
b)Zn + CuSO4 (2M, 25oC) và Zn + CuSO4 (2M, 50oC)
c)Zn (hạt) + CuSO4 (2M) và Zn (bột) + CuSO4 (2M)
d)2H2 + O2 → 2H2O (to thường) và 2H2 + O2 → 2H2O (tothường),xúc tác Pt
(Nếu không ghi chú gì thêm là so sánh trong cùng điều kiện)
- VIDEOYOMEDIA
-
Bài tập 5 trang 167 SGK Hóa học 10
Cho biết phản ứng thuận nghịch sau:
2NaHCO3(r ) \(\rightleftharpoons\) Na2CO3 (r) + CO2 (k) + H2O (k), ∆H > 0
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3
-
Bài tập 6 trang 167 SGK Hóa học 10
Hệ cân bằng sau xảy ra trong một bình kín:
CaCO3 (r) \(\rightleftharpoons\) CaO(r) + CO2 (k), ∆H > 0
Điều gì xảy ra nếu thực hiện một trong những biến đổi sau?
a) Tăng dung tích của bình phản ứng.
b) Thêm CaCO3 vào bình phản ứng.
c) Lấy bớt CaO khỏi bình phản ứng.
d) Thêm ít giọt NaOH vào bình phản ứng.
e) Tăng nhiệt độ.
-
Bài tập 7 trang 167 SGK Hóa học 10
Trong số các cân bằng sau, cân bằng nào sẽ chuyển dịch và dịch chuyển theo chiều nào khi giảm dung tích của bình phản ứng xuống ở nhiệt độ:
a) CH4(k) + H2O(k) ⇄ CO(k) + 3H2(k)
b) CO2(k) + H2(k) ⇄ CO(k) + H2O(k)
c) 2SO2(k) + O2(k) ⇄ 2SO3(k).
d) 2HI ⇄ H2(k) + I2(k)
e) N2O4(k) ⇄ 2NO2(k).
-
Bài tập 39.1 trang 85 SBT Hóa học 10
Người ta đã sử dụng nhiệt của phản ứng đốt cháy than đá để nung vôi :
CaCO3(r) ⥩(to) CaO (r) + CO2 (r) ΔH > 0
Biện pháp kĩ thuật nào sau đây không được sử dụng để tăng tốc độ phản ứng nung vôi ?
A. Đập nhỏ đá vôi với kích thước thích hợp.
B. Duy trì nhiệt độ phản ứng thích hợp.
C. Tăng nhiệt độ phản ứng càng cao càng tốt.
D. Thổi không khí nén vào lò nung vôi.
-
Bài tập 39.2 trang 86 SBT Hóa học 10
Trong những điều khẳng định sau, điều nào là phù hợp với một phản ứng hoá học ở trạng thái cân bằng ?
A. Phản ứng thuận đã kết thúc.
B. Phản ứng nghịch đã kết thúc.
C. Tốc độ của phản ứng thuận và nghịch bằng nhau.
D. Nồng độ của các chất tham gia và tạo thành sau phản ứng như nhau.
-
Bài tập 39.3 trang 86 SBT Hóa học 10
Để dập tắt một đám cháy thông thường, nhỏ, mới bùng phát người ta có thể
A. dùng vỏ chăn ướt trùm lên đám cháy.
B. dùng nước để dập tắt đám cháy.
C. dùng cát để dập tắt đám cháy.
D. Cả 3 phương án A, B, C.
-
Bài tập 39.4 trang 86 SBT Hóa học 10
Đối với phản ứng có chất khí tham gia thì
A. khi áp suất tăng, tốc độ phản ứng giảm.
B. khi áp suất tăng, tốc độ phản ứng tăng.
C. khi áp suất giảm, tốc độ phản ứng tăng.
D. áp suất không ảnh hưởng đến tốc độ phản ứng
-
Bài tập 39.5 trang 86 SBT Hóa học 10
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng với phản ứng có chất ở trạng thái nào dưới đây tham gia ?
A. Trạng thái lỏng.
B. Trạng thái khí.
C. Trạng thái rắn.
D. Cả 3 trạng thái: lỏng, khí, rắn.
-
Bài tập 39.6 trang 86 SBT Hóa học 10
Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25°C). Trường hợp nào tốc độ phản ứng không thay đổi ?
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M.
C. Thực hiện phản ứng ở 50°C.
D. Dùng thể tích dung dịch H2SO4 4M gấp đôi ban đầu.
-
Bài tập 39.7 trang 87 SBT Hóa học 10
Cho các phản ứng hoá học :
C(r) + H2O(k) ⇔ CO(k) + H2 (1)
2SO2 (k) + O2(k) ⇔ 2SO3(k) (2)
a) Hãy so sánh các đặc điểm của hai phản ứng hoá học trên.
b) Nêu các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất.
-
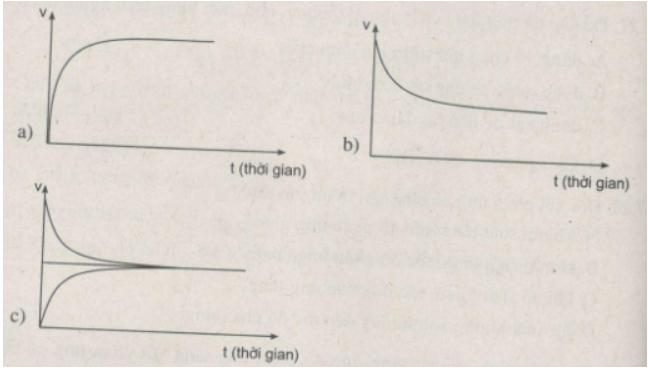
Bài tập 39.8 trang 87 SBT Hóa học 10
Đồ thị nào sau đây biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian ? Sự biến đổi tốc độ phản ứng nghịch theo thời gian ? Trạng thái cân bằng hoá học ?
-
Bài tập 39.9 trang 87 SBT Hóa học 10
Vì sao không nển để than đá hay giẻ lau máy đã qua sử dụng thành một đống lớn ?
-
Bài tập 39.10 trang 87 SBT Hóa học 10
Trong vòng 100 năm qua, nhiệt độ trung bình của Trái Đất đã tăng thêm 0,6°C. Nguyên nhân chính của hiện tượng này là do sự tăng nồng độ khí cacbon đioxit (CO2) trong khí quyển, gây ra hiệu ứng nhà kính. Tương tự hiệu ứng giữ ấm cho thực vật trong các nhà kính trồng rau mùa đông ở vùng ôn đới.
Mặc dù lượng khí CO2 do công nghiệp thải ra hàng năm rất lớn, tăng nhanh, nhưng tại sao nồng độ của chất khí này trong khí quyển tăng chậm ?
-
Bài tập 39.11 trang 88 SBT Hóa học 10
Trong nước ngầm thường có ion Fe2+ dưới dạng muối sắt (II) hiđrocacbonat và sắt (II) hiđroxit. Nước sinh hoạt có chứa ion Fe2+ ảnh hưởng xấu đến sức khoẻ của con người. Để loại bỏ ion Fe2+ một cách đơn giản, rẻ tiền, người ta dùng oxi không khí oxi hoá ion Fe2+, thành hợp chất chứa ion Fe3+(ít tan trong nước) rồi lọc để thu nước sạch. Để tăng tốc độ của phản ứng oxi hoá ion Fe2+ người ta sử dụng biện pháp kĩ thuật nào ? Giải thích.
-
Bài tập 39.12 trang 88 SBT Hóa học 10
Gần đây, khi thám hiểm Nam Cực, các nhà khoa học đã tìm thấy những đồ hộp do các đoàn thám hiểm trước để lại. Mặc dù đã qua hàng trăm năm, nhưng các thức ăn trong những đồ hộp đó vẫn trong tình trạng tốt, có thể ăn được. Hãy giải thích và liên hệ với viộc bảo quản thực phẩm bằng cách ướp đá.
-
Bài tập 39.13 trang 88 SBT Hóa học 10
Trong phòng thí nghiệm, để tăng tốc độ của một số phản ứng hoá học, ngoài các biện pháp như tăng nồng độ, nhiệt độ, người ta còn dùng máy khuấy. Tác dụng của máy khuấy là gì ?
-
Bài tập 39.14 trang 88 SBT Hóa học 10
Làm thế nào để điều khiển các phản ứng hoá học theo hướng có lợi nhất cho con người ?
-
Bài tập 39.15 trang 88 SBT Hóa học 10
Nồng độ các chất tham gia phản ứng có ảnh hưởng như thế nào đến tốc độ phản ứng khi các chất sau đây tác dụng với nhau?
a) CaCO3 + HCl →
b) H2 + Cl2 →
c) Fe3O4 + H2 →
-
Bài tập 39.16 trang 88 SBT Hóa học 10
Cho phản ứng: 3O2 ↔ 2O3
Nồng độ ban đầu của O2 là 0,24 mol/lít, sau 5 giây, nồng độ của O2 còn là 0,02 mol/lít. Hãy tính tốc độ của phản ứng trong thời gian đó.
-
Bài tập 39.17 trang 88 SBT Hóa học 10
Thực hiện phản ứng tổng hợp amoniac:
N2 + 3H2 ↔ 2NH3
Nồng độ mol ban đầu của các chất như sau :
[N2] = 1 mol/l ; [H2] = 1,2 mol/l
Khi phản ứng đạt cân bằng nồng độ mol của [NH3] = 0,2 mol/l. Tính hiệu suất của phản ứng tổng hợp amoniac.
-
Bài tập 1 trang 216 SGK Hóa học 10 nâng cao
Nội dung nào thể hiện trong các câu sau đây là sai?
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
B. Nước giải khát được nén khí CO2 ở áp suất cao hơn có độ chua (độ axit) lớn hơn.
C. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
D. Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong không khí.
-
Bài tập 2 trang 216 SGK Hóa học 10 nâng cao
Nội dung nào thể hiện trong các câu sau đây là đúng?
A. Hằng số cân bằng KC của mọi phản ứng đều tăng khi tăng nhiệt độ.
B. Hằng số cân bằng KC càng lớn, hiệu suất phản ứng càng nhỏ.
C. Khi một phản ứng thuận nghịch ở trạng thái cân bằng cũ chuyển sang trạng thái cân bằng mới ở nhiệt độ không đổi, hằng số cân bằng KC biến đổi.
D. Khi thay đổi hệ số tỉ lượng các chất trong phương trình hóa học của một phản ứng, giá trị của hằng số cân bằng KC thay đổi.
-
Bài tập 3 trang 216 SGK Hóa học 10 nâng cao
Trong các cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn?
a) Fe + CuSO4 (2M) và Fe + CuSO4 (4M) (cùng nhiệt độ).
b) Zn + CuSO4 (2M, 25oC) và Zn + CuSO4 (2M, 50°C).
c) Zn (hạt) + CuSO4 (2M) và Zn (bột) + CuSO4 (2M) (cùng nhiệt độ).
d) 2H2 + O2 → 2H2O (đk: nhiệt độ thường) và 2H2 + O2 → 2H2O (đk: nhiệt độ thường, Pt)
-
Bài tập 4 trang 216 SGK Hóa học 10 nâng cao
Cho phản ứng thuận nghịch sau:
2NaHCO3(r) ⇌ Na2CO3(r) + CO2(k) + H2O(k); ΔH = 129kJ
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3?
-
Bài tập 5 trang 216 SGK Hóa học 10 nâng cao
Khi đun nóng HI trong một bình kín, xảy ra phản ứng sau: 2HI(k) ⇌ H2(k) + I2(k)
a) Ở một nhiệt độ nào đó, hằng số cân bằng KC của phản ứng bằng 1/64. Tính xem có bao nhiêu phần trăm HI bị phân hủy ở nhiệt độ đó.
b) Tính hằng số cân bằng KC của hai phản ứng sau ở cùng nhiệt độ như trên:
HI(k) ⇆ 1/2 H2(k) + 1/2 I2(k) và H2(k) + I2(k) ⇆ 2HI(k)
-
Bài tập 6 trang 217 SGK Hóa học 10 nâng cao
Phản ứng nung vôi xảy ra như sau trong một bình kín:
CaCO3 (r) ⇌ CaO(r) + CO2(k); ΔH = 178kJ
Ở 820oC hằng số cân bằng KC = 4,28.10-3
a) Phản ứng trên là tỏa nhiệt hay thu nhiệt ?
b) Khi phẳn ứng đang ở trạng thái cân bằng, nếu biến đổi một trong những điều kiện sau đây thì hằng số cân bằng KC có biến đổi không và biến đổi như thế nào? Giải thích.
- Thêm khí CO2 vào.
- Lấy bớt một lượng CaCO3 ra.
- Tăng dung tích của bình phản ứng lên.
- Giảm nhiệt độ của phản ứng xuống.
c) Tại sao miệng của các lò nung vôi lại để hở? Nếu đậy kín xảy ra hiện tượng gì? Tại sao?
-
Bài tập 7 trang 217 SGK Hóa học 10 nâng cao
Cho 0,1 mol CaCO3(r) vào bình chân không dung tích 1 lít để thực hiện phản ứng sau:
CaCO3 (r) ⇌ CaO(r) + CO2(k);
Ở nhiệt độ 820oC , hằng số cân bằng KC = 4,28.10-3
Ở nhiệt độ 880oC, hằng số cân bằng KC = 1,06.10-2.
Tính hiệu suất chuyển hóa CaCO3 thành CaO và CO2 (%CaCO3 bị phân hủy) khi đạt đến trạng thái cân bằng ở hai nhiệt độ trên. So sánh các kết quả thu được hãy rút ra kết luận và giải thích.