Hóa 10 Bài 9: Liên kết ion chương trình SGK Chân trời sáng tạo được HOC247 biên soạn, nội dung tóm tắt trọng tâm lý thuyết bài liên kết ion, giúp các bạn học sinh nắm chắc kiến thức từ đó vận dụng giải các bài tập sách giáo khoa, sách bài tập, học tập tốt hơn môn Hóa học 10. Mời các bạn tham khảo chi tiết nội dung dưới đây.
Tóm tắt lý thuyết
1.1. Ion sự hình thành liên kết ion
a. Tìm hiểu về sự hình thành ion

Nguyên tử sodium (Na) lon sodium (Na+)
(a)

Nguyên tử oxygen (O) lon oxide (O2-)
(b)
Hình 9.1. Minh hoạ quá trình hình thành ion
+ Khi cho electron, nguyên tử trở thành ion dương (cation)
+ Khi nhận electron, nguyên tử trở thành ion âm (anion).
+ Giá trị diện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận.
b. Tìm hiểu phản ứng của sodium với chlorine
+ Khi cho sodium tác dụng với chlorine, ta thu được sodium chloride (NaCl). Phản ứng giữa sodium và chlorine có thể được minh hoạ bởi sơ đồ:
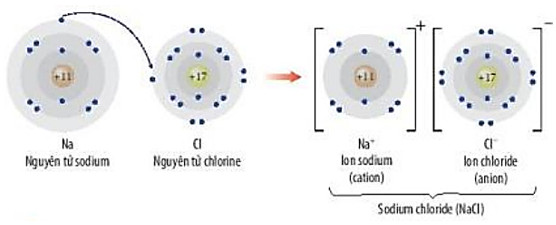
Hình 9.2. Minh hoạ sự hình thành liên kết ion trong phân tử NaCl
Phương trình hoá học: 2Na + Cl2 → 2NaCl
|
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. - Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình. |
|---|
1.2. Tinh thể ion
- Tìm hiểu về tinh thể NaCl và khái niệm ô mạng tinh thể NaCl là hợp chất ion phổ biến và quen thuộc trong đời sống. Trong điều kiện thường, hợp chất này tồn tại dưới dạng tinh thể rắn, cứng, dễ tan trong nước và có nhiệt độ nóng chảy khá cao (801 °C).
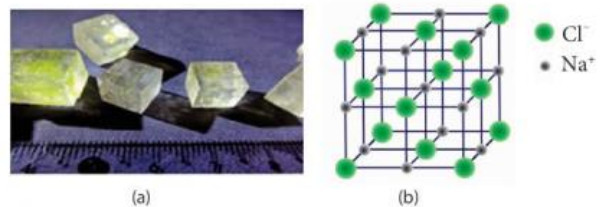
Hình 9.3. Tinh thể NaCl thực tế (a) và mô hình ô mạng tinh thể Na (b)
- Ô mạng tinh thể là đơn vị nhỏ nhất của mạng tinh thể, hiển thị cấu trúc không gian ba chiều của toàn bộ tinh thể.
- Tinh thể của một chất có thể xem là một ô mạng lặp đi lặp lại trong không gian ba chiều.
- Do các hợp chất ion có cấu trúc tinh thể và lực hút tĩnh điện mạnh nên chúng thường tồn tại ở trạng thái rắn trong điều kiện thường.
| Trong điều kiện thưởng, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. |
|---|
c. Thực hành lắp ráp mô hình tinh thể NaCl (theo mô hình có sẵn)
- Bước 1: Xác định số lượng mỗi loại khối cầu và số lượng các thanh nối cần sử dụng.
- Bước 2: Lắp xen kẽ các khối cầu và thanh nối như hình minh hoạ (Hình 9.4a).
- Bước 3: Hoàn chỉnh mô hình tinh thể NaCl (Hình 9.4b).
.jpg)
Hình 9.4. Minh họa cách lắp ráp mô hình tinh thể NaCl
Bài tập minh họa
Bài 1: Hơn 50% dược phẩm sử dụng trong y tế được sản xuất dưới dạng muối với mục đích thúc đẩy sự hấp thu các dược chất vào máu, tăng cường hiệu quả điều trị. Trong đó, thường gặp nhất là các muối hydrochloride, sodium hoặc sulfate.
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?
Hướng dẫn giải
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình
Bài 2: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của chúng (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa canxi và clo trong hợp chất CaCl2 thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó.
Hướng dẫn giải
Cl (Z = 17) : 1s22s22p63s23p5
Ca (Z = 20) : 1s22s22p63s23p64s2
Clo nằm ở ô số 17, chu kỳ 3, nhóm VIIA.
Canxi nằm ở ô số 20, chu kỳ 4, nhóm IIA.
Liên kết trong hợp chất CaCl2 là liên kết ion vì Ca là kim loại điển hình, Cl là phi kim điển hình.
Sơ đồ hình thành liên kết:
2Cl + 21e → 2Cl-
Ca → Ca2+ + 2e
Các ion Ca2+và Cl-tạo thành mang điện tích trái dấu, chúng hút nhau bằng lực hút tĩnh điện, tạo thành hợp chất CaCl2:
Ca2+ + 2Cl- → CaCl2
Bài 3: Z là một nguyên tố mà nguyên tử có chứa 12 proton, còn Y là một nguyên tố mà nguyên tử có chứa 9 proton. Công thức của hợp chất hình thành giữa các nguyên tố này là?
A. Z2Y với liên kết cộng hoá trị.
B. ZY2 với liên kết ion.
C. ZY với liên kết cho nhận.
D. Z2Y3 với liên kết cộng hoá trị.
Hướng dẫn giải
Cấu hình e của Z là: 1s22s22p63s2 → Z là kim loại. Z có xu hướng nhường 2 e để được cấu hình bền
Cấu hình e của Y là: 1s22s22p5 → Y là phi kim. Y có xu hướng nhận 1 e để được cấu hình bền
→ Liên kết với Y và Z là liên kết ion, tạo phân tử ZY2
Đáp án B
Luyện tập Bài 9 Hóa 10 CTST
Sau bài học này, học sinh sẽ:
- Trình bày được sự hình thành liên kết ion (nêu một số ví dụ điển hình tuần theo quy tắc octet).
- Nêu được cấu tạo tinh thể NaCl.
- Giải thích được vì sao các hợp chất ion thường ở trạng thái rắn trong điều kiện thường (dạng tinh thể ion).
- Lắp ráp được mô hình tinh thể NaCl (theo mô hình có sẵn).
3.1. Trắc nghiệm Bài 9 Hóa 10 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Chân trời sáng tạo Bài 9 cực hay có đáp án và lời giải chi tiết.
-
-
A.
kim loại.
- B. cộng hóa trị.
- C. ion.
- D. cho – nhận.
-
A.
-
- A. HCl
- B. H2O
- C. K2O
- D. NH3
-
- A. 1 liên kết đơn
- B. 3 liên kết đơn
- C. 1 liên kết đôi
- D. 1 liên kết ba
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 9 Hóa 10 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 9 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 2 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 3 trang 55 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 4 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 5 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 6 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 7 trang 56 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 8 trang 57 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 57 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 1 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 2 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 3 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 4 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5 trang 58 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.1 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.2 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.3 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.4 trang 30 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.5 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.6 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.7 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.8 trang 31 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.9 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.10 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.11 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.12 trang 32 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.13 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.14 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.15 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 9.16 trang 33 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỏi đáp Bài 9 Hóa học 10 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





