Bài 11: Liên kết Hydrogen và tương tác Van der Waals chương trình SGK Hóa học 10 chân trời sáng tạo. Với phần lý thuyết đầy đủ và bài tập minh họa đi kèm hướng dẫn giải chi tiết cho từng bài tập có trong chương trình học của sách giáo khoa. Hi vọng, các em học sinh hiểu và nắm vững kiến thức bài học.
Tóm tắt lý thuyết
1.1. Liên kết Hydrogen
a. Tìm hiểu về liên kết hydrogen
- Tìm hiểu về liên kết hydrogen. Nước và hydrogen sulfide (H2S) có cấu trúc phân tử tương tự nhau. Tuy H2S có kích thước phần tử lớn hơn nhưng nhiệt độ sôi của hợp chất này (-60°C) thấp hơn nhiều so với nước (100°C). Điều này có thể được giải thích bởi sự phân cực khác nhau của liên kết trong mỗi phân tử.
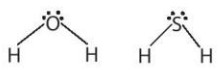
Hình 11.1. Cấu trúc phân tử của nước và hydrogen sulfide
- Lực hút tĩnh điện giữa nguyên tử H mang một phần điện tích dương (linh động) của phân tử H2O này với nguyên tử oxygen mang một phần điện tích âm của phân tử H2O khác, tạo thành liên kết yếu giữa các phần tử nước, gọi là liên kết hydrogen, thường được biểu diễn bằng dấu ba chấm (...).
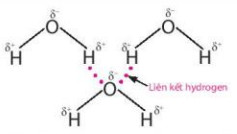
Hình 11.2. Liên kết hydrogen giữa các phân tử nước
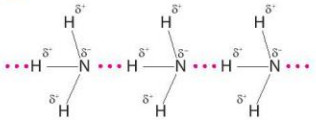
Hình 11.3. Liên kết hydrogen giữa các phần tử ammonia
- Liên kết hydrogen là một loại liên kết yểu, được hình thánh giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cập electron hoá trị chưa tham gia liên kết.
b. Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
- So với các hợp chất có cấu trúc phân tử tương tự, các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao hơn do tạo được liên kết hydrogen liền phân tử và tan tốt hơn trong nước do tạo được liên kết hydrogen với các phân tử nước. Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ sối cao hơn so với nhiều hợp chất có cùng cấu trúc phân tử nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau.
- Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ sối cao hơn so với nhiều hợp chất có cùng cấu trúc phân tử nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau. Ngoài ra, nước còn là một dung môi tốt, không chỉ hoà tan được nhiều hợp chất ion, mà còn hoà tan được nhiều hợp chất có liên kết cộng hoá trị phân cực. Đặc biệt, các hợp chất có thể tạo liên kết hydrogen với nước thường tan tốt trong nước. Hầu hết các phản ứng hoá học quan trọng đối với sự sống đều diễn ra ở môi trường nước bên trong tế bào.
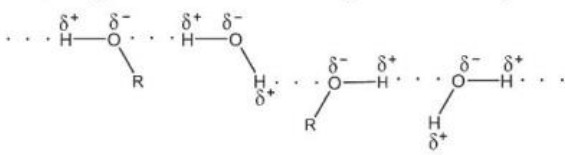
Hình 11.4. Liên kết hydrogen giữa alcohol và nước
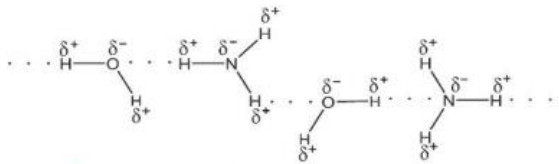
Hình 11.5. Lên kết hydrogen giữa ammonia và nước
- Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng. Đó là do nước đá có cấu trúc tinh thể phân tử với bốn phân tử H2O phân bổ ở bốn định của một tử diện đểu, bên trong là cấu trúc rỗng (Hình 11.6). Điều này lý giải tại sao nước đá nổi được trên mặt nước lỏng.
Hình 11.6. Cấu trúc của tinh thể phân tử nước đá
- Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100°C).
1.2. Tương tác Van der Waals
a. Giới thiệu về tương tác van der Waals (van đơ Van)
Trong phân tử, các electron không ngừng chuyển động. Khi các electron di chuyển tập trung về một phía bất kì của phần tử sẽ hình thành nên các lưỡng cực tạm thời. Ví dụ, ta có thể tìm thấy các electron phân bố như Hình 11.7 trong một phân tử.
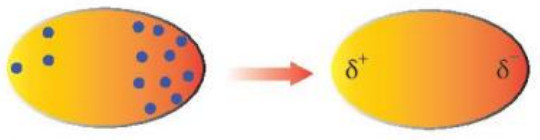
Hình 11.7. Lưỡng cực tạm thời được hình thành do sự phân bố không đồng đều của các electron trong phân tử
- Các phân tử có lưỡng cực tạm thời cũng có thể làm các phân tử lân cận xuất hiện các lưỡng cực cảm ứng. Do đó, các phân tử có thể tập hợp thành một mạng lưới với các tương tác lưỡng cực cảm ứng , được gọi là tương tác van der Waals (Hinh 11.8).
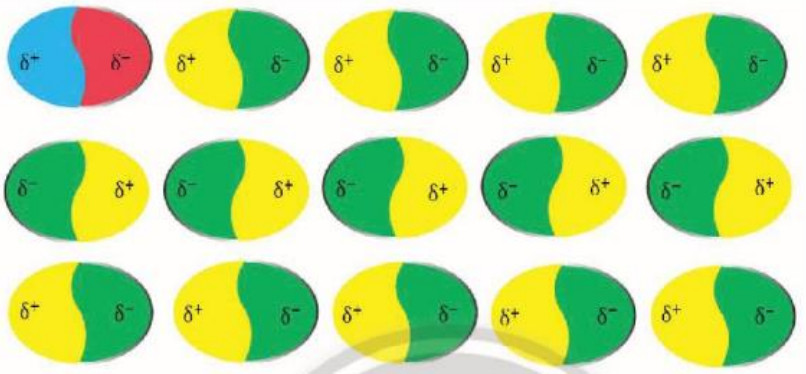
Hình 11.8. Mạng lưới tương tác lưỡng cực cảm ứng được tạo thành bởi lưỡng cực tạm thời
- Tìm hiểu ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy và nhiệt độ sôi các chất
- Tương tác van der Waals được sử dụng để giải thích sự khác biệt về nhiệt độ nóng chảy và nhiệt độ sôi giữa các chất.
Bảng 11.1. Nhiệt độ sôi và nhiệt độ nóng chảy của các khí hiếm
.jpg)
- Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng
Bài tập minh họa
Bài 1: Trong việc hình thành liên kết hóa học, không phải lúc nào các nguyên tử cũng cho, nhận electron hóa trị với nhau như trong liên kết ion. Thay vào đó, chúng có thể cùng nhau sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet. Trong trường hợp này, một loại liên kết hóa học mới được hình thành. Đó là loại liên kết gì?
Hướng dẫn giải
Liên kết mà các nguyên tử sử dụng chung các electron hóa trị để cùng thỏa mãn quy tắc octet được gọi là liên kết cộng hóa trị
Bài 2: Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Hướng dẫn giải
Đồng phân mạch không phân nhánh butane có nhiệt độ sôi cao hơn so với đồng phân mạch phân nhánh isobutan do diện tích tiếp xúc giữa các phân tử butane lớn hơn nhiều so với isobutane.
Bài 3: Ở áp suất khí quyển, nhiệt độ sôi của H2O là 1000C, CH4 là -161,580C, H2S là -60,280C. Vì sao các chất trên có nhiệt độ sôi khác nhau.
Hướng dẫn giải
- Liên kết hydrogen được hình thành giữa nguyên tử hydrogen với các nguyên tử có độ âm điện lớn và các nguyên tử này phải có 1 ít nhất một cặp electron hóa trị chưa tham gia liên kết.
- Do O và S đều còn 2 cặp electron hóa trị chưa tham gia liên kết, C không còn cặp electron hóa trị tự do nên H2O và H2S có thể tạo liên kết hydrogen trong phân tử, còn CH4 thì không.
→ Nhiệt độ sôi của H2O và H2S lớn hơn CH4.
- Do độ âm điện của O lớn hơn S nên liên kết hydrogen trong phân tử H2O mạnh hơn trong phân tử H2S.
→ Nhiệt độ sôi của H2O lớn hơn H2S.
Luyện tập Bài 11 Hóa 10 CTST
Sau bài học này, học sinh sẽ:
- Trình bày được khái niệm liên kết hydrogen. Vận dụng để giải thích được sự xuất hiện liên kết hydrogen.
- Nêu được vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
- Nêu được khái niệm về tương tác van der Waals và ảnh hưởng của tương tác này tới nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
3.1. Trắc nghiệm Bài 11 Hóa 10 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Chân trời sáng tạo Bài 11 cực hay có đáp án và lời giải chi tiết.
-
- A. Lưỡng tháp tam giác
- B. Tháp vuông
- C. Bát diện đều
- D. Vuông phẳng
-
- A. Hiđro.
- B. Ion.
- C. Cộng hóa trị không cực.
- D. Cộng hóa trị có cực.
-
- A. tinh thể kim loại
- B. tinh thể ion
- C. tinh thể nguyên tử
- D. tinh thể phân tử
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 11 Hóa 10 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 11 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 67 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 2 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 3 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 4 trang 68 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 5 trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 6 trang 69 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 7 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 8 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 1 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 2 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 3 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 4 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5 trang 70 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.1 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.2 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.3 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.4 trang 39 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.5 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.6 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.7 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.8 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.9 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.10 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.11 trang 40 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.12 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.13 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.14 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.15 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 11.16 trang 41 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỏi đáp Bài 11 Hóa học 10 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





