Mб»қi cГЎc em hб»Қc sinh cГ№ng tham khбәЈo tГ i liб»Үu Bб»ҷ 5 Д‘б»Ғ thi HK2 mГҙn HГіa hб»Қc 10 nДғm 2021-2022 cГі Д‘ГЎp ГЎn TrЖ°б»қng THPT Phan Ngб»Қc Hiб»ғn dЖ°б»ӣi Д‘Гўy Д‘ГЈ Д‘Ж°б»Јc Hб»Қc247 biГӘn soбәЎn vГ tб»•ng hб»Јp nhбәұm giГәp cГЎc em cГі thб»ғ tham khбәЈo dбәЎng Д‘б»Ғ thi HK2 sбәҜp Д‘бәҝn. ChГәc cГЎc em sбәҪ cГі mб»ҷt kГ¬ thi Д‘бәЎt Д‘iб»ғm cao nhГ©!
|
TRЖҜб»ңNG THPT PHAN NGб»ҢC HIб»ӮN |
Дҗб»Җ THI Hб»ҢC KГҢ 2 MГ”N HГ“A Hб»ҢC 10 NДӮM Hб»ҢC 2021-2022 Thб»қi gian lГ m bГ i 45 phГәt |
Дҗб»Җ THI Sб»җ 1
I. TRбә®C NGHIб»ҶM
CГўu 1: CГЎc sб»‘ oxi hoГЎ cГі thб»ғ cГі của lЖ°u huб»іnh lГ :
A. 0, +2, +4, +6
B. -2, +4, +6
C. -2, +4, +5
D. -2, 0, +4, +6
CГўu 2: Kim loбәЎi bб»Ӣ thб»Ҙ Д‘б»ҷng trong H2SO4 Д‘бә·c, nguб»ҷi lГ :
A. Al
B. Cu
C. Mg
D. Zn
CГўu 3: H2SO4 Д‘бә·c khi tiбәҝp xГәc vб»ӣi Д‘Ж°б»қng, vбәЈi, giбәҘy cГі thб»ғ lГ m chГәng hГіa Д‘en do tГӯnh chбәҘt nГ o dЖ°б»ӣi Д‘Гўy:
A. oxi hГіa mбәЎnh
B. hГЎo nЖ°б»ӣc
C. axit mбәЎnh
D. khб»ӯ mбәЎnh
CГўu 4: Sб»ұ cГі mбә·t của ozon trГӘn thЖ°б»Јng tбә§ng khГӯ quyб»ғn rбәҘt cбә§n thiбәҝt, vГ¬:
A. ozon lГ m cho trГЎi Д‘бәҘt бәҘm hЖЎn.
B. ozon ngДғn cбәЈn oxi khГҙng cho thoГЎt ra khб»Ҹi mбә·t Д‘бәҘt.
C. ozon hбәҘp thб»Ҙ tia cб»ұc tГӯm.
D. ozon hбәҘp thб»Ҙ tia Д‘бәҝn tб»« ngoГ i khГҙng gian Д‘б»ғ tбәЎo freon.
CГўu 5: HЖЎi thủy ngГўn rбәҘt Д‘б»ҷc, do Д‘Гі phбәЈi thu hб»“i thủy ngГўn rЖЎi vГЈi bбәұng cГЎch:
A. Nhб»Ҹ nЖ°б»ӣc brom lГӘn giб»Қt thủy ngГўn.
B. Nhб»Ҹ nЖ°б»ӣc ozon lГӘn giб»Қt thủy ngГўn.
C. RбәҜc bб»ҷt lЖ°u huб»іnh lГӘn giб»Қt thủy ngГўn.
D. RбәҜc bб»ҷt photpho lГӘn giб»Қt thủy ngГўn.
CГўu 6: Nhб»қ bбәЈo quбәЈn bбәұng nЖ°б»ӣc ozon, mбәӯn BбәҜc HГ вҖ“ LГ o Cai, cam HГ Giang Д‘ГЈ Д‘Ж°б»Јc bбәЈo quбәЈn tб»‘t hЖЎn, nhб»қ Д‘Гі bГ con nГҙng dГўn Д‘ГЈ cГі thu nhбәӯp cao hЖЎn. NguyГӘn nhГўn nГ o sau Д‘Гўy lГ m cho nЖ°б»ӣc ozon cГі thб»ғ bбәЈo quбәЈn hoa quбәЈ tЖ°ЖЎi lГўu ngГ y:
A. Ozon lГ mб»ҷt khГӯ Д‘б»ҷc.
B. Ozon Д‘б»ҷc vГ dб»… tan trong nЖ°б»ӣc hЖЎn oxi.
C. Ozon cГі tГӯnh chбәҘt oxi hoГЎ mбәЎnh, khбәЈ nДғng sГЎt trГ№ng cao vГ dб»… tan trong nЖ°б»ӣc hЖЎn oxi.
D. Ozon cГі tГӯnh tбә©y mГ u.
CГўu 7: ДҗГўy lГ Д‘ЖЎn chбәҘt gГ¬?
- б»һ Д‘iб»Ғu kiб»Үn thЖ°б»қng Д‘ЖЎn chбәҘt nГ y cГі trбәЎng thГЎi rбәҜn, mГ u vГ ng.
- ДҗЖЎn chбәҘt nГ y thЖ°б»қng Д‘Ж°б»Јc tГ¬m thбәҘy б»ҹ cГЎc suб»‘i nЖ°б»ӣc nГіng, gбә§n miб»Үng nГәi lб»ӯa hoбә·c б»ҹ cГЎc mб»Ҹ muб»‘i.
- LГ thГ nh phбә§n quan trб»Қng trong phГЎt minh nб»•i tiбәҝng nhбәҘt của ngЖ°б»қi Trung Hoa cб»• Д‘бәЎi.
A. LЖ°u huб»іnh
B. VГ ng
C. Cacbon
D. Oxi
CГўu 8: CбәҘu hГ¬nh electron lб»ӣp ngoГ i cГ№ng của cГЎc nguyГӘn tб»‘ nhГіm VIA lГ
A. ns2np4
B. ns2np3
C. ns2np5
D. ns2np6
CГўu 9: BбәЎc tiбәҝp xГәc vб»ӣi khГҙng khГӯ cГі H2S bб»Ӣ biбәҝn Д‘б»•i thГ nh sunfua:
4Ag + 2H2S +O2 вҶ’ 2Ag2S + 2H2O
Mб»Үnh Д‘б»Ғ diб»…n tбәЈ Д‘Гәng tГӯnh chбәҘt của cГЎc chбәҘt phбәЈn б»©ng lГ :
A. H2S lГ chбәҘt oxi hГіa, Ag lГ chбәҘt khб»ӯ.
B. Ag lГ chбәҘt khб»ӯ, O2 lГ chбәҘt oxi hГіa.
C. H2S lГ chбәҘt khб»ӯ, Ag lГ chбәҘt oxi hГіa.
D. Ag lГ chбәҘt oxi hГіa, O2 lГ chбәҘt khб»ӯ.
CГўu 10: Trong cГЎc phбәЈn б»©ng hoГЎ hб»Қc, Д‘б»ғ chuyб»ғn thГ nh anion, nguyГӘn tб»ӯ của cГЎc nguyГӘn tб»‘ halogen Д‘ГЈ nhбәӯn hay nhЖ°б»қng bao nhiГӘu electron?
A. Nhбәӯn thГӘm 1 electron
B. Nhбәӯn thГӘm 2 electron
C. NhЖ°б»қng Д‘i 1 electron
D. NhЖ°б»қng Д‘i 7 electron
CГўu 11: Cho 2 phaМүn Ж°МҒng sau :
H2 + S вҶ’ H2S (1)
S + O2 вҶ’ SO2 (2)
Kбәҝt luбәӯn nГ o sau Д‘Гўy Д‘Гәng Д‘Ж°б»Јc rГәt ra tб»« 2 phбәЈn б»©ng trГӘn:
A. S chiМү coМҒ tiМҒnh khЖ°Мү.
B. S chiМү coМҒ tiМҒnh oxi hoМҒa.
C. S vЖ°МҖa coМҒ tiМҒnh khЖ°Мү, vЖ°МҖa coМҒ tiМҒnh oxi hoМҒa.
D. S chiМү taМҒc duМЈng vЖЎМҒi caМҒc phi kim.
CГўu 12: Muб»‘i clorua quan trб»Қng nhбәҘt lГ muб»‘i X. NgoГ i viб»Үc bбәЈo quбәЈn thб»©c Дғn vГ bбәЈo quбәЈn thб»ұc phбә©m, X lГ nguyГӘn liб»Үu quan trб»Қng Д‘б»‘i vб»ӣi ngГ nh cГҙng nghiб»Үp hГіa chбәҘt Д‘iб»Ғu chбәҝ Cl2, H2, NaOH, nЖ°б»ӣc Gia-venвҖҰ X lГ muб»‘i:
A. NaCl B. CuCl2 C. CaCl2 D. AgCl
II. Tб»° LUбә¬N
CГўu 1: Viбәҝt cГЎc phЖ°ЖЎng trГ¬nh phбәЈn б»©ng theo sЖЎ Д‘б»“ chuyб»ғn hoГЎ sau (ghi rГө Д‘iб»Ғu kiб»Үn nбәҝu cГі).
S вҶ’ H2S вҶ’ SO2 вҶ’ H2SO4 вҶ’ CO2
CГўu 2: NГӘu hiб»Үn tЖ°б»Јng vГ giбәЈi thГӯch khi thб»ұc hiб»Үn cГЎc thГӯ nghiб»Үm sau (viбәҝt phЖ°ЖЎng trГ¬nh phбәЈn б»©ng nбәҝu cГі).
a. ThГӯ nghiб»Үm 1: Cho Д‘inh sбәҜt vГ o dung dб»Ӣch H2SO4 loГЈng
b. ThГӯ nghiб»Үm 2: Sб»Ҙc khГӯ SO2 vГ o dung dб»Ӣch brom
CГўu 3: Cho 12,8 gam hб»—n hб»Јp X gб»“m FeO vГ Fe vГ o dung dб»Ӣch H2SO4 loГЈng, dЖ°. Sau khi cГЎc phбәЈn б»©ng xбәЈy ra hoГ n toГ n thu Д‘Ж°б»Јc 2,24 lit khГӯ б»ҹ Д‘ktc.
a. Viбәҝt phЖ°ЖЎng trГ¬nh phбәЈn б»©ng xбәЈy ra.
b. TГӯnh thГ nh phбә§n phбә§n trДғm theo khб»‘i lЖ°б»Јng mб»—i chбәҘt trong hб»—n hб»Јp X.
c. Cho 6,4 gam hб»—n hб»Јp X б»ҹ trГӘn tГЎc dб»Ҙng vб»ӣi dung dб»Ӣch H2SO4 Д‘бә·c nГіng, dЖ° thu Д‘Ж°б»Јc khГӯ SO2. Sб»Ҙc toГ n bб»ҷ lЖ°б»Јng khГӯ SO2 thu Д‘Ж°б»Јc vГ o dung dб»Ӣch nЖ°б»ӣc vГҙi trong lбәҘy dЖ° thбәҘy xuбәҘt hiб»Үn kбәҝt tủa. Cho biбәҝt khб»‘i lЖ°б»Јng dung dб»Ӣch nЖ°б»ӣc vГҙi trong tДғng hay giбәЈm bao nhiГӘu gam?
ДҗГҒP ГҒN Дҗб»Җ THI Sб»җ 1
I. TRбә®C NGHIб»ҶM
|
1D |
2A |
3B |
4C |
5C |
6C |
7A |
8A |
9B |
10A |
11C |
12A |
II. Tб»° LUбә¬N
CГўu 1:
1.S + H2 \(\xrightarrow{{{t}^{0}}}\) H2S
2. 2H2S + 3O2dЖ° \(\xrightarrow{{{t}^{0}}}\) 2SO2 + 2H2O
3.SO2 + Br2 + H2O \(\xrightarrow{{}}\) H2SO4 + 2HBr
4.H2SO4 + CaCO3 \(\xrightarrow{{}}\) CaSO4 + CO2 + H2O
CГўu 2:
a.Hiб»Үn tЖ°б»Јng: CГі khГӯ khГҙng mГ u, khГҙng mГ№i bay ra
PhЖ°ЖЎng trГ¬nh phбәЈn б»©ng: Fe + H2SO4 \(\xrightarrow{{}}\) FeSO4 + H2
b.Hiб»Үn tЖ°б»Јng: Dung dб»Ӣch nЖ°б»ӣc brГҙm mбәҘt mГ u
PhЖ°ЖЎng trГ¬nh phбәЈn б»©ng: SO2 + Br2 + H2O \(\xrightarrow{{}}\) H2SO4 + 2HBr
CГўu 3:
a.PTPЖҜ:
FeO + H2SO4 \(\xrightarrow{{}}\)FeSO4 + H2O(1)
Fe + H2SO4 \(\xrightarrow{{}}\) FeSO4 + H2(2)
Theo PT(2): nFe = nH2 = 2,24: 22,4 = 0,1 mol.
Suy ra : mFe = 5,6 gam; mFeO = 7,2 gam.
%mFeO = 7,2x100:12,8 = 56,25%.
%mFe = 100% - 56,25% = 43,75%.
b.2FeO + 4H2SO4 \(\xrightarrow{{}}\) Fe2(SO4)3 + SO2 + 4H2O (3)
2Fe + 6H2SO4 \(\xrightarrow{{}}\) Fe2(SO4)3 + 3SO2 + 6H2O (4)
SO2 + Ca(OH)2 \(\xrightarrow{{}}\) CaSO3 + H2O (5)
Theo phương trình 3,4,5: nSO2 = nCaSO3= 0,1 mol.
mCaSO3 = 0,1 x120 = 12 gam.
Vì mSO2 = 0,1x64 = 6,4 gam < mCaSO3
\(\xrightarrow{{}}\) mCaSO3 вҖ“ mSO2 = 12 вҖ“ 6,4 = 5,6 gam.
Vбәӯy: khб»‘i lЖ°б»Јng dung dб»Ӣch nЖ°б»ӣc vГҙi trong giбәЈm 5,6 gam.
Дҗб»Җ THI Sб»җ 2
Дҗб»Җ THI HK2 MГ”N HOГҒ Hб»ҢC 10 NДӮM 2022 TRЖҜб»ңNG THPT PHAN NGб»ҢC HIб»ӮN- Дҗб»Җ Sб»җ 2
CГўu 1: HoГ n thГ nh chuб»—i phбәЈn б»©ng sau (ghi rГө Д‘iб»Ғu kiб»Үn nбәҝu cГі):
.jpg?enablejsapi=1)
CГўu 2: NГӘu hiб»Үn tЖ°б»Јng xбәЈy ra vГ viбәҝt phЖ°ЖЎng trГ¬nh phбәЈn б»©ng minh hб»Қa trong cГЎc trЖ°б»қng hб»Јp sau:
a) Sб»Ҙc khГӯ Cl2 vГ o dung dб»Ӣch Na2CO3.
b) Cho quГ¬ tГӯm tбә©m dung dб»Ӣch KI tiбәҝp xГәc vб»ӣi khГӯ ozon.
c) Cho khГӯ H2S vГ o dung dб»Ӣch brom.
d) Cho khГӯ SO2 vГ o dung dб»Ӣch nЖ°б»ӣc vГҙi trong dЖ°.
CГўu 3: Cho cГўn bбәұng sau: 2SO2 (k) + O2 (k) вҮ” 2SO3 (k), rH < 0.
CГўn bбәұng sбәҪ chuyб»ғn dб»Ӣch theo chiб»Ғu nГ o khi (giбәЈi thГӯch ngбәҜn gб»Қn):
a) giбәЈm ГЎp suбәҘt của hб»Ү.
b) thб»•i khГҙng khГӯ vГ o hб»Ү.
c) tДғng nhiб»Үt Д‘б»ҷ của hб»Ү.
d) lбәҘy bб»ӣt SO3 ra.
CГўu 4: Cho 23,25 gam hб»—n hб»Јp gб»“m Zn, Al, Ag tГЎc dб»Ҙng vб»ӣi dung dб»Ӣch H2SO4 20% vб»«a đủ thГ¬ thu Д‘Ж°б»Јc 6,72 lГӯt H2 (Д‘ktc) vГ cГІn lбәЎi a gam chбәҘt rбәҜn khГҙng tan. Cho a gam chбәҘt rбәҜn khГҙng tan nГ y tГЎc dб»Ҙng vб»ӣi H2SO4 Д‘бә·c, nГіng dЖ° thГ¬ thu Д‘Ж°б»Јc 1,12 lГӯt SO2 (Д‘ktc).
a) TГӯnh % khб»‘i lЖ°б»Јng mб»—i kim loбәЎi trong hб»—n hб»Јp ban Д‘бә§u.
b) Cho lЖ°б»Јng SO2 б»ҹ trГӘn tГЎc dб»Ҙng hoГ n toГ n vб»ӣi 200 ml dung dб»Ӣch KOH 0,3M. TГӯnh CM của chбәҘt trong dung dб»Ӣch sau phбәЈn б»©ng.
CГўu 5: Oxi hГіa m gam bб»ҷt sбәҜt bбәұng oxi khГҙng khГӯ thГ¬ thu Д‘Ж°б»Јc 75,2 gam hб»—n hб»Јp A gб»“m 4 chбәҘt rбәҜn. Cho hб»—n hб»Јp A tГЎc dб»Ҙng vб»ӣi H2SO4 Д‘бә·c, nГіng dЖ° thГ¬ thu Д‘Ж°б»Јc 6,72 lГӯt SO2 (Д‘ktc). HГЈy tГӯnh giГЎ trб»Ӣ của m.
---(Дҗб»ғ xem tiбәҝp nб»ҷi dung Д‘ГЎp ГЎn của Д‘б»Ғ thi sб»‘ 2 cГЎc em vui lГІng xem Online hoбә·c ДҗДғng nhбәӯp vГ o HOC247 Д‘б»ғ tбәЈi vб»Ғ mГЎy)---
Дҗб»Җ THI Sб»җ 3
Дҗб»Җ THI HK2 MГ”N HOГҒ Hб»ҢC 10 NДӮM 2022 TRЖҜб»ңNG THPT PHAN NGб»ҢC HIб»ӮN- Дҗб»Җ Sб»җ 3
I. TrбәҜc nghiб»Үm:
0001: PhбәЈn б»©ng Д‘iб»Ғu chбәҝ khГӯ clo trong phГІng thГӯ nghiб»Үm lГ :
A. 2NaCl вҶ’2Na + Cl2 .
B. F2 + 2NaCl вҶ’ 2NaF + Cl2 .
C. 4HCl + MnO2 вҶ’ MnCl2 + 2H2O + Cl2 .
D. 2HCl вҶ’ H2 + Cl2.
0002: ChбәҘt Дғn mГІn thủy tinh lГ :
A. KF. B. HF. C. F2. D. HI.
0003: Khi nung nГіng, iot biбәҝn thГ nh hЖЎi khГҙng qua trбәЎng thГЎi lб»Ҹng. Hiб»Үn tЖ°б»Јng nГ y Д‘Ж°б»Јc gб»Қi lГ
A. sб»ұ bay hЖЎi.
B. sб»ұ chuyб»ғn trбәЎng thГЎi.
C. sб»ұ thДғng hoa.
D. sб»ұ phГўn hủy.
0004: Cho cГЎc phбәЈn б»©ng:
(1) SiO2 + dung dб»Ӣch HF вҶ’
(2) F2 + H2O \(\xrightarrow{{{t}^{o}}}\)
(3) AgBr \(\xrightarrow{as}\)
(4) Br2 + NaI (dЖ°) вҶ’
Trong cГЎc phбәЈn б»©ng trГӘn, nhб»Ҝng phбәЈn б»©ng cГі tбәЎo ra Д‘ЖЎn chбәҘt lГ
A. (1), (2), (3).
B. (1), (3), (4).
C. (2), (3), (4).
D. (1), (2), (4).
0005: Chia mГҙМЈt dung diМЈch nЖ°ЖЎМҒc brom coМҒ maМҖu vaМҖng laМҖm 2 phГўМҖn:
- DГўМғn khiМҒ X khГҙng maМҖu vaМҖo phГўМҖn 1 thiМҖ dung diМЈch mГўМҒt maМҖu
- DГўМғn khiМҒ Y khГҙng maМҖu vaМҖo phГўМҖn 2 thiМҖ dung diМЈch sГўМғm maМҖu hЖЎn.
KhiМҒ X vaМҖ Y coМҒ thГӘМү lГўМҖn lЖ°ЖЎМЈt laМҖ:
A. SO2 vaМҖ HI. B. N2 vaМҖ CO2. C. SO2 vaМҖ Cl2. D. SO2 vaМҖ CO2.
0006: Cho 0,5 mol KOH tГЎc dб»Ҙng vб»ӣi 0,5mol HCl.Cho quГ¬ tГӯm vГ o dung dб»Ӣch sau phбәЈn б»©ng, quГ¬ tГӯm chuyб»ғn sang mГ u:
A. hб»“ng. B. khГҙng Д‘б»•i mГ u. C. Д‘б»Ҹ. D. xanh.
0007: Sб»Ҙc tб»« tб»« 2,24 lit SO2 (Д‘kc) vГ o 100 ml dung dб»Ӣch NaOH 3M. CГЎc chбәҘt cГі trong dung dб»Ӣch sau phбәЈn б»©ng?
A. Na2SO3, NaOH, H2O.
B. NaHSO3,H2O.D. Na2SO3
, NaHSO3, H2O.
0008: Cho hб»—n hб»Јp X gб»“m Fe(56) vГ Mg(24) vГ o dung dб»Ӣch HCl vб»«a đủ thГ¬ Д‘Ж°б»Јc 0,224lГӯt hydro(Д‘ktc). Mбә·t khГЎc A tГЎc dб»Ҙng vб»«a đủ vб»ӣi 0,28lГӯt clo (Д‘ktc). ThГ nh phбә§n % khб»‘i lЖ°б»Јng Mg trong X lГ :
A. 30%. B. 43%. C. 70%. D. 57%.
0009: Cho 0,448 lГӯt Clo (Д‘ktc) vГ o dung dб»Ӣch NaX dЖ°, Д‘Ж°б»Јc 5,08 gam X2. NguyГӘn tб»‘ X lГ :
A. F. B. Cl. C. Br. D. I.
0010: CГЎc sб»‘ oxi hГіa cГі thб»ғ cГі của lЖ°u huб»іnh lГ
A. - 2; 0; +4; +6. B. 0; +2; +4;+6. C. - 2; +4: +6. D. 0; +4; +6.
0011: NgЖ°б»қi ta phбәЈi bЖЎm, sб»Ҙc khГҙng khГӯ vГ o cГЎc bб»ғ nuГҙi cГЎ cбәЈnh.Trong bб»ғ cГЎ, ngЖ°б»қi ta lбәҜp thГӘm mГЎy sб»Ҙc khГӯ lГ Д‘б»ғ
A. cung cбәҘp thГӘm nitЖЎ cho cГЎ.
B. cung cбәҘp thГӘm oxi cho cГЎ.
C. cung cбәҘp thГӘm cacbon Д‘ioxit.
D. chб»ү Д‘б»ғ lГ m Д‘бә№p.
0012: Lб»ӣp ozon б»ҹ tбә§ng bГ¬nh lЖ°u của khГӯ quyб»ғn lГ tбәҘm lГЎ chбәҜn tia tб»ӯ ngoбәЎi của Mбә·t trб»қi, bбәЈo vб»Ү sб»ұ sб»‘ng trГӘn TrГЎi Д‘бәҘt. Hiб»Үn tЖ°б»Јng suy giбәЈm tбә§ng ozon Д‘ang lГ mб»ҷt vбәҘn Д‘б»Ғ mГҙi trЖ°б»қng toГ n cбә§u. NguyГӘn nhГўn của hiб»Үn tЖ°б»Јng nГ y lГ do
A. cГЎc hб»Јp chбәҘt hб»Ҝu cЖЎ trong tб»ұ nhiГӘn.
B. sб»ұ thay Д‘б»•i của khГӯ hбәӯu.
C. chбәҘt thбәЈi CFC.
D. chбәҘt thбәЈi CO2.
0013: Дҗб»ғ phГўn biб»Үt O2 vГ O3, ngЖ°б»қi ta thЖ°б»қng dГ№ng thuб»‘c thб»ӯ lГ
A. nЖ°б»ӣc.
B. dung dб»Ӣch KI vГ hб»“ tinh bб»ҷt.
C. dung dб»Ӣch CuSO4.
D. dung dб»Ӣch H2SO4.
00014: Дҗiб»Ғn tб»« thГӯch hб»Јp vГ o chб»— trб»‘ng trong Д‘oбәЎn vДғn bбәЈn sau:
Oxi trong khГҙng khГӯ lГ sбәЈn phбә©m của quГЎ trГ¬nh вҖҰ(1). CГўy xanh lГ nhГ mГЎy sбәЈn xuбәҘt cacbohiД‘rat vГ oxi tб»« cacbon Д‘ioxit vГ nЖ°б»ӣc dЖ°б»ӣi tГЎc dб»Ҙng của вҖҰ(2)вҖҰ mбә·t trб»қi. Nhб»қ sб»ұ quang hб»Јp của cГўy xanh mГ lЖ°б»Јng khГӯ oxi trong khГҙng khГӯ hбә§u nhЖ° вҖҰ(3).
A. (1) quang hб»Јp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
B. (1) hГҙ hбәҘp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
C. (1) quang hб»Јp, (2) nhiб»Үt, (3) thay Д‘б»•i.
D. (1) hГҙ hбәҘp, (2) nДғng lЖ°б»Јng, (3) thay Д‘б»•i.
0015: DГЈy gб»“m cГЎc chбәҘt Д‘б»Ғu tГЎc dб»Ҙng vб»ӣi oxi lГ
A. H2, Fe, Cl2. B. Mg, C, Al. C. CO, Au, S. D. Na, H2S, Pt.
0016: Trong phГІng thГӯ nghiб»Үm khГӯ oxi cГі thб»ғ Д‘Ж°б»Јc Д‘iб»Ғu chбәҝ bбәұng cГЎch nhiб»Үt phГўn muб»‘i KClO3 cГі MnO2 lГ m xГәc tГЎc vГ cГі thб»ғ Д‘Ж°б»Јc thu bбәұng cГЎch Д‘бә©y nЖ°б»ӣc hay Д‘бә©y khГҙng khГӯ
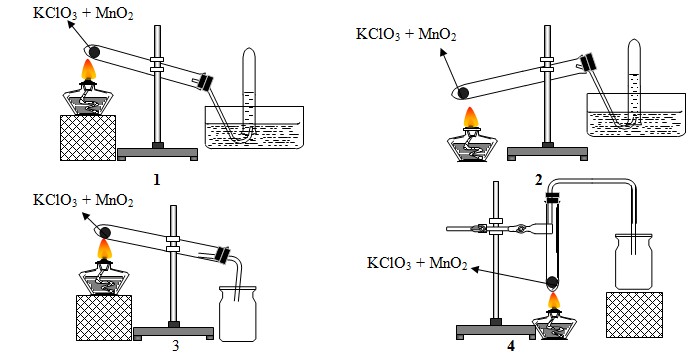
Trong cГЎc hГ¬nh vбәҪ cho б»ҹ trГӘn, hГ¬nh vбәҪ mГҙ tбәЈ Д‘iб»Ғu chбәҝ vГ thu khГӯ oxi Д‘Гәng cГЎch lГ
A. 1 vГ 2. B. 2 vГ 3. C. 1 vГ 3. D. 3 vГ 4.
0017: CГі mб»ҷt hб»—n hб»Јp khГӯ gб»“m oxi vГ ozon. Hб»—n hб»Јp khГӯ nГ y cГі tб»ү khб»‘i so vб»ӣi H2 lГ 18. ThГ nh phбә§n phбә§n trДғm theo thб»ғ tГӯch của oxi vГ ozon trong hб»—n hб»Јp khГӯ lбә§n lЖ°б»Јt lГ
A. 80% vГ 20%. B. 75% vГ 25%. C. 25% vГ 75%. D. 60% vГ 40%.
0018: Trб»ҷn 22,4 gam bб»ҷt Fe vб»ӣi 9,6 gam bб»ҷt S rб»“i nung trong Д‘iб»Ғu kiб»Үn khГҙng cГі khГҙng khГӯ Д‘бәҝn khi phбәЈn б»©ng hoГ n toГ n, thu Д‘Ж°б»Јc chбәҘt rбәҜn X. HoГ tan X bбәұng dung dб»Ӣch H2SO4 loГЈng dЖ° thu Д‘Ж°б»Јc khГӯ Y. Дҗб»‘t chГЎy hoГ n toГ n Y cбә§n V lГӯt O2 (Д‘ktc). GiГЎ trб»Ӣ của V lГ .
A. 8,96. B. 11,20. C. 13,44. D. 15,68.
0019: Cho cГЎc phГЎt biб»ғu sau:
(1): Khi thu khГӯ oxi bбәұng phЖ°ЖЎng phГЎp Д‘бә©y khГҙng khГӯ, ta phбәЈi Д‘бә·t miб»Үng bГ¬nh Гәp xuб»‘ng
(2): CГЎc phбәЈn б»©ng hГіa hб»Қc cГі lЖ°u huб»іnh tham gia Д‘б»Ғu phбәЈi Д‘un nГіng
(3): Ozon cГі tГӯnh oxi hГіa mбәЎnh hЖЎn oxi vГ¬ ozon dб»… bб»Ӣ phГўn hủy sinh ra oxi nguyГӘn tб»ӯ
(4): Ozon dб»… tan trong nЖ°б»ӣc hЖЎn so vб»ӣi oxi do phГўn tб»ӯ ozon kГ©m phГўn cб»ұc hЖЎn oxi
(5): Oxi phбәЈn б»©ng vб»ӣi hбә§u hбәҝt cГЎc phi kim, trб»« nhГіm halogen
Sб»‘ phГЎt biб»ғu Д‘Гәng lГ .
A. 3. B. 2. C. 5. D. 4.
0020: HГІa tan 12,8 gam Cu trong axit H2SO4 Д‘бә·c, nГіng dЖ°. Thб»ғ tГӯch khГӯ SO2 thu Д‘Ж°б»Јc (Д‘ktc) lГ
A. 4,48 lГӯt. B. 2,24 lГӯt. C. 6,72 lГӯt. D. 8,96 lГӯt.
0021: Tб»‘c Д‘б»ҷ phбәЈn б»©ng lГ :
A. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
B. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
C. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng hoбә·c sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
D. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của cГЎc chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
0022: Trong hб»Ү phбәЈn б»©ng б»ҹ trбәЎng thГЎi cГўn bбәұng: 2SO2 (k) + O2 (k) \(\rightleftarrows \) 2SO3 (k) (\(\Delta \)H<0)
Nб»“ng Д‘б»ҷ của SO3 sбәҪ tДғng, nбәҝu :
A. giбәЈm nб»“ng Д‘б»ҷ của SO2. B. tДғng nб»“ng Д‘б»ҷ của SO2.
C. tДғng nhiб»Үt Д‘б»ҷ. D. giбәЈm nб»“ng Д‘б»ҷ của O2.
0023: б»һ nhiб»Үt Д‘б»ҷ khГҙng Д‘б»•i, hб»Ү cГўn bбәұng sбәҪ dб»Ӣch chuyб»ғn vб»Ғ bГӘn phбәЈi nбәҝu tДғng ГЎp suбәҘt
A. 2H2(k) + O2(k) \(\rightleftarrows \) 2H2O(k).
B. 2SO3(k) \(\rightleftarrows \) 2SO2(k) + O2(k)
C. 2NO(k) \(\rightleftarrows \) N2(k) + O2(k)
D. 2CO2(k) \(\rightleftarrows \) 2CO(k) + O2(k)
0024: Khi bбәҜt Д‘бә§u phбәЈn б»©ng, nб»“ng Д‘б»ҷ mб»ҷt chбәҘt lГ 0,024 mol/l . Sau 10 giГўy xбәЈy ra phбәЈn б»©ng, nб»“ng Д‘б»ҷ của chбәҘt Д‘Гі lГ 0,022 mol/l. Tб»‘c Д‘б»ҷ phбәЈn б»©ng trong trЖ°б»қng hб»Јp nГ y lГ :
A. 0,0003 mol/l.s. B. 0,00025 mol/l.s. C. 0,00015 mol/l.s. D. 0,0002 mol/l.s.
II. Tб»ұ luбәӯn
CГўu 1: (1Д‘) HoГ n thГ nh cГЎc phЖ°ЖЎng trГ¬nh phбәЈn б»©ng sau:
a) \(\overset{{}}{\mathop{\text{Fe}}}\,+\overset{{}}{\mathop{\text{S}}}\,\xrightarrow{{{t}^{o}}}\)
b) \(\overset{{}}{\mathop{\text{S}}}\,+{{\overset{{}}{\mathop{\text{O}}}\,}_{2}}\xrightarrow{{{t}^{o}}}\)
CГўu 2: 11,2 lit (Д‘kc) hб»—n hб»Јp khГӯ A gб»“m clo vГ oxi tГЎc dб»Ҙng hбәҝt vб»ӣi 16,98 gam hб»—n hб»Јp B gб»“m Mg vГ Al tбәЎo ra 42,34 gam hб»—n hб»Јp G gб»“m clorua vГ oxit của 2 kim loбәЎi. TГӯnh thГ nh phбә§n phбә§n trДғm vб»Ғ thб»ғ tГӯch của tб»«ng chбәҘt trong hб»—n hб»Јp A? thГ nh phбә§n phбә§n trДғm vб»Ғ khб»‘i lЖ°б»Јng của tб»«ng chбәҘt trong hб»—n hб»Јp B?
---(Дҗб»ғ xem tiбәҝp nб»ҷi dung Д‘ГЎp ГЎn của Д‘б»Ғ thi sб»‘ 3 cГЎc em vui lГІng xem Online hoбә·c ДҗДғng nhбәӯp vГ o HOC247 Д‘б»ғ tбәЈi vб»Ғ mГЎy)---
Дҗб»Җ THI Sб»җ 4
Дҗб»Җ THI HK2 MГ”N HOГҒ Hб»ҢC 10 NДӮM 2022 TRЖҜб»ңNG THPT PHAN NGб»ҢC HIб»ӮN- Дҗб»Җ Sб»җ 4
I. TrбәҜc nghiб»Үm
CГўu 1: Cho cГЎc phбәЈn б»©ng:
(1) SiO2 + dung dб»Ӣch HF вҶ’
(2) F2 + H2O \(\xrightarrow{{{t}^{o}}}\)
(3) AgBr\(\xrightarrow{as}\)
(4) Br2 + NaI (dЖ°) вҶ’
Trong cГЎc phбәЈn б»©ng trГӘn, nhб»Ҝng phбәЈn б»©ng cГі tбәЎo ra Д‘ЖЎn chбәҘt lГ
A. (1), (3), (4). B. (1), (2), (3). C. (2), (3), (4). D. (1), (2), (4).
CГўu 2: Cho cГЎc phГЎt biб»ғu sau:
(1): Khi thu khГӯ oxi bбәұng phЖ°ЖЎng phГЎp Д‘бә©y khГҙng khГӯ, ta phбәЈi Д‘бә·t miб»Үng bГ¬nh Гәp xuб»‘ng
(2): CГЎc phбәЈn б»©ng hГіa hб»Қc cГі lЖ°u huб»іnh tham gia Д‘б»Ғu phбәЈi Д‘un nГіng
(3): Ozon cГі tГӯnh oxi hГіa mбәЎnh hЖЎn oxi vГ¬ ozon dб»… bб»Ӣ phГўn hủy sinh ra oxi nguyГӘn tб»ӯ
(4): Ozon dб»… tan trong nЖ°б»ӣc hЖЎn so vб»ӣi oxi do phГўn tб»ӯ ozon kГ©m phГўn cб»ұc hЖЎn oxi
(5): Oxi phбәЈn б»©ng vб»ӣi hбә§u hбәҝt cГЎc phi kim, trб»« nhГіm halogen
Sб»‘ phГЎt biб»ғu Д‘Гәng lГ .
A. 4. B. 3. C. 5. D. 2.
CГўu 3: CГі mб»ҷt hб»—n hб»Јp khГӯ gб»“m oxi vГ ozon. Hб»—n hб»Јp khГӯ nГ y cГі tб»ү khб»‘i so vб»ӣi H2 lГ 18. ThГ nh phбә§n phбә§n trДғm theo thб»ғ tГӯch của oxi vГ ozon trong hб»—n hб»Јp khГӯ lбә§n lЖ°б»Јt lГ
A. 60% vГ 40%. B. 75% vГ 25%. C. 25% vГ 75%. D. 80% vГ 20%.
CГўu 4: Cho 0,448 lГӯt Clo (Д‘ktc) vГ o dung dб»Ӣch NaX dЖ°, Д‘Ж°б»Јc 5,08 gam X2. NguyГӘn tб»‘ X lГ :
A. Br. B. I. C. F. D. Cl.
CГўu 5: б»һ nhiб»Үt Д‘б»ҷ khГҙng Д‘б»•i, hб»Ү cГўn bбәұng sбәҪ dб»Ӣch chuyб»ғn vб»Ғ bГӘn phбәЈi nбәҝu tДғng ГЎp suбәҘt
A. 2H2(k) + O2(k) \(\rightleftarrows \) 2H2O(k).
B. 2CO2(k) \(\rightleftarrows \) 2CO(k) + O2(k)
C. 2NO(k) \(\rightleftarrows \) N2(k) + O2(k)
D. 2SO3(k) \(\rightleftarrows \) 2SO2(k) + O2(k)
CГўu 6: Tб»‘c Д‘б»ҷ phбәЈn б»©ng lГ :
A. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
B. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của cГЎc chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
C. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
D. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng hoбә·c sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
CГўu 7: Дҗiб»Ғn tб»« thГӯch hб»Јp vГ o chб»— trб»‘ng trong Д‘oбәЎn vДғn bбәЈn sau:
Oxi trong khГҙng khГӯ lГ sбәЈn phбә©m của quГЎ trГ¬nh вҖҰ(1). CГўy xanh lГ nhГ mГЎy sбәЈn xuбәҘt cacbohiД‘rat vГ oxi tб»« cacbon Д‘ioxit vГ nЖ°б»ӣc dЖ°б»ӣi tГЎc dб»Ҙng của вҖҰ(2)вҖҰ mбә·t trб»қi. Nhб»қ sб»ұ quang hб»Јp của cГўy xanh mГ lЖ°б»Јng khГӯ oxi trong khГҙng khГӯ hбә§u nhЖ° вҖҰ(3).
A. (1) quang hб»Јp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
B. (1) hГҙ hбәҘp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
C. (1) quang hб»Јp, (2) nhiб»Үt, (3) thay Д‘б»•i.
D. (1) hГҙ hбәҘp, (2) nДғng lЖ°б»Јng, (3) thay Д‘б»•i.
CГўu 8: Cho hб»—n hб»Јp X gб»“m Fe(56) vГ Mg(24) vГ o dung dб»Ӣch HCl vб»«a đủ thГ¬ Д‘Ж°б»Јc 0,224lГӯt hydro(Д‘ktc). Mбә·t khГЎc A tГЎc dб»Ҙng vб»«a đủ vб»ӣi 0,28lГӯt clo (Д‘ktc). ThГ nh phбә§n % khб»‘i lЖ°б»Јng Mg trong X lГ :
A. 70%. B. 30%. C. 43%. D. 57%.
CГўu 9: Trong hб»Ү phбәЈn б»©ng б»ҹ trбәЎng thГЎi cГўn bбәұng: 2SO2 (k) + O2 (k) \(\rightleftarrows \) 2SO3 (k) (\(\Delta \)H<0)
Nб»“ng Д‘б»ҷ của SO3 sбәҪ tДғng, nбәҝu :
A. tДғng nб»“ng Д‘б»ҷ của SO2.
B. tДғng nhiб»Үt Д‘б»ҷ.
C. giбәЈm nб»“ng Д‘б»ҷ của O2.
D. giбәЈm nб»“ng Д‘б»ҷ của SO2.
CГўu 10: CГЎc sб»‘ oxi hГіa cГі thб»ғ cГі của lЖ°u huб»іnh lГ
A. 0; +4; +6. B. - 2; 0; +4; +6. C. - 2; +4: +6. D. 0; +2; +4;+6.
CГўu 11: PhбәЈn б»©ng Д‘iб»Ғu chбәҝ khГӯ clo trong phГІng thГӯ nghiб»Үm lГ :
A. 2NaCl 2Na + Cl2 .
B. F2 + 2NaCl 2NaF + Cl2 .
C. 4HCl + MnO2 MnCl2 + 2H2O + Cl2 .
D. 2HCl H2 + Cl2.
CГўu 12: Khi nung nГіng, iot biбәҝn thГ nh hЖЎi khГҙng qua trбәЎng thГЎi lб»Ҹng. Hiб»Үn tЖ°б»Јng nГ y Д‘Ж°б»Јc gб»Қi lГ
A. sб»ұ chuyб»ғn trбәЎng thГЎi. B. sб»ұ phГўn hủy.
C. sб»ұ bay hЖЎi. D. sб»ұ thДғng hoa.
CГўu 13: HГІa tan 12,8 gam Cu trong axit H2SO4 Д‘бә·c, nГіng dЖ°. Thб»ғ tГӯch khГӯ SO2 thu Д‘Ж°б»Јc (Д‘ktc) lГ
A. 4,48 lГӯt. B. 8,96 lГӯt. C. 2,24 lГӯt. D. 6,72 lГӯt.
CГўu 14: Lб»ӣp ozon б»ҹ tбә§ng bГ¬nh lЖ°u của khГӯ quyб»ғn lГ tбәҘm lГЎ chбәҜn tia tб»ӯ ngoбәЎi của Mбә·t trб»қi, bбәЈo vб»Ү sб»ұ sб»‘ng trГӘn TrГЎi Д‘бәҘt. Hiб»Үn tЖ°б»Јng suy giбәЈm tбә§ng ozon Д‘ang lГ mб»ҷt vбәҘn Д‘б»Ғ mГҙi trЖ°б»қng toГ n cбә§u. NguyГӘn nhГўn của hiб»Үn tЖ°б»Јng nГ y lГ do
A. chбәҘt thбәЈi CFC.
B. cГЎc hб»Јp chбәҘt hб»Ҝu cЖЎ trong tб»ұ nhiГӘn.
C. sб»ұ thay Д‘б»•i của khГӯ hбәӯu.
D. chбәҘt thбәЈi CO2.
CГўu 15: Trб»ҷn 22,4 gam bб»ҷt Fe vб»ӣi 9,6 gam bб»ҷt S rб»“i nung trong Д‘iб»Ғu kiб»Үn khГҙng cГі khГҙng khГӯ Д‘бәҝn khi phбәЈn б»©ng hoГ n toГ n, thu Д‘Ж°б»Јc chбәҘt rбәҜn X. HoГ tan X bбәұng dung dб»Ӣch H2SO4 loГЈng dЖ° thu Д‘Ж°б»Јc khГӯ Y. Дҗб»‘t chГЎy hoГ n toГ n Y cбә§n V lГӯt O2 (Д‘ktc). GiГЎ trб»Ӣ của V lГ .
A. 15,68. B. 8,96. C. 13,44. D. 11,20.
CГўu 16: NgЖ°б»қi ta phбәЈi bЖЎm, sб»Ҙc khГҙng khГӯ vГ o cГЎc bб»ғ nuГҙi cГЎ cбәЈnh.Trong bб»ғ cГЎ, ngЖ°б»қi ta lбәҜp thГӘm mГЎy sб»Ҙc khГӯ lГ Д‘б»ғ
A. cung cбәҘp thГӘm oxi cho cГЎ. B. cung cбәҘp thГӘm cacbon Д‘ioxit.
C. chб»ү Д‘б»ғ lГ m Д‘бә№p. D. cung cбәҘp thГӘm nitЖЎ cho cГЎ.
CГўu 17: ChбәҘt Дғn mГІn thủy tinh lГ :
A. F2. B. KF. C. HF. D. HI.
CГўu 18: Cho 0,5 mol KOH tГЎc dб»Ҙng vб»ӣi 0,5mol HCl.Cho quГ¬ tГӯm vГ o dung dб»Ӣch sau phбәЈn б»©ng, quГ¬ tГӯm chuyб»ғn sang mГ u:
A. xanh. B. khГҙng Д‘б»•i mГ u. C. hб»“ng. D. Д‘б»Ҹ.
CГўu 19: Khi bбәҜt Д‘бә§u phбәЈn б»©ng, nб»“ng Д‘б»ҷ mб»ҷt chбәҘt lГ 0,024 mol/l . Sau 10 giГўy xбәЈy ra phбәЈn б»©ng, nб»“ng Д‘б»ҷ của chбәҘt Д‘Гі lГ 0,022 mol/l. Tб»‘c Д‘б»ҷ phбәЈn б»©ng trong trЖ°б»қng hб»Јp nГ y lГ :
A. 0,00015 mol/l.s. B. 0,00025 mol/l.s. C. 0,0003 mol/l.s. D. 0,0002 mol/l.s.
CГўu 20: Дҗб»ғ phГўn biб»Үt O2 vГ O3, ngЖ°б»қi ta thЖ°б»қng dГ№ng thuб»‘c thб»ӯ lГ
A. dung dб»Ӣch H2SO4. B. dung dб»Ӣch CuSO4.
C. nЖ°б»ӣc. D. dung dб»Ӣch KI vГ hб»“ tinh bб»ҷt.
CГўu 21: DГЈy gб»“m cГЎc chбәҘt Д‘б»Ғu tГЎc dб»Ҙng vб»ӣi oxi lГ
A. H2, Fe, Cl2. B. Na, H2S, Pt. C. Mg, C, Al. D. CO, Au, S.
CГўu 22: Trong phГІng thГӯ nghiб»Үm khГӯ oxi cГі thб»ғ Д‘Ж°б»Јc Д‘iб»Ғu chбәҝ bбәұng cГЎch nhiб»Үt phГўn muб»‘i KClO3 cГі MnO2 lГ m xГәc tГЎc vГ cГі thб»ғ Д‘Ж°б»Јc thu bбәұng cГЎch Д‘бә©y nЖ°б»ӣc hay Д‘бә©y khГҙng khГӯ

Trong cГЎc hГ¬nh vбәҪ cho б»ҹ trГӘn, hГ¬nh vбәҪ mГҙ tбәЈ Д‘iб»Ғu chбәҝ vГ thu khГӯ oxi Д‘Гәng cГЎch lГ
A. 1 vГ 2. B. 1 vГ 3. C. 2 vГ 3. D. 3 vГ 4.
CГўu 23: Sб»Ҙc tб»« tб»« 2,24 lit SO2 (Д‘kc) vГ o 100 ml dung dб»Ӣch NaOH 3M. CГЎc chбәҘt cГі trong dung dб»Ӣch sau phбәЈn б»©ng?
A. Na2SO3, H2O. B. Na2SO3, NaHSO3, H2O.
C. Na2SO3, NaOH, H2O. D. NaHSO3,H2O.
CГўu 24: Chia mГҙМЈt dung diМЈch nЖ°ЖЎМҒc brom coМҒ maМҖu vaМҖng laМҖm 2 phГўМҖn:
- DГўМғn khiМҒ X khГҙng maМҖu vaМҖo phГўМҖn 1 thiМҖ dung diМЈch mГўМҒt maМҖu
- DГўМғn khiМҒ Y khГҙng maМҖu vaМҖo phГўМҖn 2 thiМҖ dung diМЈch sГўМғm maМҖu hЖЎn.
KhiМҒ X vaМҖ Y coМҒ thГӘМү lГўМҖn lЖ°ЖЎМЈt laМҖ:
A. SO2 vaМҖ CO2. B. SO2 vaМҖ Cl2. C. N2 vaМҖ CO2. D. SO2 vaМҖ HI.
II. Tб»ұ luбәӯn
CГўu 1: (1Д‘) HoГ n thГ nh cГЎc phЖ°ЖЎng trГ¬nh phбәЈn б»©ng sau:
a) \(\overset{{}}{\mathop{\text{Fe}}}\,+\overset{{}}{\mathop{\text{S}}}\,\xrightarrow{{{t}^{o}}}\)
b) \(\overset{{}}{\mathop{\text{S}}}\,+{{\overset{{}}{\mathop{\text{O}}}\,}_{2}}\xrightarrow{{{t}^{o}}}\)
CГўu 2: (3 Д‘iб»ғm) 11,2 lit (Д‘kc) hб»—n hб»Јp khГӯ A gб»“m clo vГ oxi tГЎc dб»Ҙng hбәҝt vб»ӣi 16,98 gam hб»—n hб»Јp B gб»“m Mg vГ Al tбәЎo ra 42,34 gam hб»—n hб»Јp G gб»“m clorua vГ oxit của 2 kim loбәЎi. TГӯnh thГ nh phбә§n phбә§n trДғm vб»Ғ thб»ғ tГӯch của tб»«ng chбәҘt trong hб»—n hб»Јp A? thГ nh phбә§n phбә§n trДғm vб»Ғ khб»‘i lЖ°б»Јng của tб»«ng chбәҘt trong hб»—n hб»Јp B?
ДҗГҒP ГҒN Дҗб»Җ THI Sб»җ 4
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
C |
D |
B |
B |
A |
D |
A |
B |
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
A |
B |
C |
D |
A |
A |
C |
A |
|
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
C |
B |
D |
D |
C |
B |
C |
D |
---(Дҗб»ғ xem tiбәҝp nб»ҷi dung Д‘ГЎp ГЎn phбә§n tб»ұ luбәӯn của Д‘б»Ғ thi sб»‘ 4 cГЎc em vui lГІng xem Online hoбә·c ДҗДғng nhбәӯp vГ o HOC247 Д‘б»ғ tбәЈi vб»Ғ mГЎy)---
Дҗб»Җ THI Sб»җ 5
Дҗб»Җ THI HK2 MГ”N HOГҒ Hб»ҢC 10 NДӮM 2022 TRЖҜб»ңNG THPT PHAN NGб»ҢC HIб»ӮN- Дҗб»Җ Sб»җ 5
I. TrбәҜc nghiб»Үm:
CГўu 1: Tб»‘c Д‘б»ҷ phбәЈn б»©ng lГ :
A. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
B. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của cГЎc chбәҘt phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
C. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
D. Дҗб»ҷ biбәҝn thiГӘn nб»“ng Д‘б»ҷ của mб»ҷt chбәҘt phбәЈn б»©ng hoбә·c sбәЈn phбә©m phбәЈn б»©ng trong mб»ҷt Д‘ЖЎn vб»Ӣ thб»қi gian.
CГўu 2: Khi bбәҜt Д‘бә§u phбәЈn б»©ng, nб»“ng Д‘б»ҷ mб»ҷt chбәҘt lГ 0,024 mol/l . Sau 10 giГўy xбәЈy ra phбәЈn б»©ng, nб»“ng Д‘б»ҷ của chбәҘt Д‘Гі lГ 0,022 mol/l. Tб»‘c Д‘б»ҷ phбәЈn б»©ng trong trЖ°б»қng hб»Јp nГ y lГ :
A. 0,00015 mol/l.s.
B. 0,00025 mol/l.s.
C. 0,0003 mol/l.s.
D. 0,0002 mol/l.s.
CГўu 3: Chia mГҙМЈt dung diМЈch nЖ°ЖЎМҒc brom coМҒ maМҖu vaМҖng laМҖm 2 phГўМҖn:
- DГўМғn khiМҒ X khГҙng maМҖu vaМҖo phГўМҖn 1 thiМҖ dung diМЈch mГўМҒt maМҖu
- DГўМғn khiМҒ Y khГҙng maМҖu vaМҖo phГўМҖn 2 thiМҖ dung diМЈch sГўМғm maМҖu hЖЎn.
KhiМҒ X vaМҖ Y coМҒ thГӘМү lГўМҖn lЖ°ЖЎМЈt laМҖ:
A. N2 vaМҖ CO2. B. SO2 vaМҖ CO2. C. SO2 vaМҖ Cl2. D. SO2 vaМҖ HI.
CГўu 4: Cho 0,448 lГӯt Clo (Д‘ktc) vГ o dung dб»Ӣch NaX dЖ°, Д‘Ж°б»Јc 5,08 gam X2. NguyГӘn tб»‘ X lГ :
A. Br. B. I. C. Cl. D. F.
CГўu 5: Trб»ҷn 22,4 gam bб»ҷt Fe vб»ӣi 9,6 gam bб»ҷt S rб»“i nung trong Д‘iб»Ғu kiб»Үn khГҙng cГі khГҙng khГӯ Д‘бәҝn khi phбәЈn б»©ng hoГ n toГ n, thu Д‘Ж°б»Јc chбәҘt rбәҜn X. HoГ tan X bбәұng dung dб»Ӣch H2SO4 loГЈng dЖ° thu Д‘Ж°б»Јc khГӯ Y. Дҗб»‘t chГЎy hoГ n toГ n Y cбә§n V lГӯt O2 (Д‘ktc). GiГЎ trб»Ӣ của V lГ .
A. 15,68. B. 8,96. C. 13,44. D. 11,20.
CГўu 6: Cho hб»—n hб»Јp X gб»“m Fe(56) vГ Mg(24) vГ o dung dб»Ӣch HCl vб»«a đủ thГ¬ Д‘Ж°б»Јc 0,224lГӯt hydro(Д‘ktc). Mбә·t khГЎc A tГЎc dб»Ҙng vб»«a đủ vб»ӣi 0,28lГӯt clo (Д‘ktc). ThГ nh phбә§n % khб»‘i lЖ°б»Јng Mg trong X lГ :
A. 43%. B. 57%. C. 30%. D. 70%.
CГўu 7: Sб»Ҙc tб»« tб»« 2,24 lit SO2 (Д‘kc) vГ o 100 ml dung dб»Ӣch NaOH 3M. CГЎc chбәҘt cГі trong dung dб»Ӣch sau phбәЈn б»©ng?
A. Na2SO3, H2O.
B. Na2SO3, NaHSO3, H2O.
C. Na2SO3, NaOH, H2O.
D. NaHSO3,H2O.
CГўu 8: Trong hб»Ү phбәЈn б»©ng б»ҹ trбәЎng thГЎi cГўn bбәұng: 2SO2 (k) + O2 (k) \(\rightleftarrows \) 2SO3 (k) (\(\Delta \)H<0)
Nб»“ng Д‘б»ҷ của SO3 sбәҪ tДғng, nбәҝu :
A. tДғng nhiб»Үt Д‘б»ҷ.
B. giбәЈm nб»“ng Д‘б»ҷ của SO2.
C. giбәЈm nб»“ng Д‘б»ҷ của O2.
D. tДғng nб»“ng Д‘б»ҷ của SO2.
CГўu 9: CГЎc sб»‘ oxi hГіa cГі thб»ғ cГі của lЖ°u huб»іnh lГ
A. - 2; +4: +6.
B. - 2; 0; +4; +6.
C. 0; +2; +4;+6.
D. 0; +4; +6.
CГўu 10: Cho cГЎc phГЎt biб»ғu sau:
(1): Khi thu khГӯ oxi bбәұng phЖ°ЖЎng phГЎp Д‘бә©y khГҙng khГӯ, ta phбәЈi Д‘бә·t miб»Үng bГ¬nh Гәp xuб»‘ng
(2): CГЎc phбәЈn б»©ng hГіa hб»Қc cГі lЖ°u huб»іnh tham gia Д‘б»Ғu phбәЈi Д‘un nГіng
(3): Ozon cГі tГӯnh oxi hГіa mбәЎnh hЖЎn oxi vГ¬ ozon dб»… bб»Ӣ phГўn hủy sinh ra oxi nguyГӘn tб»ӯ
(4): Ozon dб»… tan trong nЖ°б»ӣc hЖЎn so vб»ӣi oxi do phГўn tб»ӯ ozon kГ©m phГўn cб»ұc hЖЎn oxi
(5): Oxi phбәЈn б»©ng vб»ӣi hбә§u hбәҝt cГЎc phi kim, trб»« nhГіm halogen
Sб»‘ phГЎt biб»ғu Д‘Гәng lГ .
A. 2. B. 3. C. 4. D. 5.
CГўu 11: Trong phГІng thГӯ nghiб»Үm khГӯ oxi cГі thб»ғ Д‘Ж°б»Јc Д‘iб»Ғu chбәҝ bбәұng cГЎch nhiб»Үt phГўn muб»‘i KClO3 cГі MnO2 lГ m xГәc tГЎc vГ cГі thб»ғ Д‘Ж°б»Јc thu bбәұng cГЎch Д‘бә©y nЖ°б»ӣc hay Д‘бә©y khГҙng khГӯ
.jpg)
Trong cГЎc hГ¬nh vбәҪ cho б»ҹ trГӘn, hГ¬nh vбәҪ mГҙ tбәЈ Д‘iб»Ғu chбәҝ vГ thu khГӯ oxi Д‘Гәng cГЎch lГ
A. 1 vГ 2.
B. 1 vГ 3.
C. 2 vГ 3.
D. 3 vГ 4.
CГўu 12: CГі mб»ҷt hб»—n hб»Јp khГӯ gб»“m oxi vГ ozon. Hб»—n hб»Јp khГӯ nГ y cГі tб»ү khб»‘i so vб»ӣi H2 lГ 18. ThГ nh phбә§n phбә§n trДғm theo thб»ғ tГӯch của oxi vГ ozon trong hб»—n hб»Јp khГӯ lбә§n lЖ°б»Јt lГ
A. 60% vГ 40%.
B. 75% vГ 25%.
C. 25% vГ 75%.
D. 80% vГ 20%.
CГўu 13: HГІa tan 12,8 gam Cu trong axit H2SO4 Д‘бә·c, nГіng dЖ°. Thб»ғ tГӯch khГӯ SO2 thu Д‘Ж°б»Јc (Д‘ktc) lГ
A. 4,48 lГӯt. B. 8,96 lГӯt. C. 2,24 lГӯt. D. 6,72 lГӯt.
CГўu 14: б»һ nhiб»Үt Д‘б»ҷ khГҙng Д‘б»•i, hб»Ү cГўn bбәұng sбәҪ dб»Ӣch chuyб»ғn vб»Ғ bГӘn phбәЈi nбәҝu tДғng ГЎp suбәҘt
A. 2H2(k) + O2(k) \(\rightleftarrows \) 2H2O(k).
B. 2SO3(k) \(\rightleftarrows \) 2SO2(k) + O2(k)
C. 2NO(k) \(\rightleftarrows \) N2(k) + O2(k)
D. 2CO2(k) \(\rightleftarrows \) 2CO(k) + O2(k)
CГўu 15: Khi nung nГіng, iot biбәҝn thГ nh hЖЎi khГҙng qua trбәЎng thГЎi lб»Ҹng. Hiб»Үn tЖ°б»Јng nГ y Д‘Ж°б»Јc gб»Қi lГ
A. sб»ұ bay hЖЎi.
B. sб»ұ thДғng hoa.
C. sб»ұ chuyб»ғn trбәЎng thГЎi.
D. sб»ұ phГўn hủy.
CГўu 16: ChбәҘt Дғn mГІn thủy tinh lГ :
A. F2. B. KF. C. HF. D. HI.
CГўu 17: Cho 0,5 mol KOH tГЎc dб»Ҙng vб»ӣi 0,5mol HCl.Cho quГ¬ tГӯm vГ o dung dб»Ӣch sau phбәЈn б»©ng, quГ¬ tГӯm chuyб»ғn sang mГ u:
A. xanh. B. Д‘б»Ҹ. C. hб»“ng. D. khГҙng Д‘б»•i mГ u.
CГўu 18: Дҗб»ғ phГўn biб»Үt O2 vГ O3, ngЖ°б»қi ta thЖ°б»қng dГ№ng thuб»‘c thб»ӯ lГ
A. dung dб»Ӣch H2SO4. B. dung dб»Ӣch CuSO4.
C. nЖ°б»ӣc. D. dung dб»Ӣch KI vГ hб»“ tinh bб»ҷt.
CГўu 19: Cho cГЎc phбәЈn б»©ng:
(1) SiO2 + dung dб»Ӣch HF вҶ’
(2) F2 + H2O \(\xrightarrow{{{t}^{o}}}\)
(3) AgBr\(\xrightarrow{as}\)
(4) Br2 + NaI (dЖ°) вҶ’
Trong cГЎc phбәЈn б»©ng trГӘn, nhб»Ҝng phбәЈn б»©ng cГі tбәЎo ra Д‘ЖЎn chбәҘt lГ
A. (2), (3), (4). B. (1), (2), (3). C. (1), (2), (4). D. (1), (3), (4).
CГўu 20: DГЈy gб»“m cГЎc chбәҘt Д‘б»Ғu tГЎc dб»Ҙng vб»ӣi oxi lГ
A. H2, Fe, Cl2. B. Na, H2S, Pt. C. Mg, C, Al. D. CO, Au, S.
CГўu 21: PhбәЈn б»©ng Д‘iб»Ғu chбәҝ khГӯ clo trong phГІng thГӯ nghiб»Үm lГ :
A. F2 + 2NaCl 2NaF + Cl2 .
B. 2NaCl 2Na + Cl2 .
C. 4HCl + MnO2 MnCl2 + 2H2O + Cl2 .
D. 2HCl H2 + Cl2.
CГўu 22: Дҗiб»Ғn tб»« thГӯch hб»Јp vГ o chб»— trб»‘ng trong Д‘oбәЎn vДғn bбәЈn sau:
Oxi trong khГҙng khГӯ lГ sбәЈn phбә©m của quГЎ trГ¬nh вҖҰ(1). CГўy xanh lГ nhГ mГЎy sбәЈn xuбәҘt cacbohiД‘rat vГ oxi tб»« cacbon Д‘ioxit vГ nЖ°б»ӣc dЖ°б»ӣi tГЎc dб»Ҙng của вҖҰ(2)вҖҰ mбә·t trб»қi. Nhб»қ sб»ұ quang hб»Јp của cГўy xanh mГ lЖ°б»Јng khГӯ oxi trong khГҙng khГӯ hбә§u nhЖ° вҖҰ(3).
A. (1) quang hб»Јp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
B. (1) quang hб»Јp, (2) nhiб»Үt, (3) thay Д‘б»•i.
C. (1) hГҙ hбәҘp, (2) ГЎnh sГЎng, (3) khГҙng Д‘б»•i.
D. (1) hГҙ hбәҘp, (2) nДғng lЖ°б»Јng, (3) thay Д‘б»•i.
CГўu 23: NgЖ°б»қi ta phбәЈi bЖЎm, sб»Ҙc khГҙng khГӯ vГ o cГЎc bб»ғ nuГҙi cГЎ cбәЈnh.Trong bб»ғ cГЎ, ngЖ°б»қi ta lбәҜp thГӘm mГЎy sб»Ҙc khГӯ lГ Д‘б»ғ
A. cung cбәҘp thГӘm oxi cho cГЎ.
B. cung cбәҘp thГӘm cacbon Д‘ioxit.
C. chб»ү Д‘б»ғ lГ m Д‘бә№p.
D. cung cбәҘp thГӘm nitЖЎ cho cГЎ.
CГўu 24: Lб»ӣp ozon б»ҹ tбә§ng bГ¬nh lЖ°u của khГӯ quyб»ғn lГ tбәҘm lГЎ chбәҜn tia tб»ӯ ngoбәЎi của Mбә·t trб»қi, bбәЈo vб»Ү sб»ұ sб»‘ng trГӘn TrГЎi Д‘бәҘt. Hiб»Үn tЖ°б»Јng suy giбәЈm tбә§ng ozon Д‘ang lГ mб»ҷt vбәҘn Д‘б»Ғ mГҙi trЖ°б»қng toГ n cбә§u. NguyГӘn nhГўn của hiб»Үn tЖ°б»Јng nГ y lГ do
A. cГЎc hб»Јp chбәҘt hб»Ҝu cЖЎ trong tб»ұ nhiГӘn.
B. chбәҘt thбәЈi CFC.
C. chбәҘt thбәЈi CO2.
D. sб»ұ thay Д‘б»•i của khГӯ hбәӯu.
II. Tб»ұ luбәӯn
CГўu 1: (1 Д‘iб»ғm) HoГ n thГ nh cГЎc phЖ°ЖЎng trГ¬nh phбәЈn б»©ng sau:
a )\(\overset{{}}{\mathop{\text{Fe}}}\,+\overset{{}}{\mathop{\text{S}}}\,\xrightarrow{{{t}^{o}}}\)
b) \(\overset{{}}{\mathop{\text{S}}}\,+{{\overset{{}}{\mathop{\text{O}}}\,}_{2}}\xrightarrow{{{t}^{o}}}\)
CГўu 2: 1,2 lit (Д‘kc) hб»—n hб»Јp khГӯ A gб»“m clo vГ oxi tГЎc dб»Ҙng hбәҝt vб»ӣi 16,98 gam hб»—n hб»Јp B gб»“m Mg vГ Al tбәЎo ra 42,34 gam hб»—n hб»Јp G gб»“m clorua vГ oxit của 2 kim loбәЎi. TГӯnh thГ nh phбә§n phбә§n trДғm vб»Ғ thб»ғ tГӯch của tб»«ng chбәҘt trong hб»—n hб»Јp A? thГ nh phбә§n phбә§n trДғm vб»Ғ khб»‘i lЖ°б»Јng của tб»«ng chбәҘt trong hб»—n hб»Јp B?
ДҗГҒP ГҒN Дҗб»Җ THI Sб»җ 5
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
D |
D |
D |
B |
C |
C |
C |
D |
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
B |
A |
B |
B |
A |
A |
B |
C |
|
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
D |
D |
A |
C |
C |
A |
A |
B |
---(Дҗб»ғ xem tiбәҝp nб»ҷi dung Д‘ГЎp ГЎn phбә§n tб»ұ luбәӯn của Д‘б»Ғ thi sб»‘ 5 cГЎc em vui lГІng xem Online hoбә·c ДҗДғng nhбәӯp vГ o HOC247 Д‘б»ғ tбәЈi vб»Ғ mГЎy)---
TrГӘn Д‘Гўy lГ trГӯch dбә«n mб»ҷt phбә§n nб»ҷi dung Bб»ҷ 5 Д‘б»Ғ thi HK2 mГҙn HГіa hб»Қc 10 nДғm 2021-2022 cГі Д‘ГЎp ГЎn TrЖ°б»қng THPT Phan Ngб»Қc Hiб»ғn. Дҗб»ғ xem toГ n bб»ҷ nб»ҷi dung cГЎc em Д‘Дғng nhбәӯp vГ o trang hoc247.net Д‘б»ғ tбәЈi tГ i liб»Үu vб»Ғ mГЎy tГӯnh.
Hy vб»Қng tГ i liб»Үu nГ y sбәҪ giГәp cГЎc em hб»Қc sinh Гҙn tбәӯp tб»‘t vГ Д‘бәЎt thГ nh tГӯch cao trong hб»Қc tбәӯp.
NgoГ i ra cГЎc em cГі thб»ғ tham khбәЈo thГӘm mб»ҷt sб»‘ tЖ° liб»Үu cГ№ng chuyГӘn mб»Ҙc tбәЎi Д‘Гўy:
Thi Online:
ChГәc cГЎc em hб»Қc tб»‘t!
TГ i liб»Үu liГӘn quan
TЖ° liб»Үu nб»•i bбәӯt tuбә§n
-
Дҗб»Ғ thi minh hб»Қa mГҙn ToГЎn tб»‘t nghiб»Үp THPT nДғm 2025
22/10/20241309 - Xem thГӘm





