Nội dung bài học Phương trình hoá học tìm hiểu về khái niệm, các bước lập phương trình hoá học; Ý nghĩa của phương trình hoá học: Cho biết các chất phản ứng và sản phẩm, tỉ lệ số phân tử, số nguyên tử giữa các chất trong phản ứng.
Tóm tắt lý thuyết
1.1. Lập phương trình hóa học
1.1.1. Phương trình hóa học
- Phương trình chữ của phản ứng: Hiđrô + Ôxi → Nước
- Sơ đồ phản ứng: H2 + O2 \(\dashrightarrow\) H2O
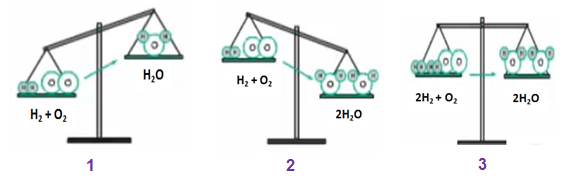
Hình 1: Minh họa cách lập phương trình hóa học
-
Ở hình 1: Nếu theo sơ đồ phản ứng H2 + O2 \(\dashrightarrow\) H2O thì
-
Vế trái: 2 nguyên tử H và 2 nguyên tử O
-
Vế phải: 2 nguyên tử H và 1 nguyên tử O
-
⇒ Vế trái sẽ có khối lượng nhiều hơn vì hơn 1 nguyên tử O
-
Ở hình 2: Vậy nếu vế trái nhiều hơn 1 nguyên tử O thì ta thêm hệ số 2 trước vế phải. Lúc này:
-
Vế trái: 2 nguyên tử H và 2 nguyên tử O
-
Vế phải: 4 nguyên tử H và 2 nguyên tử O
-
⇒ Vế phải có khối lượng nhiều hơn, do hơn 2 nguyên tử H
-
Ở hình 3: Ta thêm hệ số 2 vào trước H2 và H2O
-
Vế trái: 4 nguyên tử H và 2 nguyên tử O
-
Vế phải: 4 nguyên tử H và 2 nguyên tử O
-
⇒ Khối lượng của hai vế bằng nhau
-
Kết luận:
Phương trình hóa học: 2H2 + O2 → 2H2O
Phương trình hóa học dùng để biểu diễn ngắn gọn phản ứng hoá học. Gồm công thức hóa học và hệ số thích hợp của những chất tham gia và chất tạo thành.
1.1.2. Cách bước lập phương trình hóa học
- Các bước lập phương trình hóa học
- Bước 1: Viết sơ đồ phản ứng gồm công thức hóa học của các chất phản ứng và sản phẩm.
- Bước 2: Cân bằng số nguyên tử của các nguyên tố có trong phản ứng: Tìm hệ số thích hợp đặt trước các công thức.
- Bước 3: Viết phương trình hóa học.
- Chú ý:
- Không được thay đổi các chỉ số trong công thức hóa học đã viết đúng. Ví dụ như 3O2 (đúng) chuyển thành 6O (sai)
- Viết hệ số cao bằng kí hiệu hóa học: Ví dụ như 4Al, 2Mg (đúng). Không viết 4Al, 2Mg (sai)
- Trong các công thức hóa học có các nhóm nguyên tử như nhóm OH, SO4... Thì coi cả nhóm như một đơn vị để cân bằng, trước và sau phản ứng số nhóm nguyên tử phải bằng nhau.
1.2. Ý nghĩa của phương trình hóa học
- Phương trình hóa học cho biết: Tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
- Ví dụ: Phương trình phản ứng 4Al + 3O2
2Al2O3
- Tỉ lệ số nguyên tử Al : Số phân tử O2 : Số phân tử Al2O3 = 4 : 3 : 2
- Điều này được hiểu là: Cứ 4 nguyên tử Al tác dụng với 3 phân tử O2 tạo thành 2 phân tử Al2O3
1.3. Tổng kết
Hình 2: Tổng kết kiến thức về Phương trình hóa học
Bài tập minh họa
Bài 1:
Lập phương trình hóa học cho phản ứng giữa Natri cacbonat và Canxi hidroxit tạo thành sản phẩm là Canxi cacbonat và Natri hidroxit.
Hướng dẫn:
- Phương trình chữ của phản ứng là: Natri cacbonat + Canxi hidroxit → Canxi cacbonat + Natri hidroxit
- Sơ đồ phản ứng: Na2CO3 + Ca(OH)2 \(\dashrightarrow\) CaCO3 + NaOH
- Nhận xét:
- Vế trái: có 2 nguyên tử Na và 1 nhóm CO3 + 1 nguyên tử Ca và 2 nhóm OH
- Vế phải: có 1 nguyên tử Na và 1 nhóm CO3 + 1 nguyên tử Ca và 1 nhóm OH
- Như vậy: Ta thêm hệ số 2 trước Natri hidroxit thì sẽ cân bằng khối lượng của vế phải và vế trái
- Phương trình hóa học: Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
3. Luyện tập Bài 16 Hóa học 8
Sau bài học cần nắm:
- Kĩ năng lập phương trình hoá học khi biết các chất phản ứng (tham gia) và sản phẩm
- Xác định được ý nghĩa của một số phương trình hoá học cụ thể.
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 16 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. x = 4; y = 1
- B. x = 2; y = 3
- C. x = 1; y = 4
- D. x = 3; y = 2
-
- A. 2,6,2,3
- B. 2,6,3,2
- C. 2,6,3,3
- D. 6,3,2,3
-
Câu 3:
Cho PTHH: N2 + H2 \(\leftrightarrows\) NH3. Các hệ số đặt trước các phân tử N2, H2, NH3 lần lượt là:
- A. 1, 3, 2
- B. 1, 2, 3
- C. 2, 1, 3
- D. 3, 1, 2
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 16.
Bài tập 1 trang 58 SGK Hóa học 8
Bài tập 2 trang 58 SGK Hóa học 8
Bài tập 3 trang 58 SGK Hóa học 8
Bài tập 4 trang 58 SGK Hóa học 8
Bài tập 5 trang 58 SGK Hóa học 8
Bài tập 6 trang 58 SGK Hóa học 8
Bài tập 7 trang 58 SGK Hóa học 8
Bài tập 16.1 trang 21 SBT Hóa học 8
Bài tập 16.2 trang 22 SBT Hóa học 8
Bài tập 16.3 trang 22 SBT Hóa học 8
Bài tập 16.4 trang 22 SBT Hóa học 8
Bài tập 16.5 trang 22 SBT Hóa học 8
Bài tập 16.6 trang 22 SBT Hóa học 8
Bài tập 16.7 trang 22 SBT Hóa học 8
Bài tập 16.8 trang 22 SBT Hóa học 8
4. Hỏi đáp về Bài 16 chương 2 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.