Phản ứng hoá học là quá trình biến đổi chất này thành chất khác. Để xảy ra phản ứng hoá học, các chất phản ứng phải tiếp xúc với nhau, hoặc cần thêm nhiệt độ cao, áp suất cao hay chất xúc tác. Để nhận biết có phản ứng hoá học xảy ra, dựa vào một số dấu hiệu có chất mới tạo thành mà ta quan sát được như thay đổi màu sắc, tạo kết tủa, khí thoát ra… Cụ thể ta tìm hiểu trong bài giảng sau về Phản ứng hóa học.
Tóm tắt lý thuyết
1.1. Định nghĩa
- Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
- Chất ban đầu bị biến đổi trong phản ứng gọi là chất tham gia hay chất phản ứng.
- Chất mới sinh ra trong phản ứng gọi là sản phẩm.
- Phương trình chữ: Tên các chất phản ứng → Tên các sản phẩm
- Lưu ý:
-
Dấu "→" đọc là tạo thành (hay sinh ra)
-
Dấu " +" phía trước dấu "→" đọc là tác dụng với (hay phản ứng với, hóa hợp với).
-
Dấu " +" phía sau dấu "→" đọc là: và
-
- Ví dụ:
(1) Lưu huỳnh + oxi → lưu huỳnh đioxít
(chất tham gia) (sản phẩm )
⇒ Đọc là: Lưu huỳnh tác dụng với Oxi sinh ra lưu huỳnh đioxít
(2) Canxicacbonat .PNG)
(chất tham gia) (sản phẩm ) (sản phẩm )
⇒ Canxicacbonat sinh ra canxioxit và khí cacbonic
(3) Parafin + oxi .PNG)
(chất tham gia) (sản phẩm )
⇒ Parafin tác dụng với oxi tạo thành khí cacbonic và nước
- Trong phản ứng hóa học, các chất tham gia giảm dần, lượng sản phẩm tăng dần.
1.2. Diễn biến của phản ứng hóa học
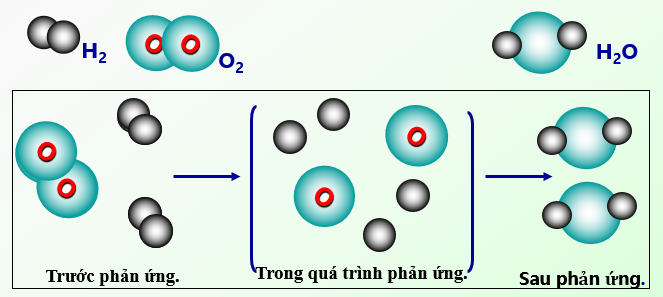
Hình 1: Sơ đồ tượng trưng cho phản ứng hóa học giữa khí Hidro và khí Oxi tạo thành nước
|
Trước phản ứng |
Trong quá trình phản ứng |
Sau phản ứng | |
|
Số phân tử |
Một phân tử Oxi, hai phân tử Hiđrô. |
Không có phân tử nào. |
Hai phân tử nước. |
|
Liên kết giữa các nguyên tử |
2 nguyên tử H liên kết với nhau, 2 nguyên tử O liên kết với nhau. |
Không có sự liên kết giữa các nguyên tử. |
2 nguyên tử H liên kết với 1 nguyên tử O. |
|
Số nguyên tử H, số nguyên tử O |
4 nguyên tử H, 2 nguyên tử O. |
4 nguyên tử H, 2 nguyên tử O. |
4 nguyên tử H, 2 nguyên tử O. |
- Kết luận: Trong các phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác.
- Lưu ý: Nếu có đơn chất kim loại tham gia phản ứng thì sau phản ứng nguyên tử kim loại phải liên kết với nguyên tử của nguyên tố khác.
1.3. Khi nào phản ứng hóa học xảy ra?
- Quan sát thí nghiệm sau:
Video 1: Phản ứng giữa kẽm và dung dịch axit clohodric HCl
-
Muốn phản ứng hóa học xảy ra: Các chất tham gia phản ứng phải tiếp xúc với nhau.
Ví dụ: đường cát dễ tan hơn so với đường phèn. Vì đường cát có diện tích tiếp xúc nhiều hơn đường phèn.
- 1 số phản ứng hóa học muốn xảy ra phải được đun nóng đến t0 thích hợp.
- Có những phản ứng muốn xảy ra cần có mặt của chất xúc tác.
Ví dụ: Quá trình chuyển hóa tinh bột sang rượu cần "men". Men lúc này đóng vai trò là chất xúc tác, giúp phản ứng xảy ra nhanh hơn, nhưng không biến đổi khi phản ứng kết thúc.
1.4. Làm thế nào để nhận biết có phản ứng hóa học xảy ra?
-
Dựa vào dấu hiệu có chất mới tạo thành, có tính chất khác chất phản ứng để nhận biết có phản ứng hóa học xảy ra hay không.
-
Dựa vào: màu sắc, trạng thái, tính tan, …
Ví dụ: Đường bị cháy đen, tạo thành Cacbon
-
Ngoài ra, sự toả nhiệt và phát sáng cũng có thể là dấu hiệu để xảy ra phản ứng hóa học.
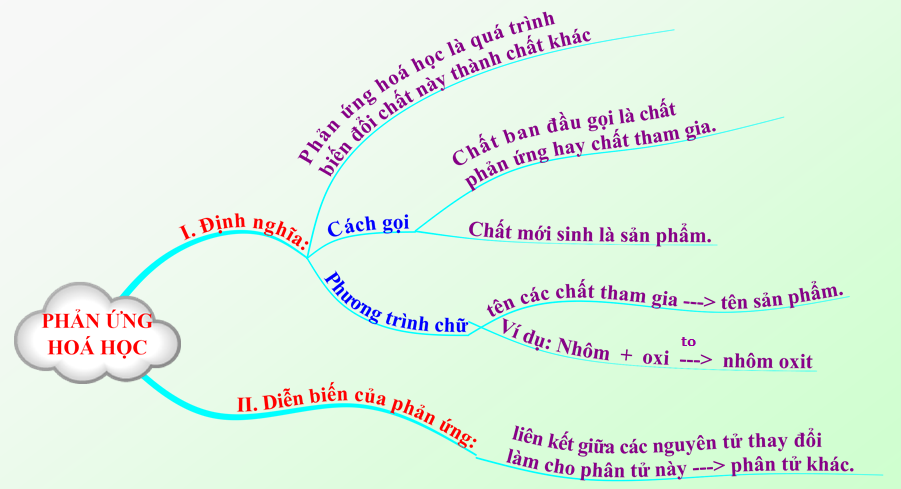
1.5. Tổng kết
Hình 2: Sơ đồ tư duy bài Phản ứng hóa học
Bài tập minh họa
Bài 1:
Viết phương trình chữ cho phản ứng hóa học sau: Đốt bột nhôm trong không khí, tạo ra nhôm oxit.
Xác định chất tham gia và sản phẩm tạo thành?
Hướng dẫn:
Phương trình chữ của phản ứng:
Nhôm + Khí oxi .PNG)
(Chất tham gia) (Sản phẩm)
Bài 2:
Đánh dấu X vào ô ứng với hiện tượng hoá học hay hiện tượng vật lí. Viết phương trình chữ của phản ứng hoá học ?
|
Các quá trình
|
Hiện tượng
|
Phương trình chữ của phản ứng hoá học |
|
| Vật lí | Hóa học | ||
| Dây sắt cắt nhỏ tán thành đinh sắt | X | ||
| Đốt bột sắt trong oxi tạo ra oxit sắt từ | X |
Sắt + oxi |
|
| Điện phân nước ta thu được khí hiđro và khí oxi | X |
Nước (Điện phân) → Khí Hidro +Khí oxi |
|
Bài 3:
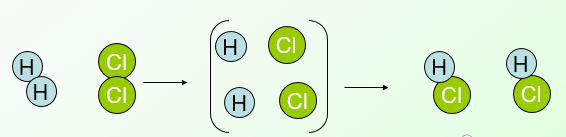
Hình dưới đây là sơ đồ tượng trưng cho phản ứng giữa khí Hiđrô H2 và khí Clo Cl2 tạo ra Axítclohiđríc HCl
Hãy cho biết.
a) Liên kết giữa những nguyên tử trong phân tử nào bị tách rời?
b) Phân tử nào được tạo ra?
Hướng dẫn:
a) Liên kết giữa những nguyên tử trong phân tử hiđrô và clo bị tách rời.
Bài 4:
Khi để ngọn lửa đến gần là cồn (rượu etylic) đã bắt cháy?
Biết rằng cồn cháy được là có sự tham gia của khí oxi, tao ra hơi nước và khí cacbonic. Viết phương trình chữ của phản ứng trên.
Hướng dẫn:
Phương trình chữ của phản ứng là:
Rượu etylic + Khí oxi .PNG)
3. Luyện tập Bài 13 Hóa học 8
Sau bài học cần nắm:
- Kĩ năng quan sát thí nghiệm, hình vẽ hoặc hình ảnh cụ thể, rút ra được nhận xét về phản ứng hoá học, điều kiện và dấu hiệu để nhận biết có phản ứng hoá học xảy ra
- Viết được phương trình hoá học bằng chữ để biểu diễn phản ứng hoá học
- Xác định được chất phản ứng (chất tham gia, chất ban đầu) và sản phẩm
3.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 8 Bài 13 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
- A. Số nguyên tử của mỗi nguyên tố.
- B. Số nguyên tố tạo nên chất.
- C. Số phân tử của mỗi chất.
- D. Số nguyên tử trong mỗi chất.
-
- A. Có ánh sáng phát ra.
- B. Có sinh nhiệt.
- C. Có chất mới tạo thành.
- D. Có chất không tan trong nước.
-
- A. Không thể thiếu chất xúc tác.
- B. Các chất phản ứng phải tiếp xúc nhau.
- C. Cần phải được đun nóng
- D. Cả 3 điều kiện trên
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 8 Bài 13.
Bài tập 1 trang 50 SGK Hóa học 8
Bài tập 2 trang 50 SGK Hóa học 8
Bài tập 3 trang 50 SGK Hóa học 8
Bài tập 4 trang 50 SGK Hóa học 8
Bài tập 5 trang 51 SGK Hóa học 8
Bài tập 6 trang 51 SGK Hóa học 8
Bài tập 13.1 trang 18 SBT Hóa học 8
Bài tập 13.2 trang 18 SBT Hóa học 8
Bài tập 13.3 trang 18 SBT Hóa học 8
Bài tập 13.4 trang 19 SBT Hóa học 8
Bài tập 13.5 trang 19 SBT Hóa học 8
Bài tập 13.6 trang 19 SBT Hóa học 8
Bài tập 13.7 trang 19 SBT Hóa học 8
Bài tập 13.8 trang 19 SBT Hóa học 8
4. Hỏi đáp về Bài 13 chương 2 Hóa học 8
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.