Hã░ß╗øng dß║½n giß║úi b├ái tß║¡p SGK Hi─æro sunfua - Lã░u huß╗│nh ─æioxit - Lã░u huß╗│nh trioxit Hi─æro sunfua - Lã░u huß╗│nh ─æioxit - Lã░u huß╗│nh trioxit gi├║p c├íc em hß╗ìc sinh biß║┐t T├¡nh chß║Ñt vß║¡t l├¡, trß║íng th├íi tß╗▒ nhi├¬n, t├¡nh oxit axit, ß╗®ng dß╗Ñng, phã░ãíng ph├íp ─æiß╗üu chß║┐ SO2, SO3. Nguy├¬n nh├ón t├¡nh khß╗¡ oxi h├│a, khß╗¡: SO2 (vß╗½a c├│ t├¡nh oxi h├│a, vß╗½a c├│ t├¡nh khß╗¡) v├á SO3 (chß╗ë c├│ t├¡nh oxi h├│a).
-
Bài tập 1 trang 138 SGK Hóa học 10
Lã░u huß╗│nh ─æioxit c├│ thß╗â tham gia nhß╗»ng phß║ún ß╗®ng sau:
SO2 + Br2 + 2H2O  2HBr + H2SO4 (1)
SO2 + 2H2S  3S + 2H2O (2)
C├óu n├áo sau ─æ├óy diß╗àn tß║ú kh├┤ng ─æ├║ng t├¡nh chß║Ñt cß╗ºa c├íc chß║Ñt trong nhß╗»ng phß║ún ß╗®ng tr├¬n?
A. Phß║ún ß╗®ng (1): SO2 l├á chß║Ñt khß╗¡, Br2 l├á chß║Ñt oxi h├│a.
B. Phß║ún ß╗®ng (2): SO2 l├á chß║Ñt oxi h├│a, H2S l├á chß║Ñt khß╗¡.
C. Phß║ún ß╗®ng (2): SO2 vß╗½a l├á chß║Ñt khß╗¡, vß╗½a l├á chß║Ñt oxi h├│a.
D. Phß║ún ß╗®ng (1): Br2 l├á chß║Ñt oxi h├│a, phß║ún ß╗®ng (2): H2S l├á chß║Ñt khß╗¡.
-
Bài tập 2 trang 138 SGK Hóa học 10
H├úy gh├®p cß║Àp chß║Ñt v├á t├¡nh chß║Ñt cß╗ºa chß║Ñt sao cho ph├╣ hß╗úp:
Các chất Tính chất của chất A. S a) Chỉ có tính oxi hóa B. SO2 b) Chỉ có tính khử C. H2S c) Có tính oxi hóa và tính khử D. H2SO4 d) Không có tính oxi hóa và tính khử -
Bài tập 3 trang 138 SGK Hóa học 10
Cho phß║ún ß╗®ng h├│a hß╗ìc:
H2S + 4Cl2 + 4H2O  H2SO4 + 8HCl
C├óu n├áo sau ─æ├óy diß╗àn tß║ú ─æ├║ng t├¡nh chß║Ñt c├íc chß║Ñt phß║ún ß╗®ng?
A. H2S là chất oxi hóa, Cl2 là chất khử.
B. H2S là chất khử, H2O là chất oxi hóa.
C. Cl2 là chất oxi hóa, H2O là chất khử.
D. Cl2 là chất oxi hóa, H2S là chất khử.
-
Bài tập 4 trang 138 SGK Hóa học 10
H├úy cho biß║┐t nhß╗»ng t├¡nh chß║Ñt h├│a hß╗ìc ─æß║Àc trã░ng cß╗ºa:
a) Hi─æro sunfua.
b) Lã░u huß╗│nh ─æioxit.
Dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â minh hß╗ìa.
- VIDEOYOMEDIA
-
Bài tập 5 trang 139 SGK Hóa học 10
Dß║½n kh├¡ SO2 v├áo dung dß╗ïch KMnO4 m├áu t├¡m nhß║¡n thß║Ñy dung dß╗ïch bß╗ï mß║Ñt m├áu, v├¼ xß║úy ra phß║ún ß╗®ng h├│a hß╗ìc sau:
SO2 + KMnO4 + H2O  K2SO4 + MnSO4 + H2SO4
a) H├úy c├ón bß║▒ng phã░ãíng tr├¼nh h├│a hß╗ìc tr├¬n bß║▒ng phã░ãíng ph├íp th─âng bß║▒ng electron.
b) H├úy cho biß║┐t vai tr├▓ cß╗ºa SO2 v├á KMnO4 trong c├íc trã░ß╗Øng hß╗úp tr├¬n.
-
Bài tập 6 trang 139 SGK Hóa học 10
a) Bß║▒ng phß║ún ß╗®ng h├│a hß╗ìc n├áo c├│ thß╗â chuyß╗ân h├│a lã░u huß╗│nh th├ánh lã░u huß╗│nh ─æioxit v├á ngã░ß╗úc lß║íi lã░u huß╗│nh ─æioxit th├ánh lã░u huß╗│nh?
b) Kh├¡ lã░u huß╗│nh ─æioxit l├á kh├¡ chß╗º yß║┐u g├óy mã░a axit. Mã░a axit ph├í hß╗ºy nhß╗»ng c├┤ng tr├¼nh ─æã░ß╗úc x├óy dß╗▒ng bß║▒ng ─æ├í, th├®p.
T├¡nh chß║Ñt n├áo cß╗ºa SO2 ─æ├ú hß╗ºy hoß║íi nhß╗»ng c├┤ng tr├¼nh n├áy? H├úy dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â chß╗®ng minh.
-
Bài tập 7 trang 139 SGK Hóa học 10
H├úy dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â chß╗®ng minh rß║▒ng lã░u huß╗│nh ─æioxit v├á lã░u huß╗│nh trioxit l├á nhß╗»ng oxit axit?
-
Bài tập 8 trang 139 SGK Hóa học 10
Cho hß╗ùn hß╗úp gß╗ôm Fe v├á FeS t├íc dß╗Ñng vß╗øi dung dß╗ïch HCl (dã░), thu ─æã░ß╗úc 2,464 l├¡t hß╗ùn hß╗úp kh├¡ (─æktc). Cho hß╗ùn hß╗úp kh├¡ n├áy ─æi qua dung dß╗ïch Pb(NO3)2 (dã░), thu ─æã░ß╗úc 23,9g kß║┐t tß╗ºa m├áu ─æen.
a) Viß║┐t c├íc phã░ãíng tr├¼nh h├│a hß╗ìc cß╗ºa phß║ún ß╗®ng ─æ├ú xß║úy ra.
b) Hß╗ùn hß╗úp kh├¡ thu ─æã░ß╗úc gß╗ôm nhß╗»ng kh├¡ n├áo? Thß╗â t├¡ch mß╗ùi kh├¡ l├á bao nhi├¬u (─æktc)?
c) T├¡nh khß╗æi lã░ß╗úng cß╗ºa Fe v├á FeS c├│ trong hß╗ùn hß╗úp ban ─æß║ºu?
-
Bài tập 9 trang 139 SGK Hóa học 10
─Éß╗æt ch├íy ho├án to├án 2,04g hß╗úp chß║Ñt A, thu ─æã░ß╗úc 1,08g H2O v├á 1,344 l├¡t SO2 (─æktc).
a) H├úy x├íc ─æß╗ïnh c├┤ng thß╗®c ph├ón tß╗¡ cß╗ºa hß╗úp chß║Ñt A.
b) Dß║½n to├án lã░ß╗úng hß╗úp chß║Ñt A n├│i tr├¬n ─æi qua dung dß╗ïch axit sunfuric ─æß║Àc thß║Ñy c├│ kß║┐t tß╗ºa m├áu v├áng xuß║Ñt hiß╗çn.
- H├úy giß║úi th├¡ch tã░ß╗úng v├á viß║┐t phã░ãíng tr├¼nh phß║ún ß╗®ng xß║úy ra.
- T├¡nh khß╗æi lã░ß╗úng chß║Ñt kß║┐t tß╗ºa thu ─æã░ß╗úc
-
Bài tập 10 trang 139 SGK Hóa học 10
Hấp thụ hoàn toàn 12,8g SO2 vào 250ml dung dịch NaOH 1M.
a) Viß║┐t c├íc phã░ãíng tr├¼nh h├│a hß╗ìc cß╗ºa phß║ún ß╗®ng c├│ thß╗â xß║úy ra.
b) T├¡nh khß╗æi lã░ß╗úng muß╗æi tß║ío th├ánh sau phß║ún ß╗®ng
-
Bài tập 32.1 trang 68 SBT Hóa học 10
Cho phß║ún ß╗®ng: SO2 + 2H2S ÔåÆ 3S + 2H2O
Phát biểu nào sau đây đúng?
A. Lã░u huß╗│nh bß╗ï oxi ho├í v├á hi─æro bß╗ï khß╗¡.
B. Lã░u huß╗│nh bß╗ï khß╗¡ v├á kh├┤ng c├│ chß║Ñt n├áo bß╗ï oxi ho├í
C. Lã░u huß╗│nh bß╗ï khß╗¡ v├á hi─æro bß╗ï oxi ho├í
D. Lã░u huß╗│nh trong SO2 bß╗ï khß╗¡, lã░u huß╗│nh trong H2S bß╗ï oxi h├│a
-
Bài tập 32.2 trang 68 SBT Hóa học 10
Oxit nào sau đây là hợp chất ion ?
A. SO2
B. SO3
C. CO2
D. CaO
-
Bài tập 32.3 trang 68 SBT Hóa học 10
Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. H2SO4
B. H2S
C. SO2
D. SO3
-
Bài tập 32.4 trang 68 SBT Hóa học 10
Kh├¡ CO2 c├│ lß║½n tß║íp chß║Ñt l├á SO2. ─Éß╗â loß║íi bß╗Å tß║íp chß║Ñt ta sß╗Ñ hß╗ùn hß╗úp vß╗øi dung dß╗ïch n├áo sau ─æ├óy
A. Dung dß╗ïch Br2 dã░
B. Dung dß╗ïch Ba(OH)2 dã░
C. Dung dß╗ïch Ca(OH)2 dã░
D. Dung dß╗ïch NaOH dã░
-
Bài tập 32.5 trang 69 SBT Hóa học 10
Cho sãí ─æß╗ô phß║ún ß╗®ng: H2S + KMnO4 + H2SO4 ÔåÆ H2O + S + MnSO4 + K2SO4
Hß╗ç sß╗æ cß╗ºa c├íc chß║Ñt phß║ún ß╗®ng l├á d├úy sß╗æ n├áo sau ─æ├óy?
A. 3,3,5
B. 5,2,3
C. 2,2,5
D. 5,2,4
-
Bài tập 32.6 trang 69 SBT Hóa học 10
Ba th├¡ nghiß╗çm ─æã░ß╗úc tiß║┐n h├ánh vß╗øi nhß╗»ng khß╗æi lã░ß╗úng Zn bß║▒ng nhau v├á vß╗øi 50 cm3 dung dß╗ïch lo├úng H2SO4 2M. PTHH cß╗ºa phß║ún ß╗®ng :
Zn + H2SO4  ZnSO4 + H2
Bß║úng dã░ß╗øi ─æ├óy cho biß║┐t c├íc ─æiß╗üu kiß╗çn cß╗ºa mß╗ùi th├¡ nghiß╗çm :
Thí nghiệm Kẛm Nhiệt độ (oC) 1
2
3
bột
lá
lá
30
20
30
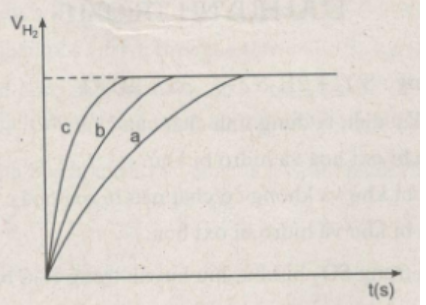
Kh├¡ hi─æro thu ─æã░ß╗úc trong mß╗ùi th├¡ nghiß╗çm ─æã░ß╗úc ghi lß║íi theo nhß╗»ng khoß║úng c├ích nhß║Ñt ─æß╗ïnh vß╗ü thß╗Øi gian cho ─æß║┐n khi phß║ún ß╗®ng kß║┐t th├║c, ─æã░ß╗úc biß╗âu diß╗àn bß║▒ng ─æß╗ô thß╗ï sau:
a) R├║t ra ─æã░ß╗úc nhß╗»ng nhß║¡n x├®t g├¼ khi so s├ính hiß╗çn tã░ß╗úng phß║ún ß╗®ng cß╗ºa :
- Thí nghiệm 1 và thí nghiệm 3 ?
- Thí nghiệm 2 và thí nghiệm 3 ?
b) H├úy quan s├ít ─æß╗ô thß╗ï tr├¬n ─æß╗â cho biß║┐t c├íc ─æã░ß╗Øng cong a, b, c biß╗âu thß╗ï cho nhß╗»ng th├¡ nghiß╗çm n├áo ?
c) Ghi thß╗â t├¡ch kh├¡ H2 tr├¬n trß╗Ñc y khi phß║ún ß╗®ng kß║┐t th├║c. Biß║┐t rß║▒ng ß╗ƒ ─æiß╗üu kiß╗çn ph├▓ng th├¡ nghiß╗çm, 1 mol kh├¡ c├│ thß╗â t├¡ch l├á 24 l├¡t v├á Zn c├▓n dã░ sau c├íc th├¡ nghiß╗çm.
-
Bài tập 32.7 trang 69 SBT Hóa học 10
Trong ph├▓ng th├¡ nghi├¬m, bß║ín em khß║úo s├ít th├¡ nghiß╗çm d├╣ng dung dß╗ïch HCl dã░ t├íc dß╗Ñng vß╗øi mß╗Öt khß╗æi lã░ß╗úng nhß╗Å FeS. Cß╗® sau mß╗Öt khoß║úng c├ích thß╗Øi gian l├á 20 gi├óy, bß║ín em lß║íi ghi thß╗â t├¡ch kh├¡ tho├ít ra. Kß║┐t quß║ú ghi ─æã░ß╗úc nhã░ sau (xem bß║úng):
Thß╗Øi gian (gi├óy) Thß╗â t├¡ch H2S (cm3) Thß╗Øi gian (gi├óy) Thß╗â t├¡ch H2S (cm3) 0
20
40
60
80
0
27
49
68
83
100
120
140
160
180
93
99
100
100
100
a) Viß║┐t PTHH cß╗ºa phß║ún ß╗®ng.
b) Vß║¢ ─æß╗ô thß╗ï biß╗âu diß╗àn thß╗â t├¡ch kh├¡ H2S thu ─æã░ß╗úc (tr├¬n trß╗Ñc tung) theo thß╗Øi gian (tr├¬n trß╗Ñc ho├ánh).
c) Hãy dùng đồ thị để tìm :
- Thß╗â t├¡ch kh├¡ H2S thu ─æã░ß╗úc ß╗ƒ thß╗Øi ─æiß╗âm 50 gi├óy.
- Khoß║úng c├ích thß╗Øi gian n├áo th├¼ phß║ún ß╗®ng xß║úy ra nhanh nhß║Ñt ? chß║¡m nhß║Ñt ?
- Thß╗Øi gian l├á bao nhi├¬u gi├óy kß╗â tß╗½ khi phß║ún ß╗®ng xß║úy ra cho ─æß║┐n khi phß║ún ß╗®ng kß║┐t th├║c ?
d) Em h├úy ph├íc hoß║í tr├¬n ─æß╗ô thß╗ï n├áy mß╗Öt ─æß╗ô thß╗ï biß╗âu diß╗àn thß╗â t├¡ch kh├¡ H2S thu ─æã░ß╗úc, nß║┐u bß║ín em thay bß║▒ng dung dß╗ïch HCl kh├íc c├│ c├╣ng thß╗â t├¡ch nhã░ng c├│ nß╗ông ─æß╗Ö cao hãín.
-
Bài tập 32.8 trang 70 SBT Hóa học 10
Tß╗½ nhß╗»ng chß║Ñt sau: Cu, S, H2S, O2, Na2SO3, H2SO4 ─æß║Àc v├á dung dß╗ïch H2SO4 lo├úng, h├úy viß║┐t PTHH cß╗ºa phß║ún ß╗®ng ─æiß╗üu chß║┐ SO2
-
Bài tập 32.9 trang 71 SBT Hóa học 10
─Éß╗æt ch├íy ho├án to├án 3,4 gam hß╗úp chß║Ñt A, thu ─æã░ß╗úc 2,24 l├¡t kh├¡ SO2 (─æktc) v├á 1,8 gam H2O
a) H├úy x├íc ─æß╗ïnh c├┤ng thß╗®c ph├ón tß╗¡ cß╗ºa hß╗úp chß║Ñt A.
b) Viß║┐t PTHH biß╗âu diß╗àn phß║ún ß╗®ng ch├íy cß╗ºa hß╗úp chß║Ñt A.
c) Dß║½n kh├¡ SO2 thu ─æã░ß╗úc ß╗ƒ tr├¬n v├áo 146,6 gam dung dß╗ïch, trong ─æ├│ c├│ ho├á tan 0,3 mol NaOH. H├úy x├íc ─æß╗ïnh nß╗ông ─æß╗Ö phß║ºn tr─âm c├íc chß║Ñt c├│ trong dung dß╗ïch sau phß║ún ß╗®ng.
-
Bài tập 32.10 trang 71 SBT Hóa học 10
Viß║┐t phã░ãíng tr├¼nh ho├í hß╗ìc cß╗ºa c├íc phß║ún ß╗®ng, ho├án th├ánh chuß╗ùi biß║┐n ho├í sau:
-
Bài tập 32.11 trang 71 SBT Hóa học 10
Viß║┐t phã░ãíng tr├¼nh ho├í hß╗ìc cß╗ºa c├íc phß║ún ß╗®ng, thß╗▒c hiß╗çn chuß╗ùi biß║┐n ─æß╗òi sau
-
Bài tập 32.12 trang 71 SBT Hóa học 10
Viß║┐t PTHH cß╗ºa chuß╗ùi phß║ún ß╗®ng sau :
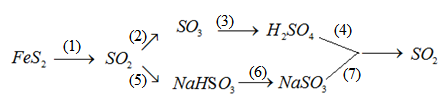
-
Bài tập 32.13 trang 71 SBT Hóa học 10
a) Tß║íi sao dung dß╗ïch H2S trong nã░ß╗øc ─æß╗â l├óu ng├áy trß╗ƒ n├¬n vß║®n ─æß╗Ñc ?
b) H├úy giß║úi th├¡ch v├¼ sao trong tß╗▒ nhi├¬n c├│ nhiß╗üu nguß╗ôn ph├│ng thß║úi ra kh├¡ H2S (n├║i lß╗¡a, x├íc ─æß╗Öng vß║¡t bß╗ï ph├ón huß╗À) nhã░ng lß║íi kh├┤ng c├│ sß╗▒ t├¡ch tß╗Ñ kh├¡ ─æ├│ trong kh├┤ng kh├¡ ?
c) H├úy giß║úi th├¡ch v├¼ sao c├íc ─æß╗ô vß║¡t bß║▒ng bß║íc ─æß╗â l├óu ng├áy thã░ß╗Øng bß╗ï x├ím ─æen ?
d) Tß║íi sao ngã░ß╗Øi ta c├│ thß╗â nhß║¡n biß║┐t kh├¡ H2S bß║▒ng tß╗Ø giß║Ñy tß║®m dung dß╗ïch Pb(NO3)2
-
Bài tập 32.14 trang 72 SBT Hóa học 10
a) Viß║┐t PTHH cß╗ºa c├íc phß║ún ß╗®ng cß╗ºa H2S vß╗øi O2, SO2, nã░ß╗øc clo. Trong c├íc phß║ún ß╗®ng ─æ├│ H2S hß╗â hiß╗çn t├¡nh khß╗¡ hay t├¡nh oxi ho├í, v├¼ sao ?
b) C├│ thß╗â ─æiß╗üu chß║┐ lã░u huß╗│nh tß╗½ kh├¡ SO2 v├á H2S. Viß║┐t PTHH cß╗ºa phß║ún ß╗®ng.
-
Bài tập 32.15 trang 72 SBT Hóa học 10
Trong phß║ún ß╗®ng ho├í hß╗ìc, c├íc chß║Ñt: S, H2S, SO2, H2SO3 c├│ thß╗â ─æ├│ng vai tr├▓ chß║Ñt oxi ho├í hay chß║Ñt khß╗¡ ? H├úy viß║┐t PTHH cß╗ºa phß║ún ß╗®ng ─æß╗â minh hoß║í cho mß╗ùi trã░ß╗Øng hß╗úp.
-
Bài tập 32.16 trang 72 SBT Hóa học 10
Cho m gam hß╗ùn hß╗úp hai muß╗æi Na2CO3 v├á NaHCO3 c├│ sß╗æ mol bß║▒ng nhau t├íc dß╗Ñng vß╗øi dung dß╗ïch H2SO4 (lo├úng) dã░. Kh├¡ sinh ra ─æã░ß╗úc dß║½n v├áo dung dß╗ïch Ba(OH)2 dã░ thu ─æã░ß╗úc 41,4 gam kß║┐t tß╗ºa. X├íc ─æß╗ïnh m.
-
Bài tập 32.17 trang 72 SBT Hóa học 10
Dß║½n tß╗½ tß╗½ 28 gam hß╗ùn hß╗úp X gß╗ôm (CO2, SO2) (dX/O2 = 1,75) qua 500 ml dung dß╗ïch hß╗ùn hß╗úp (NaOH 0,7M ; Ba(OH)2 0,4M) ─æã░ß╗úc m gam kß║┐t tß╗ºa. X├íc ─æß╗ïnh m.
-
Bài tập 32.18 trang 72 SBT Hóa học 10
Hß║Ñp thß╗Ñ hß║┐t 3,35 l├¡t kh├¡ SO2 (─æktc) v├áo dung dß╗ïch NaOH thu ─æã░ß╗úc dung dß╗ïch X chß╗®a 2 muß╗æi. Th├¬m Br2 v├áo dung dß╗ïch X, phß║ún ß╗®ng xong thu ─æã░ß╗úc dung dß╗ïch Y. Cho dung dß╗ïch Y t├íc dß╗Ñng vß╗øi lã░ß╗úng dã░ dung dß╗ïch Ba(OH)2 thu ─æã░ß╗úc kß║┐t tß╗ºa. T├¡nh khß╗æi lã░ß╗úng kß║┐t tß╗ºa thu ─æã░ß╗úc sau khi phß║ún ß╗®ng xß║úy ra ho├án to├án.
-
Bài tập 32.19 trang 72 SBT Hóa học 10
Hß║Ñp thß╗Ñ ho├án to├án 3,36 l├¡t (─æktc) hß╗ùn hß╗úp kh├¡ CO2 v├á SO2 v├áo 500 ml dung dß╗ïch NaOH c├│ nß╗ông ─æß╗Ö a mol/l, thu ─æã░ß╗úc dung dß╗ïch X c├│ khß║ú n─âng hß║Ñp thß╗Ñ tß╗æi ─æa 2,24 l├¡t CO2. X├íc ─æß╗ïnh a.
-
Bài tập 2 trang 176 SGK Hóa học 10 nâng cao
Bß║íc tiß║┐p x├║c vß╗øi kh├┤ng kh├¡ c├│ H2S bß╗ï biß║┐n ─æß╗òi th├ánh Ag2S m├áu ─æen:
4Ag + 2H2S + O2  2Ag2S + 2H2O
C├óu n├áo diß╗àn tß║ú ─æ├║ng t├¡nh chß║Ñt cß╗ºa c├íc chß║Ñt phß║ún ß╗®ng?
A. Ag là chất oxi hóa, H2S là chất khử.
B. H2S là chất khử, O2 là chất oxi hóa.
C. Ag là chất khử, O2 là chất oxi hóa.
D. H2S vừa là chất oxi hóa, vừa là chất khử, còn Ag là chất khử.
-
Bài tập 3 trang 177 SGK Hóa học 10 nâng cao
Dß║½n kh├¡ H2S v├áo dung dß╗ïch hß╗ùn hß╗úp KMnO4 v├á H2SO4, nhß║¡n thß║Ñy m├áu t├¡m cß╗ºa dung dß╗ïch chuyß╗ân sang kh├┤ng m├áu v├á c├│ vß║®n ─æß╗Ñc m├áu v├áng. H├úy:
a) Giß║úi th├¡ch hiß╗çn tã░ß╗úng quan s├ít ─æã░ß╗úc.
b) Viß║┐t phã░ãíng tr├¼nh h├│a hß╗ìc biß╗âu diß╗àn phß║ún ß╗®ng.
c) Cho biß║┐t vai tr├▓ cß╗ºa c├íc chß║Ñt phß║ún ß╗®ng H2S v├á KMnO4.
-
Bài tập 4 trang 177 SGK Hóa học 10 nâng cao
C├│ bß╗æn dung dß╗ïch lo├úng cß╗ºa c├íc muß╗æi NaCl, KNO3, Pb(NO3)2, CuSO4. H├úy cho biß║┐t c├│ hiß╗çn tã░ß╗úng g├¼ xß║úy ra v├á giß║úi th├¡ch khi cho:
a) Dung dịch Na2S vào mỗi dung dịch các muối trên.
b) Khí H2S đi vào mỗi dung dịch các muối trên.
-
Bài tập 5 trang 177 SGK Hóa học 10 nâng cao
Cho hß╗ùn hß╗úp FeS v├á Fe t├íc dß╗Ñng vß╗øi dung dß╗ïch HCl (dã░), thu ─æã░ß╗úc 2,464 l├¡t hß╗ùn hß╗úp kh├¡ ß╗ƒ ─æiß╗üu kiß╗çn ti├¬u chuß║®n. Dß║½n hß╗ùn hß╗úp kh├¡ n├áy ─æi qua dung dß╗ïch Pb(NO3)2 (dã░), sinh ra 23,9g kß║┐t tß╗ºa m├áu ─æen.
a) Viß║┐t phã░ãíng tr├¼nh h├│a hß╗ìc cß╗ºa c├íc phß║ún ß╗®ng ─æ├ú xß║úy ra.
b) Hß╗ùn hß╗úp kh├¡ thu ─æã░ß╗úc gß╗ôm nhß╗»ng kh├¡ n├áo? T├¡nh tß╗ë lß╗ç sß╗æ mol c├íc kh├¡ trong hß╗ùn hß╗úp.
c) T├¡nh th├ánh phß║ºn phß║ºn tr─âm theo khß╗æi lã░ß╗úng cß╗ºa hß╗ùn hß╗úp rß║»n ban ─æß║ºu.
-
Bài tập 1 trang 186 SGK Hóa học 10 nâng cao
Lã░u huß╗│nh ─æioxit c├│ thß╗â tham gia nhß╗»ng phß║ún ß╗®ng sau: .
SO2 + Br2 + 2H2O  2HBr + H2SO4 (1)
SO2 + 2H2S  3S + 2H2O (2)
C├óu n├áo sau ─æ├óy diß╗àn tß║ú kh├┤ng ─æ├║ng t├¡nh chß║Ñt trong nhß╗»ng phß║ún ß╗®ng tr├¬n?
A. Phß║ún ß╗®ng (1): SO2 l├á chß║Ñt khß╗¡, Br2 l├á chß║Ñt oxi h├│a.
B. Phß║ún ß╗®ng (2): SO2 l├á chß║Ñt oxi h├│a, H2S l├á chß║Ñt khß╗¡.
C. Phß║ún ß╗®ng (2): SO2 vß╗½a l├á chß║Ñt khß╗¡, vß╗½a l├á chß║Ñt oxi h├│a.
D. Phß║ún ß╗®ng (1): Br2 l├á chß║Ñt oxi h├│a, phß║ún ß╗®ng (2): H2S l├á chß║Ñt khß╗¡.
-
Bài tập 2 trang 186 SGK Hóa học 10 nâng cao
H├úy gh├®p cß║Àp chß║Ñt v├á t├¡nh chß║Ñt cß╗ºa chß║Ñt sao cho ph├╣ hß╗úp:ÔÇâ
Cột I:
A. S
B. SO2
C. H2S
D. H2SO4
Cột II:
a) Có tính oxi hóa
b) có tính khử
c) chất rắn có tính oxi hóa và tính khử
d) không có tính oxi hóa và tính khử
e) chất khí có tính oxi hóa và tính khử
-
Bài tập 4 trang 186 SGK Hóa học 10 nâng cao
H├úy lß║¡p bß║úng so s├ính nhß╗»ng t├¡nh chß║Ñt giß╗æng nhau, kh├íc nhau giß╗»a hai hß╗úp chß║Ñt cß╗ºa lã░u huß╗│nh l├á hi─æro sunfua v├á lã░u huß╗│nh ─æioxit vß╗ü:
a) Tính chất vật lí.
b) T├¡nh chß║Ñt h├│a hß╗ìc, giß║úi th├¡ch v├á chß╗®ng minh bß║▒ng phã░ãíng tr├¼nh h├│a hß╗ìc.
-
Bài tập 5 trang 186 SGK Hóa học 10 nâng cao
H├úy lß║¡p nhß╗»ng phã░ãíng tr├¼nh h├│a hß╗ìc sau v├á cho biß║┐t vai tr├▓ cß╗ºa c├íc chß║Ñt tham gia phß║ún ß╗®ng.
a) SO2 + Fe2(SO4)3 + H2O  H2SO4 + FeSO4
b) SO2 + K2Cr2O7 + H2SO4  K2SO4+ Cr2(SO4)3 + H2O
c) H2S + Cl2  S + HCl
d) H2S + SO2  S + H2O
c) SO2 + Br2 + H2O  HBr + H2SO4.