Bài tập 32.6 trang 69 SBT Hóa học 10
Ba thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và với 50 cm3 dung dịch loãng H2SO4 2M. PTHH của phản ứng :
Zn + H2SO4 → ZnSO4 + H2
Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm :
| Thí nghiệm | Kẽm | Nhiệt độ (oC) |
|
1 2 3 |
bột lá lá |
30 20 30 |
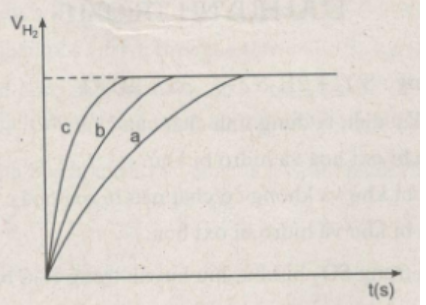
Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách nhất định về thời gian cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau:
a) Rút ra được những nhận xét gì khi so sánh hiện tượng phản ứng của :
- Thí nghiệm 1 và thí nghiệm 3 ?
- Thí nghiệm 2 và thí nghiệm 3 ?
b) Hãy quan sát đồ thị trên để cho biết các đường cong a, b, c biểu thị cho những thí nghiệm nào ?
c) Ghi thể tích khí H2 trên trục y khi phản ứng kết thúc. Biết rằng ở điều kiện phòng thí nghiệm, 1 mol khí có thể tích là 24 lít và Zn còn dư sau các thí nghiệm.
Hướng dẫn giải chi tiết bài 32.6
a) Nhận xét:
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H2SO4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H2SO4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.
b) Đồ thị biểu diễn các phản ứng :
Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất
Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình.
Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất.
c) Thể tích khí hiđro :
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H2SO4 tham gia phản ứng
nH2 = nH2SO4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
VH2 = 0,1 x 24 = 2,4l = 2400 cm3
Ta ghi số 2400 cm3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Bài tập 32.4 trang 68 SBT Hóa học 10
Bài tập 32.5 trang 69 SBT Hóa học 10
Bài tập 32.7 trang 69 SBT Hóa học 10
Bài tập 32.8 trang 70 SBT Hóa học 10
Bài tập 32.9 trang 71 SBT Hóa học 10
Bài tập 32.10 trang 71 SBT Hóa học 10
Bài tập 32.11 trang 71 SBT Hóa học 10
Bài tập 32.12 trang 71 SBT Hóa học 10
Bài tập 32.13 trang 71 SBT Hóa học 10
Bài tập 32.14 trang 72 SBT Hóa học 10
Bài tập 32.15 trang 72 SBT Hóa học 10
Bài tập 32.16 trang 72 SBT Hóa học 10
Bài tập 32.17 trang 72 SBT Hóa học 10
Bài tập 32.18 trang 72 SBT Hóa học 10
Bài tập 32.19 trang 72 SBT Hóa học 10
Bài tập 2 trang 176 SGK Hóa học 10 nâng cao
Bài tập 3 trang 177 SGK Hóa học 10 nâng cao
Bài tập 4 trang 177 SGK Hóa học 10 nâng cao
Bài tập 5 trang 177 SGK Hóa học 10 nâng cao
Bài tập 1 trang 186 SGK Hóa học 10 nâng cao
Bài tập 2 trang 186 SGK Hóa học 10 nâng cao
-


\(SO_2\) có thể gây khó thở cho người bị hen suyễn, gây các bệnh về hô hấp và làm cho bệnh tim càng nặng hơn. \(SO_2\) phản ứng với những hạt này sẽ tụ tập trong phổi và gắn kết với nhau gây khó thở và dẫn đến nguy cơ tử vong. Có thể kết luận gì về tính chất của \(SO_2\)?
bởi khanh nguyen
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Khí không thể làm khô bằng \(H_2SO_4\) đặc là gì?
bởi Bin Nguyễn
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Ý kiến đúng về muối sunfat?
bởi trang lan
 26/02/2021
26/02/2021
A. Muối sunfat là muối axit sunfuhiđric.
B. Tất cả các muối sunfat đều tan tốt trong nước.
C. Có thể nhận biết muối sunfat bằng dung dịch muối bari hoặc dung dịch Ba(OH)2.
D. Các muối sunfat đều thể hiện tính oxi hóa.
Theo dõi (0) 1 Trả lời -


Cho thí nghiệm, nêu hiện tượng?
bởi Thanh Truc
 26/02/2021
26/02/2021
 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -
ADMICRO


Tính V biết 0,1 mol mỗi chất Fe, FeS và \(FeS_2\) vào \(H_2SO_4\) đặc nóng thu được V lít khí (đktc) \(SO_2\) sản phẩm khử duy nhất.
bởi thanh duy
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Tính V biết 1 lượng \(Ca(OH)_2\) vừa đủ tác dụng với V lít khí \(SO_2\) (đktc) thu được 6 gam kết tủa. Lọc bỏ kết tủa cho tiếp một lượng dung dịch \(Ca(OH)_2\) dư vào phần nước lọc thì thu thêm 3 gam kết tủa nữa.
bởi Duy Quang
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Cho 4,8 gam bột lưu huỳnh tác dụng với 6,5 gam bột kẽm. Sau khi phản ứng với %H = 80% được hỗn hợp chất rắn X. Hòa tan X trong HCl dư thu được bao nhiêu lít khí?
bởi Tường Vi
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Hãy tìm ra nhận định đúng? 1. \(SO_2\) vừa là chất oxi hóa, vừa là chất khử.
bởi Mai Thuy
 26/02/2021
26/02/2021
2. Phản ứng giữa H2S và SO2 dùng để thu hồi S trong các khí thải.
3. Ozon có tính khử mạnh và khử được Ag ở điều kiện thường.
4. Dẫn khí O3 qua dung dịch KI có hồ tinh bột, dung dịch có màu xanh.
5. NaHSO3 có tên natri hiđrosunfit.
6. FeCO3 tác dụng với H2SO4 loãng và H2SO4 đặc cho cùng 1 loại muối.
Theo dõi (0) 1 Trả lời -


Tìm X biết ở điều kiện thường X là một chất khí, có khả năng tan tốt trong nước tạo ra dung dịch làm đổi màu quỳ tím thành đỏ. X còn được dùng làm chất tẩy trắng giấy, bột giấy, chống nấm mốc cho lương thực, thực phẩm.
bởi Hoa Hong
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Những chất phản ứng được với \(H_2SO_4\) đặc nguội là gì?
bởi A La
 25/02/2021
25/02/2021
A. Cu, Ag, Zn, Mg.
B. Zn, Al, Mg, Ca.
C. Cu, Cr, Ag, Fe.
D. Al, Fe, Ba, Cu.
Theo dõi (0) 1 Trả lời -


Những hóa chất để nhận biết \(Na_2S, K_2CO_3, BaCl_2, Na_2SO_3\), NaCl lần lượt là gì?
bởi Anh Tuyet
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời -


Cho 5,6 lít (đktc) X gồm \(H_2S\) + \(SO_2\) tác dụng hết với 1,25 lít brom vừa đủ. Thêm tiếp vào dung dịch sau phản ứng \(Ba(NO_3)_2\) dư, thu được m gam kết tủa trắng. Giá trị của m là
bởi Mai Linh
 25/02/2021
Theo dõi (0) 1 Trả lời
25/02/2021
Theo dõi (0) 1 Trả lời -


Đốt cháy hoàn toàn V lít khí \(H_2S\) (đktc) = oxi vừa đủ thu được khí Y. Hấp thụ hết Y cần vừa đủ 200 ml dung dịch \(KMnO_4\) 1M. Giá trị của V?
bởi hi hi
 26/02/2021
Theo dõi (0) 1 Trả lời
26/02/2021
Theo dõi (0) 1 Trả lời