Để giúp các em học tập hiệu quả môn Hóa 10, đội ngũ HỌC247 đã biên soạn và tổng hợp nội dung Bài 3: Nguyên tố hóa học lớp 10 chương trình SGK Cánh Diều. Bài giảng gồm kiến thức cần nhớ về nguyên tố, số hiệu nguyên tử, số khối, kí hiệu, đồng vị cũng như cách tính nguyên tử trung bình... Bên cạnh đó còn có các bài tập minh họa có hướng dẫn giải chi tiết, giúp các em học tập và củng cố thật tốt kiến thức. Mời các em cùng tham khảo.
Tóm tắt lý thuyết
1.1. Nguyên tố hóa học
a. Khái niệm nguyên tố hoá học
- Nguyên tố hoá học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử hydrogen (H) đều có một proton trong hạt nhân nên thuộc cùng một nguyên tố hoá học, nguyên tố hydrogen (H).
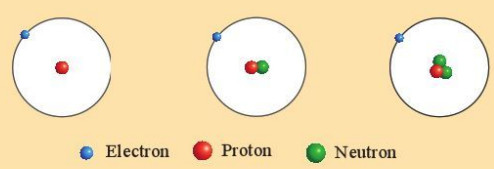
Hình 3.2. Mô hình cấu tạo các loại nguyên tử của nguyên tố hydrogen
- Kim cương và than chì có vẻ bề ngoài rất khác nhau nhưng đều được tạo nên từ các nguyên tử mà hạt nhân có 6 proton. Như vậy, kim cương và than chì đều được tạo nên từ cùng một nguyên tố hoá học, nguyên tố carbon (C).

Hình 3.3. Kim cương và than chì
- Hạt nhân nguyên tử chì (Pb) có 82 proton, hạt nhân nguyên tử vàng có 79 proton. Các tác động vật lí, hoá học thông thường không làm thay đổi hạt nhân nên không thể biến đổi chì thành vàng bằng các cách này được.
1.2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
- Ví dụ: Hạt nhân nguyên tử helium (He) có 2 proton, vậy số hiệu nguyên tử của He là 2 (ZHe = 2).
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A: A = Z + N
- Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (khi tính theo đơn vị amu).
- Kí hiệu nguyên tử \(_Z^AX\) cho biết kí hiệu hoá học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).

Hình 3.4. Kí hiệu nguyên tử của helium
- Đôi khi, người ta viết tắt kí hiệu nguyên tử. Ví dụ: sử dụng He thay cho \(_2^4He\), bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
1.3. Đồng vị, nguyên tử trung bình
a. Đồng vị
- Các nguyên tử của cùng một nguyên tố hoá học có số neutron khác nhau là đồng vị của nhau.
- Do đó, các đồng vị của cùng một nguyên tố hoá học (có cùng số proton) khác nhau về số khối do có số neutron khác nhau.
- Tất cả các nguyên tố hoá học đều có nhiều đồng vị.
Ví dụ: hydrogen có các đồng vị là: 1H (kí hiệu là H), đồng vị, 2H (kí hiệu là D), 3H (kí hiệu là T).., carbon có các đồng vị là 12C, 13C,...
b. Nguyên tử khối trung bình
- Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 12C là 12 do khối lượng của một nguyên tử 12C là 12 amu.
- Nguyên tử khối trung bình
+ Mỗi nguyên tố hoá học đều có nhiều đồng vị. Trong tự nhiên, một nguyên tố hoá học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi. Nguyên tử khối của nguyên tố hoá học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là \(\overline A \)), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
+ Công thức tính nguyên tử khối trung bình như sau:
\(\overline A = \frac{{A.a + B.b + C.c + ...}}{{a + b + c + ...}}\)
+ Trong đó:
- A, B, C,... lần lượt là số khối của các đồng vị.
- a, b, c,... là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, bạc có hai đồng vị bền: 107Ag và 109Ag chiếm tương ứng khoảng 51,86% và 48,14% về số nguyên tử. Nguyên tử khối trung bình của bạc là:
\(\frac{{107.51,86 + 109.48,14}}{{51,86 + 51,86}} \approx 107,96\)
Bài tập minh họa
Bài 1: Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hoá học?
.jpg)
Hình 3.1. Mô hình cấu tạo của một số nguyên tử
Hướng dẫn giải
- Những nguyên tử mà hạt nhân có cùng số proton sẽ thuộc cùng một nguyên tố hóa học.
- Trong một nguyên tử trung hòa về điện, số hạt proton = số hạt electron
- Dễ dàng thấy được:
+ Hình a, hình c đều có 3 electron ở lớp vỏ => Hình a, hình c đều có 3 proton → Nguyên tử a, nguyên tử c thuộc cùng 1 nguyên tố hóa học
+ Hình b, hình d đều có 2 electron ở lớp vỏ => Hình b, hình d đều có 2 proton → Nguyên tử b, nguyên tử d thuộc cùng 1 nguyên tố hóa học
Bài 2: Nguyên tử lithium (Li) có 3 proton trong hạt nhân. Khi Li tác dụng với khí chlorine (Cl2) sẽ thu được muối lithium chlorine (LiCl), trong đó Li tồn tại ở dạng Li+. Ion Li+ có bao nhiêu proton trong hạt nhân?
Hướng dẫn giải
- Nguyên tử Li và ion Li+ đều thuộc cùng 1 nguyên tố hóa học là Li
- Li+ là nguyên tử Li sau khi mất đi 1 electron. Do vậy Li+ sẽ có 3 proton và 2 electron
→ Trong hạt nhân Li và Li+ đều có cùng số hạt proton là 3.
Bài 3: Nguyên tử Li có 3 proton, 4 neutron. Viết kí hiệu nguyên tử của nguyên tố này
Hướng dẫn giải
- Nguyên tử Li có 3 proton và 4 neutron
- Số hiệu nguyên tử = số proton
- Số khối = số proton + số neutron
→ Số hiệu nguyên tử của Li là 3 và số khối của Li = 3 + 4 = 7
→ Kí hiệu Li có 3 proton và 4 neutron là: \({}_3^7X\)
Luyện tập Bài 3 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Trình bày được khái niệm về nguyên tố hoá học, số hiệu nguyên tử, số khối và kí hiệu nguyên tử.
- Phát biểu được khái niệm đồng vị, nguyên tử khối.
- Tính được nguyên tử khối trung bình (theo amu) dựa vào khối lượng nguyên tử và phần trăm số nguyên tử của các đồng vị theo phổ khối lượng được cung cấp.
3.1. Trắc nghiệm Bài 3 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 3 cực hay có đáp án và lời giải chi tiết.
-
- A. 18
- B. 20
- C. 38
- D. 40
-
- A. X thuộc ô 92, chu kì 7
- B. X thuộc ô 60 chu kì 6
- C. X thuộc ô 72 chu kì 6 nhóm IVB
- D. Tất cả đều sai
-
- A. Chu kì 2, nhóm VA, HXO3.
- B. Chu kì 2, nhóm VA, XH4.
- C. Chu kì 2, nhóm VA, XH3.
- D. Chu kì 2, nhóm VA, XH2.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 3 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 3 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 16 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 17 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 17 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 3 trang 17 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 17 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 3 trang 18 SGK Hóa học 10 Cánh Diều - CD
Vận dụng 1 trang 18 SGK Hóa học 10 Cánh Diều - CD
Vận dụng 2 trang 18 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 18 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 4 trang 18 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 20 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 20 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 20 SGK Hóa học 10 Cánh Diều - CD
Giải bài 4 trang 20 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3.1 trang 7 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.2 trang 7 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.3 trang 7 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.4 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.5 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.6 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.7 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.8 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.9 trang 8 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.10 trang 9 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.11 trang 9 SBT Hóa học 10 Cánh Diều - CD
Giải bài 3.12 trang 10 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 3 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





