Nhằm giúp các em học sinh có thêm nhiều tài liệu tham khảo hữu ích cho môn Hóa 10 chương trình Cánh Diều, HỌC247 đã biên soạn Bài 2: Các thành phần của nguyên tử. Bài giảng gồm chi tiết các khái niệm về thành phần, cấu trúc, khối lượng và kích thước của nguyên tử.... giúp các em dễ dàng nắm bắt được kiến thức trọng tâm của bài, vận dụng các kiến thức đã học vào giải bài tập. Mời các em cùng tham khảo.
Tóm tắt lý thuyết
1.1. Thành phần và cấu trúc của nguyên tử
- Mọi vật thể đểu được tạo nên từ các chất và mọi chất được tạo nên từ các nguyên tử
- Bằng thực nghiệm khoa học, người ta đã xác định được nguyên tử được tạo nên từ các hạt nhỏ bé hơn, gọi là các hạt cơ bản.
- Ba loại hạt cơ bản tạo nên nguyên tử là
+ Hạt electron, kí hiệu là e.
+ Hạt proton, kí hiệu là p.
+ Hạt neutron, kí hiệu là n.
- Khối lượng và điện tích các hạt cơ bản này được thể hiện trong Bảng 2.1
Bảng 2.1. Khối lượng và điện tích của các hạt cấu tạo nên nguyên tử
| Loại hạt | Electron | Proton | Neutron |
| Khối lượng* (amu) | 0.00055 | 1 | 1 |
| Điện tích (eo) | + |
- Trong tất cả các nguyên tố, duy nhất có một loại nguyên tử của hydrogen (H) chỉ tạo nên bởi proton và electron (không có neutron)
1.2. Cấu trúc của nguyên tử
Nguyên tử gồm lớp vỏ tạo nên bởi các hạt electron và hạt nhân tạo nên bởi các hạt proton và neutron.
Hình dưới đây mô tả cấu tạo của một loại nguyên tử hydrogen và một loại nguyên tử beryllium.
.jpg)
a) Hydrogen b) Beryllium
Hình 2.2. Mô hình cấu tạo của một số nguyên tử
1.3. Khối lượng và kích thước của nguyên tử
Nguyên tử của các nguyên tố khác nhau có kích thước và khối lượng khác nhau.
a. Khối lượng của nguyên tử
- Khối lượng của nguyên tử vô cùng nhỏ. Khối lượng nguyên tử thường được biểu thị theo đơn vị amu. Nguyên tử có khối lượng nhỏ nhất thuộc về nguyên tố hydrogen (H) là 1 annu, nguyên tử có khối lượng lớn nhất trong tự nhiên thuộc về nguyên tố tranium (U) là 238 amu.
- Do khối lượng của các electron rất nhỏ so với khối lượng của protonhay neutron, nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử
- Một cách gần đúng, có thể coi khối lượng nguyên tử bằng khối lượng của hạt nhân.
b. Kích thước của nguyên tử
- Kích thước của nguyên tử là vô cùng nhỏ so với kích thước của vật thể khác trong tự nhiên (Hình 2.3).
- Coi nguyên tử có dạng hình cầu khỉ đỏ, nguyên tử có đường kính nhỏ nhất là He (0,62 \(\mathop A\limits^0 \)), nguyên tử có đường kính lớn nhất là francium Fr (5,4\(\mathop A\limits^0 \)).
- Angstrom là đơn vị đo độ dài, kể hiệu là \(\mathop A\limits^0 \), 1\(\mathop A\limits^0 \)= 102 pm =10-10 km.
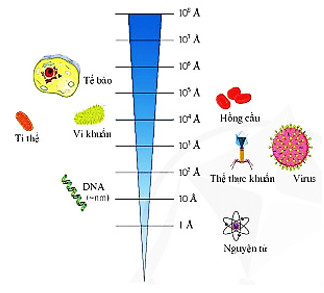
Hình 2.3. So sánh kích thước của nguyên tử với một số vật thể
- Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử. Kích thước hạt nhân bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử, như vậy phần không gian rộng chiếm chủ yếu trong nguyên tử.
Bài tập minh họa
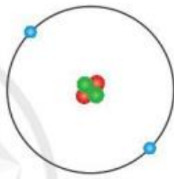
Bài 1: Nguyên tử helium được tạo nên từ ba loại hạt cơ bản (được tô màu khác nhau) Hãy gọi tên và nêu vị trí của mỗi loại hạt này trong nguyên tử?
Hướng dẫn giải
- Ba loại hạt cơ bản tạo nên nguyên tử là:
+ Hạt proton: nằm ở hạt nhân (bên trong) của nguyên tử
+ Hạt neutron: nằm ở hạt nhân (bên trong) của nguyên tử
+ Hạt electron: nằm ở lớp vỏ (bên ngoài) của nguyên tử
Bài 2: Các nguyên tử đều trung hòa về điện. Em hãy lập luận để chứng minh rằng: trong một nguyên tử, số proton và số electron luôn bằng nhau.
Hướng dẫn giải
- Trong 1 nguyên tử, gọi:
+ Số proton là a
+ Số neutron là b
+ Số electron là c
- Vì các nguyên tử trung hòa về điện => Tổng điện tích các hạt trong 1 nguyên tử = 0.
- Ta có:
(+1).a + (-1).b + 0.c = 0
→ a – b = 0
→ a = b
Như vậy: trong một nguyên tử, số proton và số electron luôn bằng nhau.
Luyện tập Bài 2 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Trình bày được thành phần của nguyên tử.
- So sánh được khối lượng của electron với proton và với neutron.
- So sánh được kích thước của hạt nhân với nguyên tử.
3.1. Trắc nghiệm Bài 2 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 2 cực hay có đáp án và lời giải chi tiết.
-
- A. 13 e
- B. 14 e
- C. 5 e
- D. 3 e
-
- A. 26, 26, 30
- B. 26, 28, 30
- C. 26, 28, 30
- D. 26, 24, 30
-
- A. 3819K
- B. 3919K
- C. 3820K
- D. 3920K
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 2 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 2 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 11 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 12 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 12 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 3 trang 12 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 12 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 13 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 13 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 15 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 15 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 15 SGK Hóa học 10 Cánh Diều - CD
Giải bài 4 trang 15 SGK Hóa học 10 Cánh Diều - CD
Giải bài 5 trang 15 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2.1 trang 4 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.2 trang 4 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.3 trang 4 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.4 trang 4 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.5 trang 4 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.6 trang 5 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.7 trang 5 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.8 trang 5 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.9 trang 5 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.10 trang 6 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.11 trang 6 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.12 trang 6 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.13 trang 6 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.14 trang 6 SBT Hóa học 10 Cánh Diều - CD
Giải bài 2.15 trang 6 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 2 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





