Bà i 5: Láŧp, phÃĒn láŧp và cášĨu hÃŽnh electron mÃīn HÃģa háŧc láŧp 10 chÆ°ÆĄng trÃŽnh SGK CÃĄnh Diáŧu bÊn dÆ°áŧi ÄÃĒy sáš― cung cášĨp cho cÃĄc em háŧc sinh cÃĄi nhÃŽn táŧng quan nhášĨt váŧ láŧp, phÃĒn láŧp electron và máŧi quan háŧ váŧ sáŧ lÆ°áŧĢng phÃĒn láŧp trong máŧt láŧp. LiÊn háŧ ÄÆ°áŧĢc váŧ sáŧ lÆ°áŧĢng AO trong máŧt phÃĒn láŧp, trong máŧt láŧp, rÃĻn luyáŧn kÄĐ nÄng viášŋt cášĨu hÃŽnh electron nguyÊn táŧ theo láŧp, phÃĒn láŧp electron và theo Ãī orbital khi biášŋt sáŧ hiáŧu nguyÊn táŧ Z táŧŦ ÄÃģ biášŋt cÃĄch dáŧą ÄoÃĄn ÄÆ°áŧĢc tÃnh chášĨt hoÃĄ háŧc cÆĄ bášĢn cáŧ§a nguyÊn táŧ. Máŧi cÃĄc em tham khášĢo náŧi dung chi tiášŋt ÄÆ°áŧĢc HOC247 trÃŽnh bà y bÊn dÆ°áŧi ÄÃĒy.
TÃģm tášŊt lÃ― thuyášŋt
1.1. Láŧp và phÃĒn láŧp electron
- CÃĄc electron trong láŧp váŧ nguyÊn táŧ ÄÆ°áŧĢc phÃĒn báŧ và o cÃĄc láŧp và phÃĒn láŧp dáŧąa theo nÄng lÆ°áŧĢng cáŧ§a chÚng.
- NÄng lÆ°áŧĢng cáŧ§a máŧt electron pháŧĨ thuáŧc và o khoášĢng cÃĄch táŧŦ electron ÄÃģ táŧi hᚥt nhÃĒn. Electron cà ng xa hᚥt nhÃĒn thÃŽ cÃģ nÄng lÆ°áŧĢng cà ng cao. Vášy khoášĢng cÃĄch cáŧ§a cÃĄc electron trong cÃđng máŧt láŧp táŧi hᚥt nhÃĒn ÄÆ°áŧĢc coi nhÆ° gᚧn bášąng nhau.
a. Láŧp electron
CÃĄc electron thuáŧc cÃđng máŧt láŧp cÃģ nÄng lÆ°áŧĢng gᚧn bášąng nhau.
Trong máŧi láŧp electron cÃģ tháŧ cÃģ máŧt hoáš·c nhiáŧu AO. Sáŧ táŧi hᚥt nhÃĒn lÆ°áŧĢng AO và sáŧ electron táŧi Äa trÊn máŧi láŧp nhÆ° BášĢng 5.1.
BášĢng 5.1. Sáŧ AO và sáŧ electron táŧi Äa trong máŧi láŧp

Sáŧ electron và sáŧ AO trong láŧp electron tháŧĐ n (n<4) ÄÆ°áŧĢc ghi nháŧ theo quy tášŊc sau:
+ Láŧp tháŧĐ n cÃģ n2 AO.
+ Láŧp tháŧĐ n cÃģ táŧi Äa 2n2 electron.
b. PhÃĒn láŧp electron
Máŧi láŧp electron (tráŧŦ láŧp tháŧĐ nhášĨt) lᚥi ÄÆ°áŧĢc chia thà nh cÃĄc phÃĒn láŧp theo nguyÊn tášŊc sau: CÃĄc electron thuáŧc cÃđng máŧt phÃĒn láŧp cÃģ nÄng lÆ°áŧĢng bášąng nhau.
- Sáŧ lÆ°áŧĢng và kà hiáŧu cÃĄc phÃĒn láŧp trong máŧt láŧp
- Láŧp electron tháŧĐ n cÃģ n phÃĒn láŧp và kà hiáŧu lᚧn lÆ°áŧĢt là ns, np, nd, nf,... CáŧĨ tháŧ:
+ Láŧp K, n= 1: cÃģ 1 phÃĒn láŧp, kà hiáŧu là 1s.
+ Láŧp L, n= 2: cÃģ 2 phÃĒn láŧp, kà hiáŧu là 2s và 2p.
+ Láŧp M, n=3: cÃģ 3 phÃĒn láŧp, kà hiáŧu là 3s, 3p và 3d.
- Sáŧ lÆ°áŧĢng AO trong máŧi phÃĒn láŧp
+ PhÃĒn láŧp ns cháŧ cÃģ 1 AO.
+ PhÃĒn láŧp np cÃģ 3 AO.
+ PhÃĒn láŧp nd cÃģ 5 AO.
+ PhÃĒn láŧp nf cÃģ 7 AO.
- Sáŧ electron trong máŧi phÃĒn láŧp ÄÆ°áŧĢc biáŧu diáŧ n bášąng cháŧ sáŧ phÃa trÊn bÊn phášĢi kà hiáŧu phÃĒn láŧp. PhÃĒn láŧp nà o ÄÃĢ cÃģ táŧi Äa electron thÃŽ ÄÆ°áŧĢc gáŧi là phÃĒn láŧp bÃĢo hoà .
Và dáŧĨ: Kà hiáŧu 1s2 cho biášŋt phÃĒn láŧp 1s cÃģ 2 electron. Do phÃĒn láŧp 1s cháŧ cÃģ 1 AO nÊn phÃĒn láŧp nà y cháŧĐa táŧi Äa 2 electron, 1s2 ÄÆ°áŧĢc gáŧi là phÃĒn láŧp bÃĢo hoà (electron).
| Dáŧąa theo nÄng lÆ°áŧĢng, cÃĄc electron trong láŧp váŧ nguyÊn táŧ ÄÆ°áŧĢc phÃĒn báŧ và o cÃĄc láŧp và phÃĒn láŧp. CÃĄc electron thuáŧc cÃđng máŧt phÃĒn láŧp cÃģ nÄng lÆ°áŧĢng bášąng nhau, cÃĄc electron thuáŧc cÃđng máŧt láŧp cÃģ nÄng lÆ°áŧĢng gᚧn bášąng nhau. |
|---|
1.2. CášĨu hÃŽnh electron nguyÊn táŧ
a. CÃĄch viášŋt cášĨu hÃŽnh electron nguyÊn táŧ
- CášĨu hÃŽnh electron biáŧu diáŧ n sáŧą phÃĒn báŧ electron và o láŧp váŧ nguyÊn táŧ theo cÃĄc láŧp và phÃĒn láŧp.
- Quy tášŊc ÄÆ°áŧng chÃĐo xÃĄc Äáŧnh dÃĢy Klechkovski (Klášŋch-cáŧpski) nhÆ° sau:

- CÃĄc bÆ°áŧc viášŋt cášĨu hÃŽnh electron nguyÊn táŧ theo nháŧŊng quy tášŊc nhÆ° sau:
(1) Äiáŧn electron theo tháŧĐ táŧą cÃĄc máŧĐc nÄng lÆ°áŧĢng táŧŦ thášĨp Äášŋn cao (dÃĢy Klechkovski):
| 1s2s2p3s3p4s3d4p5s4d5p6s... |
|---|
Äiáŧn electron bÃĢo hoà phÃĒn láŧp trÆ°áŧc ráŧi máŧi ÄiÊn tiášŋp và o phÃĒn láŧp sau.
(2) Äáŧi lᚥi váŧ trà cÃĄc phÃĒn láŧp sao cho sáŧ tháŧĐ táŧą láŧp (n) tÄng dᚧn táŧŦ trÃĄi qua phášĢi, cÃĄc phÃĒn láŧp trong cÃđng máŧt láŧp theo tháŧĐ táŧą s, p, d, f.
Và dáŧĨ 1: NguyÊn táŧ Li cÃģ Z = 3. Äiáŧn 3 electron và o dÃĢy Klechkovski theo quy tášŊc (1) ÄÆ°áŧĢc 1s22s1. ÄÃĒy cÅĐng chÃnh là cášĨu hÃŽnh electron cáŧ§a Li vÃŽ trÆ°áŧng háŧĢp nà y khÃīng cᚧn sáŧ dáŧĨng Äášŋn quy tášŊc (2).
Và dáŧĨ 2: NguyÊn táŧ K cÃģ Z = 19. Äiáŧn lᚧn lÆ°áŧĢt 19 electron và o dÃĢy Klechkovski, nhášn ÄÆ°áŧĢc cášĨu hÃŽnh 1s22s22p63s23p64s1.
- CášĨu hÃŽnh nà y cÃģ tháŧ viášŋt gáŧn là [Ar]4s1; kà hiáŧu [Ar] thay cho cášĨu hÃŽnh nguyÊn táŧ khà hiáŧm A là 1s22s22p63s23p6.
- CášĨu hÃŽnh electron cho biášŋt tháŧĐ táŧą máŧĐc nÄng lÆ°áŧĢng cÃĄc electron giáŧŊa cÃĄc phÃĒn láŧp. NÄng lÆ°áŧĢng electron trÊn máŧi phÃĒn láŧp tÄng theo chiáŧu táŧŦ trÃĄi qua phášĢi.
Và dáŧĨ 3: Trong nguyÊn táŧ Li, nÄng lÆ°áŧĢng cáŧ§a electron thuáŧc phÃĒn láŧp 2s cao hÆĄn electron thuáŧc phÃĒn láŧp 1s.
b. Biáŧu diáŧ n cášĨu hÃŽnh electron theo Ãī orbital
- Biáŧu diáŧ n cášĨu hÃŽnh electron theo Ãī orbital (cÃēn gáŧi là cÃĄch biáŧu diáŧ n cášĨu hÃŽnh theo Ãī lÆ°áŧĢng táŧ) là máŧt cÃĄch biáŧu diáŧ n sáŧą phÃĒn báŧ electron theo orbital, táŧŦ ÄÃģ biášŋt ÄÆ°áŧĢc sáŧ electron Äáŧc thÃĒn cáŧ§a nguyÊn táŧ.
- Quy tášŊc biáŧu diáŧ n cášĨu hÃŽnh theo Ãī orbital:
+ Viášŋt cášĨu hÃŽnh electron cáŧ§a nguyÊn táŧ.
+ Biáŧu diáŧ n máŧi AO bášąng máŧt Ãī vuÃīng (Ãī orbital hay Ãī lÆ°áŧĢng táŧ), cÃĄc AO trong cÃđng phÃĒn láŧp thÃŽ viášŋt liáŧn nhau, cÃĄc AO khÃĄc phÃĒn láŧp thÃŽ viášŋt tÃĄch nhau. TháŧĐ táŧą cÃĄc Ãī orbital táŧŦ trÃĄi sang phášĢi theo tháŧĐ táŧą nhÆ° áŧ cášĨu hÃŽnh electron.
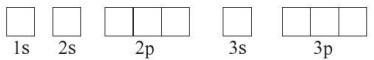
+ Äiáŧn electron và o táŧŦng Ãī orbital theo tháŧĐ táŧą láŧp và phÃĒn láŧp, máŧi electron biáŧu diáŧ n bášąng máŧt mÅĐi tÊn. Trong máŧi phÃĒn láŧp, electron ÄÆ°áŧĢc phÃĒn báŧ sao cho sáŧ electron Äáŧc thÃĒn là láŧn nhášĨt, electron ÄÆ°áŧĢc Äiáŧn và o cÃĄc Ãī orbital theo tháŧĐ táŧą táŧŦ trÃĄi sang phášĢi. Trong máŧt Ãī orbital, electron Äᚧu tiÊn ÄÆ°áŧĢc biáŧu diáŧ n bášąng mÅĐi tÊn quay lÊn, electron tháŧĐ hai ÄÆ°áŧĢc biáŧu diáŧ n bášąng mÅĐi tÊn quay xuáŧng.
VÃ dáŧĨ: CášĨu hÃŽnh theo Ãī orbital cáŧ§a C nhÆ° sau:
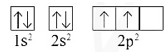
NhÆ° vášy, nguyÊn táŧ carbon cÃģ 2 electron Äáŧc thÃĒn, thuáŧc AO 2p
| CášĨu hÃŽnh electron biáŧu diáŧ n sáŧą phÃĒn báŧ electron và o láŧp váŧ nguyÊn táŧ theo cÃĄc láŧp và phÃĒn láŧp. |
|---|
1.3. Dáŧą ÄoÃĄn tÃnh chášĨt hÃģa háŧc cÆĄ bášĢn cáŧ§a nguyÊn táŧ dáŧąa theo cášĨu hÃŽnh electron cáŧ§a nguyÊn táŧ
- CÃĄc electron thuáŧc láŧp ngoà i cÃđng (cÃēn gáŧi là electron hoÃĄ tráŧ) cÃģ vai trÃē quyášŋt Äáŧnh Äášŋn tÃnh chášĨt hoÃĄ háŧc Äáš·c trÆ°ng cáŧ§a nguyÊn táŧ (tÃnh kim loᚥi, tÃnh phi kim, tÃnh trÆĄ,...). TáŧŦ cášĨu hÃŽnh electron, cÃģ tháŧ dáŧą ÄoÃĄn cÃĄc tÃnh chášĨt nà y theo quy tášŊc sau:
+ CÃĄc nguyÊn táŧ cÃģ 1, 2 hoáš·c 3 electron áŧ láŧp ngoà i cÃđng thÆ°áŧng là cÃĄc nguyÊn táŧ nguyÊn táŧ kim loᚥi. TÃnh kim loᚥi tháŧ hiáŧn qua khášĢ nÄng nhÆ°áŧng electron trong cÃĄc phášĢn áŧĐng hoÃĄ háŧc (tÃnh kháŧ).
+ CÃĄc nguyÊn táŧ cÃģ 5, 6 hoáš·c 7 electron áŧ láŧp ngoà i cÃđng thÆ°áŧng là cÃĄc nguyÊn táŧ nguyÊn táŧ phi kim. Tinh phi kim tháŧ hiáŧn qua khášĢ nÄng nhášn electron trong cÃĄc phášĢn áŧĐng hoÃĄ háŧc (tÃnh oxi hoÃĄ).
+ CÃĄc nguyÊn táŧ cÃģ 8 electron áŧ láŧp ngoà i cÃđng là cÃĄc nguyÊn táŧ nguyÊn táŧ khà hiáŧm (tráŧŦ He cháŧ cÃģ 2 electron). CÃĄc nguyÊn táŧ nà y rášĨt khÃģ tham gia cÃĄc phášĢn áŧĐng hoÃĄ háŧc (tÃnh trÆĄ).
+ Nášŋu láŧp electron ngoà i cÃđng cÃģ 4 electron thÃŽ nguyÊn táŧ nguyÊn táŧ cÃģ tháŧ là kim loᚥi hoáš·c phi kim.
| TáŧŦ cášĨu hÃŽnh electron cáŧ§a nguyÊn táŧ, cÃģ tháŧ dáŧą ÄoÃĄn ÄÆ°áŧĢc tÃnh chášĨt hoÃĄ háŧc cÆĄ bášĢn cáŧ§a nguyÊn táŧ hoÃĄ háŧc. |
|---|
BÃ i tášp minh háŧa
Bà i 1: Cho biášŋt sáŧą phÃĒn báŧ electron theo láŧp cáŧ§a cÃĄc nguyÊn táŧ H, He, Li nhÆ° sau:
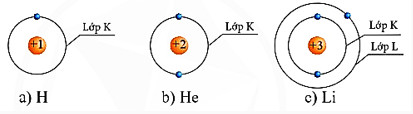
HÃŽnh 5.1. Sáŧą phÃĒn báŧ electron theo láŧp cáŧ§a máŧt sáŧ nguyÊn táŧ
Dáŧąa và o hÃŽnh 5.1, hÃĢy cho biášŋt sáŧ electron táŧi Äa áŧ láŧp K cáŧ§a cÃĄc nguyÊn táŧ cÃģ sáŧ hiáŧu nguyÊn táŧ Z \( \geqslant \) 2 là bao nhiÊu. Theo em, tháŧĐ táŧą phÃĒn báŧ electron và o láŧp váŧ nguyÊn táŧ nhÆ° thášŋ nà o?
HÆ°áŧng dášŦn giášĢi
- Sáŧ electron táŧi Äa áŧ láŧp K cáŧ§a cÃĄc nguyÊn táŧ cÃģ sáŧ hiáŧu nguyÊn táŧ Z \( \geqslant \) 2 là 2.
- TháŧĐ táŧą phÃĒn báŧ electron và o láŧp váŧ nguyÊn táŧ
+ CÃĄc electron ÄÆ°áŧĢc phÃĒn báŧ và o láŧp gᚧn hᚥt nhÃĒn trÆ°áŧc.
+ Sáŧ electron táŧi Äa trong máŧi láŧp là 2n2(n là sáŧ tháŧĐ táŧą láŧp n \( \geqslant \) 4).
| KÃ hiáŧu máŧi láŧp |
Láŧp tháŧĐ nhášĨt (Láŧp K) |
Láŧp tháŧĐ hai (Láŧp L) |
Láŧp tháŧĐ ba (Láŧp M) |
Láŧp tháŧĐ tÆ° (Láŧp N) |
| Sáŧ electron táŧi Äa máŧi láŧp | 2 | 8 | 18 | 32 |
BÃ i 2: VÃŽ sao sáŧ AO trong máŧt láŧp luÃīn bášąng máŧt náŧa sáŧ electron táŧi Äa thuáŧc láŧp ÄÃģ?
HÆ°áŧng dášŦn giášĢi
VÃŽ láŧp tháŧĐ n cÃģ n2 AO và sáŧ electron táŧi Äa trong máŧi láŧp là 2n2 nÊn sáŧ AO trong máŧt láŧp luÃīn bášąng máŧt náŧa sáŧ electron táŧi Äa thuáŧc láŧp ÄÃģ.
Luyáŧn tášp BÃ i 5 HÃģa 10 CÃĄnh Diáŧu
Háŧc xong bà i háŧc nà y, em cÃģ tháŧ:
- TrÃŽnh bà y ÄÆ°áŧĢc khÃĄi niáŧm láŧp, phÃĒn láŧp electron và máŧi quan háŧ váŧ sáŧ lÆ°áŧĢng phÃĒn láŧp trong máŧt láŧp. LiÊn háŧ ÄÆ°áŧĢc váŧ sáŧ lÆ°áŧĢng AO trong máŧt phÃĒn láŧp, trong máŧt láŧp.
- Viášŋt ÄÆ°áŧĢc cášĨu hÃŽnh electron nguyÊn táŧ theo láŧp, phÃĒn láŧp electron và theo Ãī orbital khi biášŋt sáŧ hiáŧu nguyÊn táŧ Z cáŧ§a 20 nguyÊn táŧ Äᚧu tiÊn trong bášĢng tuᚧn hoà n.
- Dáŧąa và o Äáš·c Äiáŧm cášĨu hÃŽnh electron láŧp ngoà i cÃđng cáŧ§a nguyÊn táŧ, dáŧą ÄoÃĄn ÄÆ°áŧĢc tÃnh chášĨt hoÃĄ háŧc cÆĄ bášĢn (kim loᚥi hay phi kim) cáŧ§a nguyÊn táŧ tÆ°ÆĄng áŧĐng.
3.1. TrášŊc nghiáŧm BÃ i 5 HÃģa 10 CÃĄnh Diáŧu
CÃĄc em cÃģ tháŧ háŧ tháŧng lᚥi náŧi dung kiášŋn tháŧĐc ÄÃĢ háŧc ÄÆ°áŧĢc thÃīng qua bà i kiáŧm tra TrášŊc nghiáŧm HÃģa háŧc 10 CÃĄnh Diáŧu Bà i 5 cáŧąc hay cÃģ ÄÃĄp ÃĄn và láŧi giášĢi chi tiášŋt.
-
- A. X2Y2
- B. X2Y3
- C. X5Y2
- D. X3Y2
-
- A. 3s2
- B. 2s22p4
- C. 2s22p3
- D. 3s23p1
-
- A. 3s1
- B. 3s2
- C. 3s23p1
- D. A, B, C Äáŧu ÄÚng
CÃĒu 4-10: Máŧi cÃĄc em ÄÄng nhášp xem tiášŋp náŧi dung và thi tháŧ Online Äáŧ cáŧ§ng cáŧ kiášŋn tháŧĐc váŧ bà i háŧc nà y nhÃĐ!
3.2. BÃ i tášp SGK BÃ i 5 HÃģa 10 CÃĄnh Diáŧu
CÃĄc em cÃģ tháŧ xem thÊm phᚧn hÆ°áŧng dášŦn GiášĢi bà i tášp HÃģa háŧc 10 CÃĄnh Diáŧu Bà i 5 Äáŧ giÚp cÃĄc em nášŊm váŧŊng bà i háŧc và cÃĄc phÆ°ÆĄng phÃĄp giášĢi bà i tášp.
GiášĢi cÃĒu háŧi 1 trang 26 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
Luyáŧn tášp trang 27 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi cÃĒu háŧi 2 trang 27 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi cÃĒu háŧi 3 trang 27 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi cÃĒu háŧi 4 trang 27 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
Luyáŧn tášp trang 28 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
Luyáŧn tášp trang 29 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
Luyáŧn tášp trang 30 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 1 trang 30 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 2 trang 30 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 3 trang 30 SGK HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.1 trang 12 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.2 trang 13 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.3 trang 13 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.4 trang 13 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.5 trang 13 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.6 trang 13 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.7 trang 14 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.8 trang 14 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.9 trang 14 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.10 trang 14 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.11 trang 14 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.12 trang 15 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.13 trang 15 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.14 trang 15 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.15 trang 16 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.16 trang 16 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.17 trang 16 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
GiášĢi bà i 5.18 trang 16 SBT HÃģa háŧc 10 CÃĄnh Diáŧu - CD
Háŧi ÄÃĄp BÃ i 5 HÃģa háŧc 10 CÃĄnh Diáŧu
Trong quÃĄ trÃŽnh háŧc tášp nášŋu cÃģ thášŊc mášŊc hay cᚧn tráŧĢ giÚp gÃŽ thÃŽ cÃĄc em hÃĢy comment áŧ máŧĨc Háŧi ÄÃĄp, Cáŧng Äáŧng HÃģa háŧc HOC247 sáš― háŧ tráŧĢ cho cÃĄc em máŧt cÃĄch nhanh chÃģng!
ChÚc cÃĄc em háŧc tášp táŧt và luÃīn Äᚥt thà nh tÃch cao trong háŧc tášp!





