HOC247 xin gi·ªõi thi·ªáu ƒë·∫øn qu√Ω th·∫ßy c√¥ gi√°o v√Ý c√°c em h·ªçc sinh B·ªô 5 ƒë·ªÅ thi HK2 m√¥n H√≥a h·ªçc 10 nƒÉm 2021 ƒë∆∞·ª£c bi√™n so·∫°n v√Ý t·ªïng h·ª£p t·ª´ ƒë·ªÅ thi c·ªßa Tr∆∞·ªùng THPT Y√™n L·∫°c 2, ƒë·ªÅ thi g·ªìm c√≥ c√°c c√¢u tr·∫Øc nghi·ªám v·ªõi ƒë√°p √°n ƒëi k√®m s·∫Ω gi√∫p c√°c em luy·ªán t·∫≠p, l√Ým quen c√°c d·∫°ng ƒë·ªÅ ƒë·ªìng th·ªùi ƒë·ªëi chi·∫øu k·∫øt qu·∫£, ƒë√°nh gi√° nƒÉng l·ª±c b·∫£n th√¢n t·ª´ ƒë√≥ c√≥ k·∫ø ho·∫°ch h·ªçc t·∫≠p ph√π h·ª£p. M·ªùi c√°c em c√πng tham kh·∫£o!
|
TR∆Ø·ªúNG THPT Y√äN L·∫ÝC |
ĐỀ THI HỌC KÌ 2 NĂM 2021 MÔN HÓA HỌC 10 THỜI GIAN 45 PHÚT |
ĐỀ SỐ 1
I. Trắc nghiệm:
C√¢u 1: Trong ph√≤ng th√≠ nghi·ªám kh√≠ oxi c√≥ th·ªÉ ƒë∆∞·ª£c ƒëi·ªÅu ch·∫ø b·∫±ng c√°ch nhi·ªát ph√¢n mu·ªëi KClO3 c√≥ MnO2 l√Ým x√∫c t√°c v√Ý c√≥ th·ªÉ ƒë∆∞·ª£c thu b·∫±ng c√°ch ƒë·∫©y n∆∞·ªõc hay ƒë·∫©y kh√¥ng kh√≠
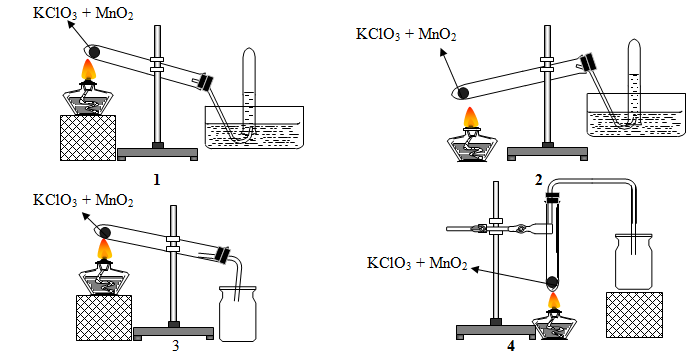
Trong c√°c h√¨nh v·∫Ω cho ·ªü tr√™n, h√¨nh v·∫Ω m√¥ t·∫£ ƒëi·ªÅu ch·∫ø v√Ý thu kh√≠ oxi ƒë√∫ng c√°ch l√Ý
A. 1 v√Ý 2. B. 2 v√Ý 3. C. 1 v√Ý 3. D. 3 v√Ý 4.
C√¢u 2: Ph·∫£n ·ª©ng ƒëi·ªÅu ch·∫ø kh√≠ clo trong ph√≤ng th√≠ nghi·ªám l√Ý:
A. F2 + 2NaCl ‚Üí 2NaF + Cl2 .
B. 2HCl ‚Üí H2 + Cl2.
C. 2NaCl ‚Üí 2Na + Cl2 .
D. 4HCl + MnO2 ‚Üí MnCl2 + 2H2O + Cl2 .
Câu 3: Chia một dung dịch nước brom có màu vàng làm 2 phần:
- Dẫn khí X không màu vào phần 1 thì dung dịch mất màu
- Dẫn khí Y không màu vào phần 2 thì dung dịch sẫm màu hơn.
Khí X và Y có thể lần lượt là:
A. SO2 vaÃÄ Cl2. B. SO2 vaÃÄ HI. C. SO2 vaÃÄ CO2. D. N2 vaÃÄ CO2.
C√¢u 4: Khi nung n√≥ng, iot bi·∫øn th√Ýnh h∆°i kh√¥ng qua tr·∫°ng th√°i l·ªèng. Hi·ªán t∆∞·ª£ng n√Ýy ƒë∆∞·ª£c g·ªçi l√Ý
A. sự chuyển trạng thái. B. sự thăng hoa.
C. sự bay hơi. D. sự phân hủy.
C√¢u 5: H√≤a tan 12,8 gam Cu trong axit H2SO4 ƒë·∫∑c, n√≥ng d∆∞. Th·ªÉ t√≠ch kh√≠ SO2 thu ƒë∆∞·ª£c (ƒëktc) l√Ý
A. 4,48 lít. B. 2,24 lít. C. 6,72 lít. D. 8,96 lít.
Câu 6: Trong hệ phản ứng ở trạng thái cân bằng: 2SO2 (k) + O2 (k) → 2SO3 (k) ( H<0)
Nồng độ của SO3 sẽ tăng, nếu :
A. giảm nồng độ của SO2. B. tăng nồng độ của SO2.
C. tăng nhiệt độ. D. giảm nồng độ của O2.
C√¢u 7: Khi b·∫Øt ƒë·∫ßu ph·∫£n ·ª©ng, n·ªìng ƒë·ªô m·ªôt ch·∫•t l√Ý 0,024 mol/l . Sau 10 gi√¢y x·∫£y ra ph·∫£n ·ª©ng, n·ªìng ƒë·ªô c·ªßa ch·∫•t ƒë√≥ l√Ý 0,022 mol/l. T·ªëc ƒë·ªô ph·∫£n ·ª©ng trong tr∆∞·ªùng h·ª£p n√Ýy l√Ý :
A. 0,03 mol/l.s. B. 0,025 mol/l.s. C. 0,015 mol/l.s. D. 0,02 mol/l.s.
C√¢u 8: ƒê·ªÉ ph√¢n bi·ªát O2 v√Ý O3, ng∆∞·ªùi ta th∆∞·ªùng d√πng thu·ªëc th·ª≠ l√Ý
A. n∆∞·ªõc. B. dung d·ªãch KI v√Ý h·ªì tinh b·ªôt.
C. dung dịch CuSO4. D. dung dịch H2SO4.
C√¢u 9: Cho h·ªón h·ª£p X g·ªìm Fe(56) v√Ý Mg(24) v√Ýo dung d·ªãch HCl v·ª´a ƒë·ªß th√¨ ƒë∆∞·ª£c 0,224l√≠t hydro(ƒëktc). M·∫∑t kh√°c A t√°c d·ª•ng v·ª´a ƒë·ªß v·ªõi 0,28l√≠t clo (ƒëktc). Th√Ýnh ph·∫ßn % kh·ªëi l∆∞·ª£ng Mg trong X l√Ý:
A. 30%. B. 70%. C. 43%. D. 57%.
C√¢u 10: Ng∆∞·ªùi ta ph·∫£i b∆°m, s·ª•c kh√¥ng kh√≠ v√Ýo c√°c b·ªÉ nu√¥i c√° c·∫£nh.Trong b·ªÉ c√°, ng∆∞·ªùi ta l·∫Øp th√™m m√°y s·ª•c kh√≠ l√Ý ƒë·ªÉ
A. cung cấp thêm cacbon đioxit. B. cung cấp thêm nitơ cho cá.
C. ch·ªâ ƒë·ªÉ l√Ým ƒë·∫πp. D. cung c·∫•p th√™m oxi cho c√°.
C√¢u 11: Cho 0,5 mol KOH t√°c d·ª•ng v·ªõi 0,5mol HCl.Cho qu√¨ t√≠m v√Ýo dung d·ªãch sau ph·∫£n ·ª©ng, qu√¨ t√≠m chuy·ªÉn sang m√Ýu:
A. xanh. B. ƒë·ªè. C. h·ªìng. D. kh√¥ng ƒë·ªïi m√Ýu.
C√¢u 12: Cho 0,448 l√≠t Clo (ƒëktc) v√Ýo dung d·ªãch NaX d∆∞, ƒë∆∞·ª£c 5,08 gam X2. Nguy√™n t·ªë X l√Ý:
A. Br. B. I. C. Cl. D. F.
C√¢u 13: ƒêi·ªÅn t·ª´ th√≠ch h·ª£p v√Ýo ch·ªó tr·ªëng trong ƒëo·∫°n vƒÉn b·∫£n sau:
Oxi trong kh√¥ng kh√≠ l√Ý s·∫£n ph·∫©m c·ªßa qu√° tr√¨nh ‚Ķ(1). C√¢y xanh l√Ý nh√Ý m√°y s·∫£n xu·∫•t cacbohiƒërat v√Ý oxi t·ª´ cacbon ƒëioxit v√Ý n∆∞·ªõc d∆∞·ªõi t√°c d·ª•ng c·ªßa ‚Ķ(2)‚Ķ m·∫∑t tr·ªùi. Nh·ªù s·ª± quang h·ª£p c·ªßa c√¢y xanh m√Ý l∆∞·ª£ng kh√≠ oxi trong kh√¥ng kh√≠ h·∫ßu nh∆∞ ‚Ķ(3).
A. (1) quang hợp, (2) ánh sáng, (3) không đổi.
B. (1) hô hấp, (2) ánh sáng, (3) không đổi.
C. (1) quang hợp, (2) nhiệt, (3) thay đổi.
D. (1) hô hấp, (2) năng lượng, (3) thay đổi.
C√¢u 14: L·ªõp ozon ·ªü t·∫ßng b√¨nh l∆∞u c·ªßa kh√≠ quy·ªÉn l√Ý t·∫•m l√° ch·∫Øn tia t·ª≠ ngo·∫°i c·ªßa M·∫∑t tr·ªùi, b·∫£o v·ªá s·ª± s·ªëng tr√™n Tr√°i ƒë·∫•t. Hi·ªán t∆∞·ª£ng suy gi·∫£m t·∫ßng ozon ƒëang l√Ý m·ªôt v·∫•n ƒë·ªÅ m√¥i tr∆∞·ªùng to√Ýn c·∫ßu. Nguy√™n nh√¢n c·ªßa hi·ªán t∆∞·ª£ng n√Ýy l√Ý do
A. chất thải CO2. B. chất thải CFC.
C. sự thay đổi của khí hậu. D. các hợp chất hữu cơ trong tự nhiên.
C√¢u 15: Ch·∫•t ƒÉn m√≤n th·ªßy tinh l√Ý:
A. F2. B. KF. C. HI. D. HF.
Câu 16: Cho các phản ứng:
(1) SiO2 + dung dịch HF →
(2) F2 + H2O ‚Üí
(3) AgBr ‚Üí
(4) Br2 + NaI (d∆∞) ‚Üí
Trong c√°c ph·∫£n ·ª©ng tr√™n, nh·ªØng ph·∫£n ·ª©ng c√≥ t·∫°o ra ƒë∆°n ch·∫•t l√Ý
A. (2), (3), (4). B. (1), (3), (4). C. (1), (2), (4). D. (1), (2), (3).
C√¢u 17: S·ª•c t·ª´ t·ª´ 2,24 lit SO2 (ƒëkc) v√Ýo 1C√¢u ml dung d·ªãch NaOH 3M. C√°c ch·∫•t c√≥ trong dung d·ªãch sau ph·∫£n ·ª©ng?
A. Na2SO3, H2O. B. Na2SO3, NaHSO3, H2O.
C. Na2SO3, NaOH, H2O. D. NaHSO3,H2O.
C√¢u 18: T·ªëc ƒë·ªô ph·∫£n ·ª©ng l√Ý :
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
C. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
C√¢u 19: C√≥ m·ªôt h·ªón h·ª£p kh√≠ g·ªìm oxi v√Ý ozon. H·ªón h·ª£p kh√≠ n√Ýy c√≥ t·ªâ kh·ªëi so v·ªõi H2 l√Ý 18. Th√Ýnh ph·∫ßn ph·∫ßn trƒÉm theo th·ªÉ t√≠ch c·ªßa oxi v√Ý ozon trong h·ªón h·ª£p kh√≠ l·∫ßn l∆∞·ª£t l√Ý
A. 60% v√Ý 40%. B. 80% v√Ý 20%. C. 25% v√Ý 75%. D. 75% v√Ý 25%.
C√¢u 20: C√°c s·ªë oxi h√≥a c√≥ th·ªÉ c√≥ c·ªßa l∆∞u hu·ª≥nh l√Ý
A. - 2; +4: +6. B. 0; +4; +6. C. - 2; 0; +4; +6. D. 0; +2; +4;+6.
Câu 21: Cho các phát biểu sau:
(1): Khi thu khí oxi bằng phương pháp đẩy không khí, ta phải đặt miệng bình úp xuống
(2): Các phản ứng hóa học có lưu huỳnh tham gia đều phải đun nóng
(3): Ozon có tính oxi hóa mạnh hơn oxi vì ozon dễ bị phân hủy sinh ra oxi nguyên tử
(4): Ozon dễ tan trong nước hơn so với oxi do phân tử ozon kém phân cực hơn oxi
(5): Oxi phản ứng với hầu hết các phi kim, trừ nhóm halogen
S·ªë ph√°t bi·ªÉu ƒë√∫ng l√Ý.
A. 2. B. 3. C. 4. D. 5.
Câu 22: Ở nhiệt độ không đổi, hệ cân bằng sẽ dịch chuyển về bên phải nếu tăng áp suất
A. 2H2(k) + O2(k) ‚Üí 2H2O(k).
B. 2SO3(k) ‚Üí 2SO2(k) + O2(k)
C. 2NO(k) ‚Üí N2(k) + O2(k)
D. 2CO2(k) ‚Üí 2CO(k) + O2(k)
C√¢u 23: D√£y g·ªìm c√°c ch·∫•t ƒë·ªÅu t√°c d·ª•ng v·ªõi oxi l√Ý
A. H2, Fe, Cl2. B. Na, H2S, Pt. C. Mg, C, Al. D. CO, Au, S.
C√¢u 24: Tr·ªôn 22,4 gam b·ªôt Fe v·ªõi 9,6 gam b·ªôt S r·ªìi nung trong ƒëi·ªÅu ki·ªán kh√¥ng c√≥ kh√¥ng kh√≠ ƒë·∫øn khi ph·∫£n ·ª©ng ho√Ýn to√Ýn, thu ƒë∆∞·ª£c ch·∫•t r·∫Øn X. Ho√Ý tan X b·∫±ng dung d·ªãch H2SO4 lo√£ng d∆∞ thu ƒë∆∞·ª£c kh√≠ Y. ƒê·ªët ch√°y ho√Ýn to√Ýn Y c·∫ßn V l√≠t O2 (ƒëktc). Gi√° tr·ªã c·ªßa V l√Ý.
A. 8,96. B. 11,20. C. 13,44. D. 15,68.
II. Tự luận
C√¢u 1: (1 ƒëi·ªÉm) Ho√Ýn th√Ýnh c√°c ph∆∞∆°ng tr√¨nh ph·∫£n ·ª©ng sau:
a) Fe + S ‚Üí b) S + O2 ‚Üí
C√¢u 2: (3 ƒëi·ªÉm) 11,2 lit (ƒëkc) h·ªón h·ª£p kh√≠ A g·ªìm clo v√Ý oxi t√°c d·ª•ng h·∫øt v·ªõi 16,98 gam h·ªón h·ª£p B g·ªìm Mg v√Ý Al t·∫°o ra 42,34 gam h·ªón h·ª£p G g·ªìm clorua v√Ý oxit c·ªßa 2 kim lo·∫°i. T√≠nh th√Ýnh ph·∫ßn ph·∫ßn trƒÉm v·ªÅ th·ªÉ t√≠ch c·ªßa t·ª´ng ch·∫•t trong h·ªón h·ª£p A? th√Ýnh ph·∫ßn ph·∫ßn trƒÉm v·ªÅ kh·ªëi l∆∞·ª£ng c·ªßa t·ª´ng ch·∫•t trong h·ªón h·ª£p B?
ĐÁP ÁN ĐỀ SỐ 1
I. Trắc nghiệm:
|
1C |
2D |
3B |
4B |
5A |
6B |
|
7D |
8B |
9A |
10D |
11D |
12B |
|
13A |
14B |
15D |
16A |
17C |
18C |
|
19D |
20B |
21A |
22A |
23C |
24C |
II. Tự luận:
C√¢u 1:
\(\begin{gathered}
Fe + S \to FeS \hfill \\
S + {O_2} \to S{O_2} \hfill \\
\end{gathered} \)
C√¢u 2:
a, ƒê·∫∑t a(mol) l√Ý s·ªë mol c·ªßa Clo, b (mol) l√Ý s·ªë mol c·ªßa Oxi.
Ta có:
\(\begin{gathered}
{n_A} = \frac{{11,2}}{{22,4}} = 0,5(mol) \hfill \\
\Rightarrow a + b = 0,5(1) \hfill \\
\end{gathered} \)
Theo ĐLBTKL ta có:
\(\begin{gathered}
{m_A} + {m_B} = {m_G} \hfill \\
\Leftrightarrow 71a + 32b + 16,98 = 42,34 \hfill \\
\to 71a + 32b = 42,34 - 16,98 \hfill \\
\Rightarrow 71a + 32b = 25,36(2) \hfill \\
\end{gathered} \)
Từ (1), (2) ta có hệ pt: \(\left\{ \begin{gathered}
a + b = 0,5 \hfill \\
71a + 32b = 25,36 \hfill \\
\end{gathered} \right.\)
Giải hệ pt ta được: \(\left\{ \begin{gathered}
a = 0,24 \hfill \\
b = 0,26 \hfill \\
\end{gathered} \right.\)
\(\left\{ \begin{gathered}
\% {V_{C{l_2}}} = \frac{{0,24}}{{0,5}} = 48\% \hfill \\
\% V{o_2} = 100 - 48 = 52\% \hfill \\
\end{gathered} \right.\)
b, ƒê·∫∑t s·ªë mol c·ªßa Mg l√Ý x(mol), s·ªë mol c·ªßa Al l√Ý y (mol)
\(24x + 27y = 16,98\;\left( 3 \right)\)
BTKL ta có: BTE ta có:
\(\begin{gathered}
2x + 3y = 0,48{\text{ }} + 1,04 \hfill \\
\Rightarrow 2x + 3y = 1,52{\text{ }}\left( 4 \right) \hfill \\
\end{gathered} \)
Từ (3), (4) ta có hệ pt:
\(\left\{ \begin{gathered}
24x + 27y = 16,98 \hfill \\
2x + 3y = 1,52 \hfill \\
\end{gathered} \right.\)
Giải hệ pt ta được:
\(\left\{ \begin{gathered}
x = 0,56 \hfill \\
y = 0,14 \hfill \\
\end{gathered} \right. \Rightarrow \left\{ \begin{gathered}
\% Mg = \frac{{0,56.24}}{{16,98}} = 79,15\% \hfill \\
\% Al = 100 - 79,15 = 20,85\% \hfill \\
\end{gathered} \right.\)
ĐỀ SỐ 2
I. Trắc nghiệm: (6 điểm)
Câu 1: Cho các phát biểu sau:
(1): Khi thu khí oxi bằng phương pháp đẩy không khí, ta phải đặt miệng bình úp xuống
(2): Các phản ứng hóa học có lưu huỳnh tham gia đều phải đun nóng
(3): Ozon có tính oxi hóa mạnh hơn oxi vì ozon dễ bị phân hủy sinh ra oxi nguyên tử
(4): Ozon dễ tan trong nước hơn so với oxi do phân tử ozon kém phân cực hơn oxi
(5): Oxi phản ứng với hầu hết các phi kim, trừ nhóm halogen
S·ªë ph√°t bi·ªÉu ƒë√∫ng l√Ý.
A. 3. B. 2. C. 5. D. 4.
C√¢u 2: H√≤a tan 12,8 gam Cu trong axit H2SO4 ƒë·∫∑c, n√≥ng d∆∞. Th·ªÉ t√≠ch kh√≠ SO2 thu ƒë∆∞·ª£c (ƒëktc) l√Ý
A. 4,48 lít. B. 8,96 lít. C. 6,72 lít. D. 2,24 lít.
C√¢u 3: ƒê·ªÉ ph√¢n bi·ªát O2 v√Ý O3, ng∆∞·ªùi ta th∆∞·ªùng d√πng thu·ªëc th·ª≠ l√Ý
A. nước. B. dung dịch CuSO4.
C. dung d·ªãch H2SO4. D. dung d·ªãch KI v√Ý h·ªì tinh b·ªôt.
C√¢u 4: Cho 0,448 l√≠t Clo (ƒëktc) v√Ýo dung d·ªãch NaX d∆∞, ƒë∆∞·ª£c 5,08 gam X2. Nguy√™n t·ªë X l√Ý:
A. Br. B. F. C. I. D. Cl.
C√¢u 5: Khi b·∫Øt ƒë·∫ßu ph·∫£n ·ª©ng, n·ªìng ƒë·ªô m·ªôt ch·∫•t l√Ý 0,024 mol/l . Sau 10 gi√¢y x·∫£y ra ph·∫£n ·ª©ng, n·ªìng ƒë·ªô c·ªßa ch·∫•t ƒë√≥ l√Ý 0,022 mol/l. T·ªëc ƒë·ªô ph·∫£n ·ª©ng trong tr∆∞·ªùng h·ª£p n√Ýy l√Ý :
A. 0,02 mol/l.s. B. 0,03 mol/l.s. C. 0,025 mol/l.s. D. 0,015 mol/l.s.
C√¢u 6: L·ªõp ozon ·ªü t·∫ßng b√¨nh l∆∞u c·ªßa kh√≠ quy·ªÉn l√Ý t·∫•m l√° ch·∫Øn tia t·ª≠ ngo·∫°i c·ªßa M·∫∑t tr·ªùi, b·∫£o v·ªá s·ª± s·ªëng tr√™n Tr√°i ƒë·∫•t. Hi·ªán t∆∞·ª£ng suy gi·∫£m t·∫ßng ozon ƒëang l√Ý m·ªôt v·∫•n ƒë·ªÅ m√¥i tr∆∞·ªùng to√Ýn c·∫ßu. Nguy√™n nh√¢n c·ªßa hi·ªán t∆∞·ª£ng n√Ýy l√Ý do
A. chất thải CO2. B. chất thải CFC.
C. sự thay đổi của khí hậu. D. các hợp chất hữu cơ trong tự nhiên.
Câu 7: Cho các phản ứng:
(1) SiO2 + dung dịch HF →
(2) F2 + H2O ‚Üí
(3) AgBr ‚Üí
(4) Br2 + NaI (d∆∞) ‚Üí
Trong c√°c ph·∫£n ·ª©ng tr√™n, nh·ªØng ph·∫£n ·ª©ng c√≥ t·∫°o ra ƒë∆°n ch·∫•t l√Ý
A. (1), (3), (4). B. (2), (3), (4). C. (1), (2), (4). D. (1), (2), (3).
C√¢u 8: ƒêi·ªÅn t·ª´ th√≠ch h·ª£p v√Ýo ch·ªó tr·ªëng trong ƒëo·∫°n vƒÉn b·∫£n sau:
Oxi trong kh√¥ng kh√≠ l√Ý s·∫£n ph·∫©m c·ªßa qu√° tr√¨nh ‚Ķ(1). C√¢y xanh l√Ý nh√Ý m√°y s·∫£n xu·∫•t cacbohiƒërat v√Ý oxi t·ª´ cacbon ƒëioxit v√Ý n∆∞·ªõc d∆∞·ªõi t√°c d·ª•ng c·ªßa ‚Ķ(2)‚Ķ m·∫∑t tr·ªùi. Nh·ªù s·ª± quang h·ª£p c·ªßa c√¢y xanh m√Ý l∆∞·ª£ng kh√≠ oxi trong kh√¥ng kh√≠ h·∫ßu nh∆∞ ‚Ķ(3).
A. (1) quang hợp, (2) ánh sáng, (3) không đổi.
B. (1) hô hấp, (2) ánh sáng, (3) không đổi.
C. (1) quang hợp, (2) nhiệt, (3) thay đổi.
D. (1) hô hấp, (2) năng lượng, (3) thay đổi.
C√¢u 9: Cho h·ªón h·ª£p X g·ªìm Fe(56) v√Ý Mg(24) v√Ýo dung d·ªãch HCl v·ª´a ƒë·ªß th√¨ ƒë∆∞·ª£c 0,224l√≠t hydro(ƒëktc). M·∫∑t kh√°c A t√°c d·ª•ng v·ª´a ƒë·ªß v·ªõi 0,28l√≠t clo (ƒëktc). Th√Ýnh ph·∫ßn % kh·ªëi l∆∞·ª£ng Mg trong X l√Ý:
A. 70%. B. 30%. C. 43%. D. 57%.
C√¢u 10: Tr·ªôn 22,4 gam b·ªôt Fe v·ªõi 9,6 gam b·ªôt S r·ªìi nung trong ƒëi·ªÅu ki·ªán kh√¥ng c√≥ kh√¥ng kh√≠ ƒë·∫øn khi ph·∫£n ·ª©ng ho√Ýn to√Ýn, thu ƒë∆∞·ª£c ch·∫•t r·∫Øn X. Ho√Ý tan X b·∫±ng dung d·ªãch H2SO4 lo√£ng d∆∞ thu ƒë∆∞·ª£c kh√≠ Y. ƒê·ªët ch√°y ho√Ýn to√Ýn Y c·∫ßn V l√≠t O2 (ƒëktc). Gi√° tr·ªã c·ªßa V l√Ý.
A. 11,20. B. 8,96. C. 13,44. D. 15,68.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 26 của đề thi số 2 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 2
I. Trắc nghiệm:
|
1B |
2A |
3D |
4C |
5A |
6B |
|
7B |
8A |
9B |
10C |
11D |
12C |
|
13D |
14D |
15A |
16C |
17C |
18D |
|
19A |
20A |
21B |
22C |
23D |
24B |
ĐỀ SỐ 3
I. Trắc nghiệm:
C√¢u 1: T·ªëc ƒë·ªô ph·∫£n ·ª©ng l√Ý :
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
C. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C√¢u 2: Khi b·∫Øt ƒë·∫ßu ph·∫£n ·ª©ng, n·ªìng ƒë·ªô m·ªôt ch·∫•t l√Ý 0,024 mol/l . Sau 10 gi√¢y x·∫£y ra ph·∫£n ·ª©ng, n·ªìng ƒë·ªô c·ªßa ch·∫•t ƒë√≥ l√Ý 0,022 mol/l. T·ªëc ƒë·ªô ph·∫£n ·ª©ng trong tr∆∞·ªùng h·ª£p n√Ýy l√Ý :
A. 0,015 mol/l.s. B. 0,025 mol/l.s. C. 0,03 mol/l.s. D. 0,02 mol/l.s.
Câu 3: Chia một dung dịch nước brom có màu vàng làm 2 phần:
- Dẫn khí X không màu vào phần 1 thì dung dịch mất màu
- Dẫn khí Y không màu vào phần 2 thì dung dịch sẫm màu hơn.
Khí X và Y có thể lần lượt là:
A. N2 vaÃÄ CO2. B. SO2 vaÃÄ CO2. C. SO2 vaÃÄ Cl2. D. SO2 vaÃÄ HI.
C√¢u 4: Cho 0,448 l√≠t Clo (ƒëktc) v√Ýo dung d·ªãch NaX d∆∞, ƒë∆∞·ª£c 5,08 gam X2. Nguy√™n t·ªë X l√Ý:
A. Br. B. I. C. Cl. D. F.
C√¢u 5: Tr·ªôn 22,4 gam b·ªôt Fe v·ªõi 9,6 gam b·ªôt S r·ªìi nung trong ƒëi·ªÅu ki·ªán kh√¥ng c√≥ kh√¥ng kh√≠ ƒë·∫øn khi ph·∫£n ·ª©ng ho√Ýn to√Ýn, thu ƒë∆∞·ª£c ch·∫•t r·∫Øn X. Ho√Ý tan X b·∫±ng dung d·ªãch H2SO4 lo√£ng d∆∞ thu ƒë∆∞·ª£c kh√≠ Y. ƒê·ªët ch√°y ho√Ýn to√Ýn Y c·∫ßn V l√≠t O2 (ƒëktc). Gi√° tr·ªã c·ªßa V l√Ý.
A. 15,68. B. 8,96. C. 13,44. D. 11,20.
C√¢u 6: Cho h·ªón h·ª£p X g·ªìm Fe(56) v√Ý Mg(24) v√Ýo dung d·ªãch HCl v·ª´a ƒë·ªß th√¨ ƒë∆∞·ª£c 0,224l√≠t hydro(ƒëktc). M·∫∑t kh√°c A t√°c d·ª•ng v·ª´a ƒë·ªß v·ªõi 0,28l√≠t clo (ƒëktc). Th√Ýnh ph·∫ßn % kh·ªëi l∆∞·ª£ng Mg trong X l√Ý:
A. 43%. B. 57%. C. 30%. D. 70%.
C√¢u 7: S·ª•c t·ª´ t·ª´ 2,24 lit SO2 (ƒëkc) v√Ýo 1C√¢u ml dung d·ªãch NaOH 3M. C√°c ch·∫•t c√≥ trong dung d·ªãch sau ph·∫£n ·ª©ng?
A. Na2SO3, H2O. B. Na2SO3, NaHSO3, H2O.
C. Na2SO3, NaOH, H2O. D. NaHSO3,H2O.
Câu 8: Trong hệ phản ứng ở trạng thái cân bằng: 2SO2 (k) + O2 (k) ⇔ 2SO3 (k) ( H<0)
Nồng độ của SO3 sẽ tăng, nếu :
A. tăng nhiệt độ. B. giảm nồng độ của SO2.
C. giảm nồng độ của O2. D. tăng nồng độ của SO2.
C√¢u 9: C√°c s·ªë oxi h√≥a c√≥ th·ªÉ c√≥ c·ªßa l∆∞u hu·ª≥nh l√Ý
A. - 2; +4: +6. B. - 2; 0; +4; +6. C. 0; +2; +4;+6. D. 0; +4; +6.
Câu 10: Cho các phát biểu sau:
(1): Khi thu khí oxi bằng phương pháp đẩy không khí, ta phải đặt miệng bình úp xuống
(2): Các phản ứng hóa học có lưu huỳnh tham gia đều phải đun nóng
(3): Ozon có tính oxi hóa mạnh hơn oxi vì ozon dễ bị phân hủy sinh ra oxi nguyên tử
(4): Ozon dễ tan trong nước hơn so với oxi do phân tử ozon kém phân cực hơn oxi
(5): Oxi phản ứng với hầu hết các phi kim, trừ nhóm halogen
S·ªë ph√°t bi·ªÉu ƒë√∫ng l√Ý.
A. 2. B. 3. C. 4. D. 5.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 26 của đề thi số 3 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 3
I. Trắc nghiệm:
|
1C |
2D |
3B |
4B |
5A |
6D |
|
7A |
8B |
9A |
10B |
11C |
12D |
|
13A |
14A |
15C |
16A |
17C |
18B |
|
19D |
20D |
21C |
22B |
23C |
24D |
ĐỀ SỐ 4
I. Trắc nghiệm:
Câu 1: Cho các phản ứng:
(1) SiO2 + dung dịch HF →
(2) F2 + H2O
(3) AgBr
(4) Br2 + NaI (d∆∞) ‚Üí
Trong c√°c ph·∫£n ·ª©ng tr√™n, nh·ªØng ph·∫£n ·ª©ng c√≥ t·∫°o ra ƒë∆°n ch·∫•t l√Ý
A. (1), (3), (4). B. (1), (2), (3). C. (2), (3), (4). D. (1), (2), (4).
Câu 2: Cho các phát biểu sau:
(1): Khi thu khí oxi bằng phương pháp đẩy không khí, ta phải đặt miệng bình úp xuống
(2): Các phản ứng hóa học có lưu huỳnh tham gia đều phải đun nóng
(3): Ozon có tính oxi hóa mạnh hơn oxi vì ozon dễ bị phân hủy sinh ra oxi nguyên tử
(4): Ozon dễ tan trong nước hơn so với oxi do phân tử ozon kém phân cực hơn oxi
(5): Oxi phản ứng với hầu hết các phi kim, trừ nhóm halogen
S·ªë ph√°t bi·ªÉu ƒë√∫ng l√Ý.
A. 4. B. 3. C. 5. D. 2.
C√¢u 3: C√≥ m·ªôt h·ªón h·ª£p kh√≠ g·ªìm oxi v√Ý ozon. H·ªón h·ª£p kh√≠ n√Ýy c√≥ t·ªâ kh·ªëi so v·ªõi H2 l√Ý 18. Th√Ýnh ph·∫ßn ph·∫ßn trƒÉm theo th·ªÉ t√≠ch c·ªßa oxi v√Ý ozon trong h·ªón h·ª£p kh√≠ l·∫ßn l∆∞·ª£t l√Ý
A. 60% v√Ý 40%. B. 75% v√Ý 25%. C. 25% v√Ý 75%. D. 80% v√Ý 20%.
C√¢u 4: Cho 0,448 l√≠t Clo (ƒëktc) v√Ýo dung d·ªãch NaX d∆∞, ƒë∆∞·ª£c 5,08 gam X2. Nguy√™n t·ªë X l√Ý:
A. Br. B. I. C. F. D. Cl.
Câu 5: Ở nhiệt độ không đổi, hệ cân bằng sẽ dịch chuyển về bên phải nếu tăng áp suất
A. 2H2(k) + O2(k) ‚áî 2H2O(k).
B. 2CO2(k) ‚áî 2CO(k) + O2(k)
C. 2NO(k) ‚áî N2(k) + O2(k)
D. 2SO3(k) ‚áî 2SO2(k) + O2(k)
C√¢u 6: T·ªëc ƒë·ªô ph·∫£n ·ª©ng l√Ý :
A. Độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian.
B. Độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian.
C. Độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian.
D. Độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian.
C√¢u 7: ƒêi·ªÅn t·ª´ th√≠ch h·ª£p v√Ýo ch·ªó tr·ªëng trong ƒëo·∫°n vƒÉn b·∫£n sau:
Oxi trong kh√¥ng kh√≠ l√Ý s·∫£n ph·∫©m c·ªßa qu√° tr√¨nh ‚Ķ(1). C√¢y xanh l√Ý nh√Ý m√°y s·∫£n xu·∫•t cacbohiƒërat v√Ý oxi t·ª´ cacbon ƒëioxit v√Ý n∆∞·ªõc d∆∞·ªõi t√°c d·ª•ng c·ªßa ‚Ķ(2)‚Ķ m·∫∑t tr·ªùi. Nh·ªù s·ª± quang h·ª£p c·ªßa c√¢y xanh m√Ý l∆∞·ª£ng kh√≠ oxi trong kh√¥ng kh√≠ h·∫ßu nh∆∞ ‚Ķ(3).
A. (1) quang hợp, (2) ánh sáng, (3) không đổi.
B. (1) hô hấp, (2) ánh sáng, (3) không đổi.
C. (1) quang hợp, (2) nhiệt, (3) thay đổi.
D. (1) hô hấp, (2) năng lượng, (3) thay đổi.
C√¢u 8: Cho h·ªón h·ª£p X g·ªìm Fe(56) v√Ý Mg(24) v√Ýo dung d·ªãch HCl v·ª´a ƒë·ªß th√¨ ƒë∆∞·ª£c 0,224l√≠t hydro(ƒëktc). M·∫∑t kh√°c A t√°c d·ª•ng v·ª´a ƒë·ªß v·ªõi 0,28l√≠t clo (ƒëktc). Th√Ýnh ph·∫ßn % kh·ªëi l∆∞·ª£ng Mg trong X l√Ý:
A. 70%. B. 30%. C. 43%. D. 57%.
Câu 9: Trong hệ phản ứng ở trạng thái cân bằng: 2SO2 (k) + O2 (k) ⇔ 2SO3 (k) ( H<0)
Nồng độ của SO3 sẽ tăng, nếu :
A. tăng nồng độ của SO2. B. tăng nhiệt độ.
C. giảm nồng độ của O2. D. giảm nồng độ của SO2.
C√¢u 10: C√°c s·ªë oxi h√≥a c√≥ th·ªÉ c√≥ c·ªßa l∆∞u hu·ª≥nh l√Ý
A. 0; +4; +6. B. - 2; 0; +4; +6. C. - 2; +4: +6. D. 0; +2; +4;+6.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 26 của đề thi số 4 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐÁP ÁN ĐỀ SỐ 4
I. Trắc nghiệm:
|
1D |
2D |
3D |
4B |
5C |
6C |
|
7C |
8D |
9B |
10A |
11B |
12B |
|
13A |
14A |
15B |
16C |
17D |
18D |
|
19A |
20C |
21C |
22A |
23A |
24B |
ĐỀ SỐ 5
I. Trắc nghiệm: (6 điểm)
C√¢u 1: Ph·∫£n ·ª©ng ƒëi·ªÅu ch·∫ø kh√≠ clo trong ph√≤ng th√≠ nghi·ªám l√Ý:
A. 2NaCl 2Na + Cl2 . B. F2 + 2NaCl 2NaF + Cl2 .
C. 4HCl + MnO2 MnCl2 + 2H2O + Cl2 . D. 2HCl H2 + Cl2.
C√¢u 2: Ch·∫•t ƒÉn m√≤n th·ªßy tinh l√Ý:
A. KF. B. HF. C. F2. D. HI.
C√¢u 3: Khi nung n√≥ng, iot bi·∫øn th√Ýnh h∆°i kh√¥ng qua tr·∫°ng th√°i l·ªèng. Hi·ªán t∆∞·ª£ng n√Ýy ƒë∆∞·ª£c g·ªçi l√Ý
A. sự bay hơi. B. sự chuyển trạng thái. C. sự thăng hoa. D. sự phân hủy.
Câu 4: Cho các phản ứng: (1) SiO2 + dung dịch HF → (2) F2 + H2O
(3) AgBr (4) Br2 + NaI (d∆∞) ‚Üí
Trong c√°c ph·∫£n ·ª©ng tr√™n, nh·ªØng ph·∫£n ·ª©ng c√≥ t·∫°o ra ƒë∆°n ch·∫•t l√Ý
A. (1), (2), (3). B. (1), (3), (4). C. (2), (3), (4). D. (1), (2), (4).
Câu 5: Chia một dung dịch nước brom có màu vàng làm 2 phần:
- Dẫn khí X không màu vào phần 1 thì dung dịch mất màu
- Dẫn khí Y không màu vào phần 2 thì dung dịch sẫm màu hơn.
Khí X và Y có thể lần lượt là:
A. SO2 vaÃÄ HI. B. N2 vaÃÄ CO2. C. SO2 vaÃÄ Cl2. D. SO2 vaÃÄ CO2.
C√¢u 6: Cho 0,5 mol KOH t√°c d·ª•ng v·ªõi 0,5mol HCl.Cho qu√¨ t√≠m v√Ýo dung d·ªãch sau ph·∫£n ·ª©ng, qu√¨ t√≠m chuy·ªÉn sang m√Ýu:
A. h·ªìng. B. kh√¥ng ƒë·ªïi m√Ýu. C. ƒë·ªè. D. xanh.
C√¢u 7: S·ª•c t·ª´ t·ª´ 2,24 lit SO2 (ƒëkc) v√Ýo 1C√¢u ml dung d·ªãch NaOH 3M. C√°c ch·∫•t c√≥ trong dung d·ªãch sau ph·∫£n ·ª©ng?
A. Na2SO3, NaOH, H2O. B. NaHSO3,H2O.
C. Na2SO3, H2O. D. Na2SO3, NaHSO3, H2O.
C√¢u 8: Cho h·ªón h·ª£p X g·ªìm Fe(56) v√Ý Mg(24) v√Ýo dung d·ªãch HCl v·ª´a ƒë·ªß th√¨ ƒë∆∞·ª£c 0,224l√≠t hydro(ƒëktc). M·∫∑t kh√°c A t√°c d·ª•ng v·ª´a ƒë·ªß v·ªõi 0,28l√≠t clo (ƒëktc). Th√Ýnh ph·∫ßn % kh·ªëi l∆∞·ª£ng Mg trong X l√Ý:
A. 30%. B. 43%. C. 70%. D. 57%.
C√¢u 9: Cho 0,448 l√≠t Clo (ƒëktc) v√Ýo dung d·ªãch NaX d∆∞, ƒë∆∞·ª£c 5,08 gam X2. Nguy√™n t·ªë X l√Ý:
A. F. B. Cl. C. Br. D. I.
C√¢u 10: C√°c s·ªë oxi h√≥a c√≥ th·ªÉ c√≥ c·ªßa l∆∞u hu·ª≥nh l√Ý
A. - 2; 0; +4; +6. B. 0; +2; +4;+6. C. - 2; +4: +6. D. 0; +4; +6.
---(Nội dung đầy đủ, chi tiết từ câu 11 đến câu 26 của đề thi số 5 vui lòng xem tại online hoặc đăng nhập để tải về máy)---
Tr√™n ƒë√¢y l√Ý m·ªôt ph·∫ßn tr√≠ch d·∫´n n·ªôi dung B·ªô 5 ƒë·ªÅ thi HK2 m√¥n H√≥a h·ªçc 10 c√≥ ƒë√°p √°n nƒÉm 2021 Tr∆∞·ªùng THPT Y√™n L·∫°c 2. ƒê·ªÉ xem to√Ýn b·ªô n·ªôi dung c√°c em ƒëƒÉng nh·∫≠p v√Ýo trang hoc247.net ƒë·ªÉ t·∫£i t√Ýi li·ªáu v·ªÅ m√°y t√≠nh.
Hy v·ªçng t√Ýi li·ªáu n√Ýy s·∫Ω gi√∫p c√°c em h·ªçc sinh √¥n t·∫≠p t·ªët v√Ý ƒë·∫°t th√Ýnh t√≠ch cao trong h·ªçc t·∫≠p.
Ngo√Ýi ra c√°c em c√≥ th·ªÉ tham kh·∫£o th√™m m·ªôt s·ªë t∆∞ li·ªáu c√πng chuy√™n m·ª•c t·∫°i ƒë√¢y:
- Đề thi HK2 môn Hóa học 10 năm 2020 Trường THPT Đầm Dơi
- Bộ đề thi HK2 môn Hóa học 10 năm 2020 Trường THPT Lê Trung Đình
- Bộ đề thi HK2 môn Hóa học 10 năm 2019-2020 Trường THPT Lý Yên
Chúc các em học tốt!
T√Ýi li·ªáu li√™n quan
Tư liệu nổi bật tuần
- Xem thêm


