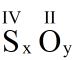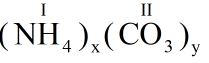Mб»қi cГЎc em hб»Қc sinh cГ№ng tham khбәЈo nб»ҷi dung BГ i 7: HoГЎ trб»Ӣ vГ cГҙng thб»©c hoГЎ hб»Қc mГҙn Khoa hб»Қc tб»ұ nhiГӘn 7 SGK ChГўn trб»қi sГЎng tбәЎo Д‘Ж°б»Јc trГ¬nh bГ y bГӘn dЖ°б»ӣi Д‘Гўy Д‘б»ғ Д‘i tГ¬m cГўu trбәЈ lб»қi cho cГЎc cГўu hб»Ҹi sau: CГЎc nguyГӘn tб»ӯ liГӘn kбәҝt vб»ӣi nhau theo nguyГӘn tбәҜc nГ o? Bбәұng cГЎch nГ o Д‘б»ғ lбәӯp Д‘Ж°б»Јc cГҙng thб»©c hГіa hб»Қc của cГЎc chбәҘt?
Hy vб»Қng Д‘Гўy lГ tГ i liб»Үu hб»Ҝu Гӯch phб»Ҙc vб»Ҙ cho viб»Үc hб»Қc tбәӯp của cГЎc em!
TГіm tбәҜt lГҪ thuyбәҝt
1.1. HГіa trб»Ӣ
a. KhГЎi niб»Үm hГіa trб»Ӣ
- Trong hб»Јp chбәҘt cб»ҷng hГіa trб»Ӣ, cГЎc nguyГӘn tб»ӯ liГӘn kбәҝt vб»ӣi nhau bбәұng liГӘn kбәҝt cб»ҷng hГіa trб»Ӣ.
- HГіa trб»Ӣ của mб»ҷt nguyГӘn tб»‘ trong hб»Јp chбәҘt lГ con sб»‘ biб»ғu thб»Ӣ khбәЈ nДғng liГӘn kбәҝt của nguyГӘn tб»ӯ nguyГӘn tб»‘ Д‘Гі vб»ӣi nguyГӘn tб»ӯ khГЎc trong phГўn tб»ӯ (HГіa trб»Ӣ Д‘Ж°б»Јc biб»ғu thб»Ӣ bбәұng sб»‘ La MГЈ: I, II,...).
HГ¬nh 7.1. HГ¬nh mГҙ phб»Ҹng mб»ҷt sб»‘ phГўn tб»ӯ
b. XГЎc Д‘б»Ӣnh hoГЎ trб»Ӣ
- XГЎc Д‘б»Ӣnh hГіa trб»Ӣ của mб»ҷt nguyГӘn tб»‘ trong hб»Јp chбәҘt cб»ҷng hГіa trб»Ӣ bбәұng cГЎch dб»ұa vГ o hГіa trб»Ӣ của nguyГӘn tб»‘ Д‘ГЈ biбәҝt lГ m Д‘ЖЎn vб»Ӣ:
+ HГіa trб»Ӣ của H lГ I
+ HГіa trб»Ӣ của O lГ II
VГӯ dб»Ҙ: Trong phГўn tб»ӯ methane, nguyГӘn tб»ӯ C liГӘn kбәҝt vб»ӣi 4 nguyГӘn tб»ӯ H, trong phГўn tб»ӯ carbon dioxide, nguyГӘn tб»ӯ C liГӘn kбәҝt vб»ӣi 2 nguyГӘn tб»ӯ O, ngЖ°б»қi ta nГіi hГіa trб»Ӣ của nguyГӘn tб»ӯ C bбәұng IV.
1.2. Quy tбәҜc hГіa trб»Ӣ
- Trong phГўn tб»ӯ hб»Јp chбәҘt, sб»‘ nguyГӘn tб»ӯ của mб»—i nguyГӘn tб»‘ phб»Ҙ thuб»ҷc vГ o hoГЎ trб»Ӣ của chГәng.
- HoГЎ trб»Ӣ vГ sб»‘ nguyГӘn tб»ӯ của cГЎc nguyГӘn tб»‘ trong mб»ҷt sб»‘ hб»Јp chбәҘt tuГўn theo mб»ҷt quy tбәҜc nhбәҘt Д‘б»Ӣnh, gб»Қi lГ quy tбәҜc hoГЎ trб»Ӣ.
- Quy tбәҜc hoГЎ trб»Ӣ: Trong phГўn tб»ӯ hб»Јp chбәҘt hai nguyГӘn tб»‘, tГӯch hГіa trб»Ӣ vГ sб»‘ nguyГӘn tб»ӯ của nguyГӘn tб»‘ nГ y bбәұng tГӯch hГіa trб»Ӣ vГ sб»‘ nguyГӘn tб»ӯ của nguyГӘn tб»‘ kia.
1.3. CГҙng thб»©c hГіa hб»Қc
- PhГўn tб»ӯ của chбәҘt Д‘Ж°б»Јc tбәЎo thГ nh tб»« nguyГӘn tб»ӯ của mб»ҷt nguyГӘn tб»‘ vГ Д‘Ж°б»Јc biб»ғu diб»…n bбәұng cГҙng thб»©c hoГЎ hб»Қc.
a. CГҙng thб»©c hoГЎ hб»Қc của Д‘ЖЎn chбәҘt
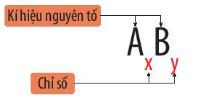
- CГҙng thб»©c hoГЎ hб»Қc của Д‘ЖЎn chбәҘt Д‘Ж°б»Јc biб»ғu diб»…n bбәұng kГӯ hiб»Үu nguyГӘn tб»‘ hoГЎ hб»Қc kГЁm vб»ӣi chб»ү sб»‘ ghi б»ҹ phГӯa dЖ°б»ӣi, bГӘn phбәЈi kГӯ hiб»Үu.
|
ДҗЖЎn chбәҘt |
CГҙng thб»©c hГіa hб»Қc (CTHH) |
|
Mб»ҷt sб»‘ Д‘ЖЎn chбәҘt phi kim thб»ғ khГӯ (б»ҹ Д‘iб»Ғu kiб»Үn thЖ°б»қng) |
- CTHH: Ax - VГӯ dб»Ҙ: PhГўn tб»ӯ khГӯ hydrogen Д‘Ж°б»Јc tбәЎo thГ nh tб»« 2 nguyГӘn tб»ӯ hydrogen liГӘn kбәҝt vб»ӣi nhau, CTHH lГ H2 |
|
Mб»ҷt sб»‘ Д‘ЖЎn chбәҘt phi kim thб»ғ rбәҜn ДҗЖЎn chбәҘt kim loбәЎi |
- CTHH: kГӯ hiб»Үu hoГЎ hб»Қc của nguyГӘn tб»‘ - VГӯ dб»Ҙ: CTHH của Д‘ЖЎn chбәҘt carbon, phosphorus, ...tЖ°ЖЎng б»©ng lГ C, P. Kim loбәЎi sodium cГі CTHH lГ Na, kim loбәЎi potassium cГі CTHH lГ K. |
b. CГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt
- CГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt gб»“m kГӯ hiб»Үu hoГЎ hб»Қc của nhб»Ҝng nguyГӘn tб»‘ tбәЎo thГ nh kГЁm chб»ү sб»‘ б»ҹ phГӯa dЖ°б»ӣi, bГӘn phбәЈi kГӯ hiб»Үu (HГ¬nh 7.3).
HГ¬nh 7.3. CГЎch biб»ғu diб»…n cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt gб»“m 2 nguyГӘn tб»‘
VГӯ dб»Ҙ: PhГўn tб»ӯ nЖ°б»ӣc gб»“m 2 nguyГӘn tб»ӯ hydrogen vГ 1 nguyГӘn tб»ӯ oxygen, cГҙng thб»©c hoГЎ hб»Қc của phГўn tб»ӯ nЖ°б»ӣc lГ H2O.
HГ¬nh 7.4. HГ¬nh mГҙ phб»Ҹng phГўn tб»ӯ nЖ°б»ӣc vГ cГЎch biб»ғu diб»…n cГҙng thб»©c hoГЎ hб»Қc
của phГўn tб»ӯ nЖ°б»ӣc
- CГҙng thб»©c hГіa hб»Қc của hб»Јp chбәҘt tбәЎo bб»ҹi:
+ Oxygen vГ nguyГӘn tб»‘ khГЎc cГі dбәЎng: AxOy
+ A lГ kim loбәЎi vГ B lГ phi kim cГі dбәЎng: AxBy
+ Hydrogen vГ nguyГӘn tб»‘ A cГі dбәЎng: AHx (nбәҝu A thuб»ҷc cГЎc nhГіm IA Д‘бәҝn VA), HxA (nбәҝu A thuб»ҷc cГЎc nhГіm VIA Д‘бәҝn VIIA).
1.4. TГӯnh phбә§n trДғm nguyГӘn tб»‘ trong hб»Јp chбәҘt
- Phбә§n trДғm (%) nguyГӘn tб»‘ trong hб»Јp chбәҘt = khб»‘i lЖ°б»Јng của nguyГӘn tб»‘ trong mб»ҷt phГўn tб»ӯ hб»Јp chбәҘt : khб»‘i lЖ°б»Јng phГўn tб»ӯ (KLPT) của hб»Јp chбәҘt
- Khб»‘i lЖ°б»Јng của nguyГӘn tб»‘ trong mб»ҷt phГўn tб»ӯ hб»Јp chбәҘt = khб»‘i lЖ°б»Јng nguyГӘn tб»ӯ (KLNT). sб»‘ nguyГӘn tб»ӯ của nguyГӘn tб»‘
Vб»ӣi hб»Јp chбәҘt AxBy: \({\rm{\% A = }}\frac{{{\rm{KLNT(A)}}{\rm{.x}}}}{{{\rm{KLPT(}}{{\rm{A}}_{\rm{x}}}{{\rm{B}}_{\rm{y}}}{\rm{)}}}}{\rm{.100\% }}\)
- Tб»•ng tбәҘt cбәЈ cГЎc phбә§n trДғm nguyГӘn tб»‘ trong mб»ҷt phбә§n tб»ӯ luГҙn bбәұng 100%
VГӯ dб»Ҙ: TГӯnh phбә§n trДғm nguyГӘn tб»‘ oxygen trong phГўn tб»ӯ nitric acid cГі cГҙng thб»©c hoГЎ hб»Қc lГ HNO3.
\({\rm{\% O = }}\frac{{{\rm{KLNT(O)}}{\rm{.3}}}}{{{\rm{KLPT(HN}}{{\rm{O}}_{\rm{3}}}{\rm{)}}}}{\rm{.100\% = }}\frac{{{\rm{16}}{\rm{.3}}}}{{{\rm{1 + 14 + 16}}{\rm{.3}}}}{\rm{.100\% = }}76,19\% \)
1.5. XГЎc Д‘б»Ӣnh cГҙng thб»©c hГіa hб»Қc
a. XГЎc Д‘б»Ӣnh CTHH dб»ұa vГ o phбә§n trДғm nguyГӘn tб»‘ vГ khб»‘i lЖ°б»Јng phГўn tб»ӯ
- BЖ°б»ӣc 1: Дҗбә·t cГҙng thб»©c hoГЎ hб»Қc cбә§n tГ¬m cГҙng thб»©c tб»•ng quГЎt
- BЖ°б»ӣc 2: Lбәӯp biб»ғu thб»©c tГӯnh phбә§n trДғm nguyГӘn tб»‘ cГі trong hб»Јp chбәҘt
- BЖ°б»ӣc 3: XГЎc Д‘б»Ӣnh sб»‘ nguyГӘn tб»ӯ của mб»—i nguyГӘn tб»‘ vГ viбәҝt cГҙng thб»©c hoГЎ hб»Қc cбә§n tГ¬m
VГӯ dб»Ҙ: Mб»ҷt hб»Јp chбәҘt cГі cГҙng thб»©c NxOy, trong Д‘Гі N chiбәҝm 63,64%. Khб»‘i lЖ°б»Јng phГўn tб»ӯ hб»Јp chбәҘt lГ 44 amu. XГЎc Д‘б»Ӣnh cГҙng thб»©c hб»Қ hб»Қc của hб»Јp chбәҘt.
Ta cГі: %O = 100% вҖ“ %N = 100% вҖ“ 63,64% = 36,36%
\(\begin{array}{l}
{\rm{\% N = }}\frac{{{\rm{KLNT(N)}}{\rm{.x}}}}{{{\rm{KLPT(}}{{\rm{N}}_{\rm{x}}}{{\rm{O}}_{\rm{y}}}{\rm{)}}}}{\rm{.100\% = }}\frac{{14.{\rm{x}}}}{{44}}{\rm{.100\% = }}63,64\% \\
= > {\rm{ x}} \approx {\rm{ 2}}\\
{\rm{\% O = }}\frac{{{\rm{KLNT(O)}}{\rm{.y}}}}{{{\rm{KLPT(}}{{\rm{N}}_{\rm{x}}}{{\rm{O}}_{\rm{y}}}{\rm{)}}}}{\rm{.100\% = }}\frac{{16.{\rm{y}}}}{{44}}{\rm{.100\% = }}36,36\% \\
= > {\rm{ y}} \approx {\rm{ 1}}
\end{array}\)
CГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt lГ N2O.
b. XГЎc Д‘б»Ӣnh CTHH dб»ұa vГ o quy tбәҜc hГіa trб»Ӣ
- BЖ°б»ӣc 1: Дҗбә·t cГҙng thб»©c hoГЎ hб»Қc cбә§n tГ¬m (cГҙng thб»©c tб»•ng quГЎt)
- BЖ°б»ӣc 2: Lбәӯp biб»ғu thб»©c tГӯnh dб»ұa vГ o quy tбәҜc hoГЎ trб»Ӣ, chuyб»ғn thГ nh tб»ү lб»Ү cГЎc chб»ү sб»‘ nguyГӘn tб»ӯ
- BЖ°б»ӣc 3: XГЎc Д‘б»Ӣnh sб»‘ nguyГӘn tб»ӯ (nhб»Ҝng sб»‘ nguyГӘn Д‘ЖЎn giбәЈn nhбәҘt, cГі tб»ү lб»Ү tб»‘i giбәЈn) vГ viбәҝt cГҙng thб»©c hoГЎ hб»Қc cбә§n tГ¬m.
Vб»ӣi cГҙng thб»©c hoГЎ hб»Қc chung: 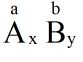
Theo quy tбәҜc hoГЎ trб»Ӣ ta cГі: a.x = b.y (2)
Dб»ұa vГ o (2) tГӯnh Д‘Ж°б»Јc tб»ү lб»Ү \(\frac{{\rm{x}}}{{\rm{y}}}\) tб»« Д‘Гі suy ra cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt.
VГӯ dб»Ҙ: XГЎc Д‘б»Ӣnh cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt sulfur dioxide cГі cбәҘu tбәЎo tб»« S hoГЎ trб»Ӣ IV vГ O.
- BЖ°б»ӣc 1: CГҙng thб»©c hoГЎ hб»Қc chung:
- BЖ°б»ӣc 2: Theo quy tбәҜc hoГЎ trб»Ӣ, ta cГі: x.IV = y.II
Chuyб»ғn thГ nh tб»ү lб»Ү: \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{IV}}}}{\rm{ = }}\frac{{\rm{2}}}{{\rm{4}}}{\rm{ = }}\frac{{\rm{1}}}{{\rm{2}}}\)
- BЖ°б»ӣc 3: Chб»ү sб»‘ nguyГӘn tб»ӯ trong phГўn tб»ӯ lГ nhб»Ҝng sб»‘ nguyГӘn Д‘ЖЎn giбәЈn nhбәҘt vГ cГі tб»ү lб»Ү tб»‘i giбәЈn; vбәӯy x = 1, y = 2. CГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt nГ y lГ SO2.
|
1. HГіa trб»Ӣ của mб»ҷt nguyГӘn tб»‘ trong hб»Јp chбәҘt lГ con sб»‘ biб»ғu thб»Ӣ khбәЈ nДғng liГӘn kбәҝt của nguyГӘn tб»ӯ nguyГӘn tб»‘ Д‘Гі vб»ӣi nguyГӘn tб»ӯ khГЎc trong phГўn tб»ӯ. 2. Quy tбәҜc hoГЎ trб»Ӣ: Trong phГўn tб»ӯ hб»Јp chбәҘt hai nguyГӘn tб»‘, tГӯch hГіa trб»Ӣ vГ sб»‘ nguyГӘn tб»ӯ của nguyГӘn tб»‘ nГ y bбәұng tГӯch hГіa trб»Ӣ vГ sб»‘ nguyГӘn tб»ӯ của nguyГӘn tб»‘ kia. 3. CГҙng thб»©c hoГЎ hб»Қc dГ№ng Д‘б»ғ biб»ғu diб»…n chбәҘt, gб»“m mб»ҷt hoбә·c nhiб»Ғu kГӯ hiб»Үu nguyГӘn tб»‘ vГ chб»ү sб»‘ б»ҹ phГӯa dЖ°б»ӣi, bГӘn phбәЈi kГӯ hiб»Үu. - CГҙng thб»©c chung của phГўn tб»ӯ cГі dбәЎng: AxBy,... - CГҙng thб»©c hoГЎ hб»Қc cho biбәҝt: thГ nh phбә§n nguyГӘn tб»‘, sб»‘ lЖ°б»Јng nguyГӘn tб»ӯ của mб»—i nguyГӘn tб»‘ cГі trong phбә§n tб»ӯ Д‘Гі, khб»‘i lЖ°б»Јng phГўn tб»ӯ 4. TГӯnh phбә§n trДғm nguyГӘn tб»‘ trong hб»Јp chбәҘt Hб»Јp chбәҘt AxBy: \({\rm{\% A = }}\frac{{{\rm{KLNT(A)}}{\rm{.x}}}}{{{\rm{KLPT(}}{{\rm{A}}_{\rm{x}}}{{\rm{B}}_{\rm{y}}}{\rm{)}}}}{\rm{.100\% }}\) 5. XГЎc Д‘б»Ӣnh cГҙng thб»©c hГіa hб»Қc - Dб»ұa vГ o phбә§n trДғm nguyГӘn tб»‘ vГ khб»‘i lЖ°б»Јng phГўn tб»ӯ - Dб»ұa vГ o quy tбәҜc hГіa trб»Ӣ |
BГ i tбәӯp minh hб»Қa
BГ i 1: ДҗЖ°б»қng glucose lГ nguб»“n cung cбәҘp nДғng lЖ°б»Јng quan trб»Қng cho hoбәЎt Д‘б»ҷng sб»‘ng của con ngЖ°б»қi. ДҗЖ°б»қng glucose cГі cГҙng thб»©c hГіa hб»Қc lГ C6H12O6.
HГЈy cho biбәҝt:
a) Glucose Д‘Ж°б»Јc tбәЎo thГ nh tб»« nhб»Ҝng nguyГӘn tб»‘ nГ o?
b) Khб»‘i lЖ°б»Јng mб»—i nguyГӘn tб»‘ trong mб»ҷt phГўn tб»ӯ glucose lГ bao nhiГӘu?
c) Khб»‘i lЖ°б»Јng phГўn tб»ӯ glucose lГ bao nhiГӘu?
HЖ°б»ӣng dбә«n giбәЈi
a) Glucose Д‘Ж°б»Јc tбәЎo thГ nh tб»« nhб»Ҝng nguyГӘn tб»‘: C, H vГ O
b) NguyГӘn tб»‘ C: CГі 6 nguyГӘn tб»ӯ C (khб»‘i lЖ°б»Јng nguyГӘn tб»ӯ: 12 amu)
вҶ’ Khб»‘i lЖ°б»Јng nguyГӘn tб»‘ C trong 1 phГўn tб»ӯ glucose = 12 amu x 6 = 72 amu
- NguyГӘn tб»‘ H: CГі 12 nguyГӘn tб»ӯ H (khб»‘i lЖ°б»Јng nguyГӘn tб»ӯ: 1 amu)
вҶ’ Khб»‘i lЖ°б»Јng nguyГӘn tб»‘ H trong 1 phГўn tб»ӯ glucose = 1 amu x 12 = 12 amu
- NguyГӘn tб»‘ O: CГі 6 nguyГӘn tб»ӯ O (khб»‘i lЖ°б»Јng nguyГӘn tб»ӯ: 16 amu)
вҶ’ Khб»‘i lЖ°б»Јng nguyГӘn tб»‘ O trong 1 phГўn tб»ӯ glucose = 16 amu x 6 = 96 amu
c) Khб»‘i lЖ°б»Јng phГўn tб»ӯ glucose = khб»‘i lЖ°б»Јng nguyГӘn tб»‘ C + khб»‘i lЖ°б»Јng nguyГӘn tб»‘ H + khб»‘i lЖ°б»Јng nguyГӘn tб»‘ O
= 72 amu + 12 amu + 96 amu = 180 amu
BГ i 2: Hб»Јp chбәҘt (E) lГ oxide của nguyГӘn tб»‘ M cГі hoГЎ trб»Ӣ VI. Biбәҝt (E) cГі khб»‘i lЖ°б»Јng phГўn tб»ӯ bбәұng 80 amu. HГЈy xГЎc Д‘б»Ӣnh cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt (E).
HЖ°б»ӣng dбә«n giбәЈi
- Gб»Қi cГҙng thб»©c hГіa hб»Қc chung của E lГ : MxOy (M cГі hГіa trб»Ӣ VI vГ O cГі hГіa trб»Ӣ II)
- Theo quy tбәҜc hГіa trб»Ӣ ta cГі: x.VI = y.II
Chuyб»ғn vб»Ғ tб»ү lб»Ү: \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{{\rm{VI}}}}{\rm{ = }}\frac{1}{3}\)
- Chб»Қn x = 1; y = 3. Vбәӯy cГҙng thб»©c hГіa hб»Қc của hб»Јp chбәҘt E lГ MO3.
- Khб»‘i lЖ°б»Јng phГўn tб»ӯ của E bбәұng 80:
KLPT(MO3) = KLNT(M) + 16.3 = 80 amu
вҮ’ KLNT (M) = 32 amu. Vбәӯy M lГ S.
CГҙng thб»©c hГіa hб»Қc của hб»Јp chбәҘt E lГ SO3.
BГ i 3: Ammonium carbonate lГ hб»Јp chбәҘt Д‘Ж°б»Јc dГ№ng nhiб»Ғu trong phГІng thГӯ nghiб»Үm, cГҙng nghiб»Үp, nГҙng nghiб»Үp, y tбәҝ, ... NГі cГІn Д‘Ж°б»Јc gб»Қi lГ ammonia của thб»Ј lГ m bГЎnh vГ lГ tiб»Ғn thГўn của cГЎc chбәҘt men hiб»Үn Д‘бәЎi hЖЎn nhЖ° baking soda vГ bб»ҷt nб»ҹ.
a) HГЈy xГЎc Д‘б»Ӣnh cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt ammonium carbonate.
b) TГӯnh phбә§n trДғm (%) của nguyГӘn tб»‘ N trong hб»Јp chбәҘt trГӘn.
HЖ°б»ӣng dбә«n giбәЈi
a) CГҙng thб»©c hГіa hб»Қc chung:
Theo quy tбәҜc hГіa trб»Ӣ, ta cГі: I.x = II.y
Chuyб»ғn vб»Ғ tб»ү lб»Ү: \(\frac{{\rm{x}}}{{\rm{y}}}{\rm{ = }}\frac{{{\rm{II}}}}{{\rm{I}}}{\rm{ = }}\frac{2}{1}\)
Chб»Қn x = 2; y = 1
Vбәӯy cГҙng thб»©c hГіa hб»Қc của hб»Јp chбәҘt lГ (NH4)2CO3
b) Trong (NH4)2CO3 cГі:
\({\rm{\% N = }}\frac{{{\rm{KLNT(N)}}{\rm{.2}}}}{{{\rm{KLPT((N}}{{\rm{H}}_{\rm{4}}}{{\rm{)}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}}{\rm{)}}}}{\rm{.100\% = }}\frac{{14.2}}{{(14 + 1.4).2 + 12 + 16.3}}{\rm{.100\% = 29,2\% }}\)
Luyб»Үn tбәӯp BГ i 7 Khoa hб»Қc tб»ұ nhiГӘn 7 CTST
Hб»Қc xong bГ i hб»Қc nГ y, em cГі thб»ғ:
- TrГ¬nh bГ y Д‘Ж°б»Јc khГЎi niб»Үm vб»Ғ hoГЎ trб»Ӣ (cho chбәҘt cГҙng hoГЎ trб»Ӣ). CГЎch viбәҝt cГҙng thб»©c hoГЎ hб»Қc.
- Viбәҝt Д‘Ж°б»Јc cГҙng thб»©c hoГЎ hб»Қc của mб»ҷt sб»‘ chбәҘt vГ hб»Јp chбәҘt Д‘ЖЎn giбәЈn thГҙng dб»Ҙng.
- NГӘu Д‘Ж°б»Јc mб»‘i liГӘn hб»Ү giб»Ҝa hoГЎ trб»Ӣ của nguyГӘn tб»‘ vб»ӣi cГҙng thб»©c hoГЎ hб»Қc.
- TГӯnh Д‘Ж°б»Јc phбә§n trДғm (%) nguyГӘn tб»‘ trong hб»Јp chбәҘt khi biбәҝt cГҙng thб»©c hoГЎ hб»Қc của nГі.
- XГЎc Д‘б»Ӣnh Д‘Ж°б»Јc cГҙng thб»©c hoГЎ hб»Қc của hб»Јp chбәҘt dб»ұa vГ o phбә§n trДғm nguyб»…n tб»‘ vГ khб»‘i lЖ°б»Јng phГўn tб»ӯ.
3.1. TrбәҜc nghiб»Үm BГ i 7 Khoa hб»Қc tб»ұ nhiГӘn 7 CTST
CГЎc em cГі thб»ғ hб»Ү thб»‘ng lбәЎi nб»ҷi dung kiбәҝn thб»©c Д‘ГЈ hб»Қc Д‘Ж°б»Јc thГҙng qua bГ i kiб»ғm tra TrбәҜc nghiб»Үm Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo Chủ Д‘б»Ғ 2 BГ i 7 cб»ұc hay cГі Д‘ГЎp ГЎn vГ lб»қi giбәЈi chi tiбәҝt.
-
-
A.
HoГЎ trб»Ӣ của nguyГӘn tб»‘ lГ Д‘бәЎi lЖ°б»Јng biб»ғu thб»Ӣ khбәЈ nДғng liГӘn kбәҝt của nguyГӘn tб»ӯ nguyГӘn tб»‘ Д‘Гі vб»ӣi nguyГӘn tб»‘ khГЎc cГі trong phГўn tб»ӯ.
-
B.
HoГЎ trб»Ӣ của nguyГӘn tб»‘ bбәұng sб»‘ nguyГӘn tб»ӯ H liГӘn kбәҝt vб»ӣi nguyГӘn tб»‘ Д‘Гі.
-
C.
HoГЎ trб»Ӣ của nguyГӘn tб»‘ bбәұng sб»‘ nguyГӘn tб»ӯ H vГ nguyГӘn tб»ӯ O liГӘn kбәҝt vб»ӣi nguyГӘn tб»‘ Д‘Гі.
-
D.
HoГЎ trб»Ӣ của nguyГӘn tб»‘ bбәұng sб»‘ nguyГӘn tб»ӯ O liГӘn kбәҝt vб»ӣi nguyГӘn tб»‘ Д‘Гі nhГўn vб»ӣi 2.
-
A.
-
CГўu 2:
PhГЎt biб»ғu nГ o sau Д‘Гўy Д‘Гәng?
-
A.
Trong hб»Јp chбәҘt tбәЎo bб»ҹi C vГ H, hoГЎ trб»Ӣ của nguyГӘn tб»‘ C luГҙn bбәұng IV vГ¬ mб»ҷt nguyГӘn tб»ӯ C luГҙn liГӘn kбәҝt vб»ӣi 4 nguyГӘn tб»ӯ H.
-
B.
Trong chбәҘt cб»ҷng hoГЎ trб»Ӣ, nguyГӘn tб»‘ H luГҙn cГі hoГЎ trб»Ӣ bбәұng I.
-
C.
Trong hб»Јp chбәҘt, nguyГӘn tб»‘ O luГҙn cГі hoГЎ trб»Ӣ bбәұng II.
- D. Trong hб»Јp chбәҘt, nguyГӘn tб»‘ N luГҙn cГі hoГЎ trб»Ӣ bбәұng II.
-
A.
-
CГўu 3:
PhГЎt biб»ғu nГ o sau Д‘Гўy Д‘Гәng?
-
A.
CГҙng thб»©c hoГЎ hб»Қc cho biбәҝt thГ nh phбә§n nguyГӘn tб»‘ vГ sб»‘ nguyГӘn tб»ӯ của chбәҘt.
- B. CГҙng thб»©c hoГЎ hб»Қc dГ№ng Д‘б»ғ biб»ғu diб»…n chбәҘt vГ cho biбәҝt hoГЎ trб»Ӣ của chбәҘt.
-
C.
CГҙng thб»©c hoГЎ hб»Қc dГ№ng Д‘б»ғ biб»ғu diб»…n chбәҘt vГ cho biбәҝt khб»‘i lЖ°б»Јng phГўn tб»ӯ của chбәҘt.
-
D.
CГҙng thб»©c hoГЎ hб»Қc dГ№ng Д‘б»ғ biб»ғu diб»…n cГЎc nguyГӘn tб»‘ cГі trong chбәҘt.
-
A.
CГўu 4-10: Mб»қi cГЎc em Д‘Дғng nhбәӯp xem tiбәҝp nб»ҷi dung vГ thi thб»ӯ Online Д‘б»ғ củng cб»‘ kiбәҝn thб»©c vб»Ғ bГ i hб»Қc nГ y nhГ©!
3.2. BГ i tбәӯp SGK BГ i 7 Khoa hб»Қc tб»ұ nhiГӘn 7 CTST
CГЎc em cГі thб»ғ xem thГӘm phбә§n hЖ°б»ӣng dбә«n GiбәЈi bГ i tбәӯp Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo Chủ Д‘б»Ғ 2 BГ i 7 Д‘б»ғ giГәp cГЎc em nбәҜm vб»Ҝng bГ i hб»Қc vГ cГЎc phЖ°ЖЎng phГЎp giбәЈi bГ i tбәӯp.
Mб»ҹ Д‘бә§u trang 45 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 1 trang 45 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 2 trang 46 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 3 trang 46 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 4 trang 47 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 5 trang 47 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 6 trang 48 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 7 trang 48 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 8 trang 48 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 9 trang 48 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 10 trang 49 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
ThбәЈo luбәӯn 11 trang 50 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp 1 trang 46 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp 2 trang 46 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp 1 trang 49 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp 2 trang 49 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Luyб»Үn tбәӯp trang 50 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Vбәӯn dб»Ҙng trang 46 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Vбәӯn dб»Ҙng trang 50 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Vбәӯn dб»Ҙng trang 51 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 1 trang 51 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 2 trang 51 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 3 trang 51 SGK Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.1 trang 22 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.2 trang 22 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.3 trang 22 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.4 trang 22 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.5 trang 22 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.6 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.7 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.8 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.9 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.10 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.11 trang 23 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.12 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.13 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.14 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.15 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.16 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.17 trang 24 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.18 trang 25 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.19 trang 25 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
GiбәЈi bГ i 7.20 trang 25 SBT Khoa hб»Қc tб»ұ nhiГӘn 7 ChГўn trб»қi sГЎng tбәЎo - CTST
Hб»Ҹi Д‘ГЎp BГ i 7 Khoa hб»Қc tб»ұ nhiГӘn 7 CTST
Trong quГЎ trГ¬nh hб»Қc tбәӯp nбәҝu cГі thбәҜc mбәҜc hay cбә§n trб»Ј giГәp gГ¬ thГ¬ cГЎc em hГЈy comment б»ҹ mб»Ҙc Hб»Ҹi Д‘ГЎp, Cб»ҷng Д‘б»“ng Khoa hб»Қc tб»ұ nhiГӘn HOC247 sбәҪ hб»— trб»Ј cho cГЎc em mб»ҷt cГЎch nhanh chГіng!
ChГәc cГЎc em hб»Қc tбәӯp tб»‘t vГ luГҙn Д‘бәЎt thГ nh tГӯch cao trong hб»Қc tбәӯp!


.JPG)