Axetilen là một hiđrocacbon có nhiều ứng dụng trong thực tiễn. Vậy axetilen có công thức cấu tạo, tính chất và ứng dụng như thế nào? Chúng ta cùng nhau tìm hiểu qua bài giảng về Axrtilen ngày hôm nay.
Tóm tắt lý thuyết
2.1. Tính chất vật lí
Chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (\(d = \frac{{26}}{{29}}\))
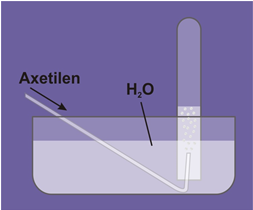
Hình 1: Thu khí Axetilen bằng cách đẩy nước
2.2. Công thức cấu tạo
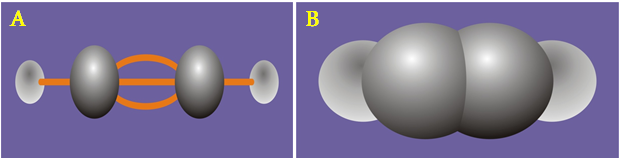
- Công thức cấu tạo của axetilen H – C ≡ C – H
- Viết gọn CH ≡ CH
- Trong phân tử C2H2 có liên kết ba (C ≡ C). Có 2 liên kết kém bền dễ đứt lần lược trong các phản ứng hoá học.
Hình 2: Công thức cấu tạo của axetilen
a) Dạng rỗng b) Dạng đặc
2.3. Tính chất hóa học
2.3.1. Axetilen có cháy không?
- Các em chú ý quan sát thao tác tiến hành thí nghiệm dưới đây:
Video 1: Axetilen cháy trong không khí
- Hiện tượng: Đốt cháy khí thoát ra cho ngọn lửa có nhiều khói đen.
- Giải thích: Khi cháy C2H2 tạo thành CO2 (nguyên nhân ngọn lửa có nhiều khói đen) và H2O. Phản ứng toả nhiệt.
2C2H2 + 5O2 .PNG)
2.3.2. Axetilen có làm mất màu dung dịch nước Brom không?
- Các em chú ý quan sát thao tác tiến hành thí nghiệm dưới đây:
Video 2: Axetilen tác dụng với dung dịch nước Brom
- Hiện tượng: Dung dịch nước Brom bị mất màu
- Giải thích:
+ C2H2 làm mất màu dd brôm
CH ≡ CH + Br – Br → Br – CH = CH – Br
+ Sản phẩm sinh ra có liên kết đôi trong phân tử nên có thể ccng tiếp với 1 phân tử Br2 nữa
Br – CH = CH – Br + Br – Br → Br2CH – CHBr2
+ Trong điều kiện thích hợp C2H2 cũng có phản ứng cộng với H2 và một số chất khác
2.4. Ứng dụng
Nhiên liệu trong đèn xì oxi-axetilen, là nguyên liệu để sản xuất PVC, cao su, axit axêtic và nhiều hoá chất khác
Hình 3: Ứng dụng của axetilen
2.5. Điều chế
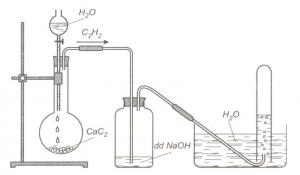
Hình 4: Điều chế và thu khí Axetilen trong phòng thí nghiệm
- Các em chú ý quan sát thao tác tiến hành thí nghiệm dưới đây:
Video 3: Điều chế và thu khí axetilen
- Cho CaC2 phản ứng với nước: CaC2 + 2H2O → C2H2 + Ca(OH)2
- Phương pháp hiện đại là nhiệt phân CH4 ở nhiệt độ cao
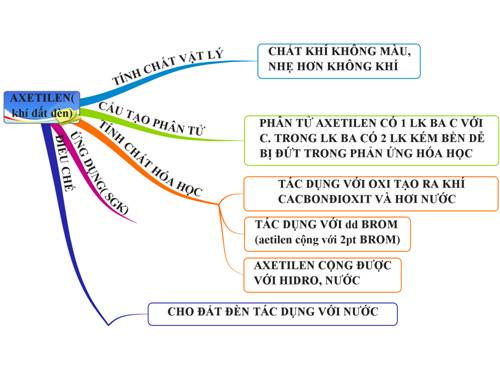
2.6. Tổng kết
Hình 5: Sơ đồ tư duy bài axetilen
Bài tập minh họa
Hoàn thành bảng so sánh sau:
| Metan (CH4) |
Etilen (C2H4) |
Axetilen (C2H2) |
|
|
Đặc điểm cấu tạo |
|||
| Tính chất hóa học chung | |||
| Tính chất hóa học riêng |
Hướng dẫn:
| Metan (CH4) |
Etilen (C2H4) |
Axetilen (C2H2) |
|
|
Đặc điểm cấu tạo |
Liên kết đơn |
Một liên kết đôi |
Một liên kết ba |
| Tính chất hóa học chung |
Phản ứng cháy |
Phản ứng cháy |
Phản ứng cháy |
| Tính chất hóa học riêng |
Phản ứng thế |
Phản ứng cộng (tác dụng với 1 phân tử Br2) |
Phản ứng cộng (tác dụng với 2 phân tử Br2) |
4. Luyện tập Bài 38 Hóa học 9
Sau bài học cần nắm:
- CTPT, CTCT, đặc điểm cấu tạo của axêtilen.
- Tính chất vật lí: Trạng thái, màu sắc, tính tan trong nước, tỉ khối so với không khí. Tính chất hoá học của C2H2: Phản ứng cộng với dd Br2, pứ cháy.
- Axetylen được dùng làm nhiên liệu và nguyên liệu trong công nghiệp.
4.1. Trắc nghiệm
Bài kiểm tra Trắc nghiệm Hóa học 9 Bài 38 có phương pháp và lời giải chi tiết giúp các em luyện tập và hiểu bài.
-
Câu 1:
Trong điều kiện nhiệt độ áp suất không đổi thì axetilen phản ứng với oxi theo tỉ lệ thể tích là
- A. 2 lít khí C2H2 phản ứng với 4 lít khí O2.
- B. 2 lít khí C2H2 phản ứng với 5 lít khí O2.
- C. 3 lít khí C2H2 phản ứng với 2 lít khí O2.
- D. 3 lít khí C2H2 phản ứng với 1 lít khí O2.
-
- A. một liên kết đơn.
- B. một liên kết đôi.
- C. một liên kết ba.
- D. hai liên kết đôi.
-
Câu 3:
Axetilen có tính chất vật lý
- A. là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí.
- B. là chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
- C. là chất khí không màu, không mùi, tan trong nước, nhẹ hơn không khí .
- D. là chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
4.2. Bài tập SGK và Nâng cao
Các em có thể hệ thống lại nội dung bài học thông qua phần hướng dẫn Giải bài tập Hóa học 9 Bài 38.
Bài tập 1 trang 122 SGK Hóa học 9
Bài tập 2 trang 122 SGK Hóa học 9
Bài tập 3 trang 122 SGK Hóa học 9
Bài tập 4 trang 122 SGK Hóa học 9
Bài tập 5 trang 122 SGK Hóa học 9
Bài tập 38.1 trang 47 SBT Hóa học 9
Bài tập 38.2 trang 48 SBT Hóa học 9
Bài tập 38.3 trang 48 SBT Hóa học 9
Bài tập 38.4 trang 48 SBT Hóa học 9
Bài tập 38.5 trang 48 SBT Hóa học 9
Bài tập 38.6 trang 48 SBT Hóa học 9
Bài tập 38.7 trang 48 SBT Hóa học 9
Bài tập 38.8 trang 48 SBT Hóa học 9
Bài tập 38.9 trang 48 SBT Hóa học 9
5. Hỏi đáp về Bài 38 chương 4 Hóa học 9
Trong quá trình học tập nếu có bất kì thắc mắc gì, các em hãy để lại lời nhắn ở mục Hỏi đáp để cùng cộng đồng Hóa HOC247 thảo luận và trả lời nhé.