Hã░ß╗øng dß║½n giß║úi b├ái tß║¡p SGK Ho├í hß╗ìc 12 B├ái 32 Hß╗úp chß║Ñt cß╗ºa sß║»t gi├║p c├íc em hß╗ìc sinh nß║»m vß╗»ng phã░ãíng ph├íp giß║úi b├ái tß║¡p v├á ├┤n luyß╗çn tß╗æt kiß║┐n thß╗®c m├┤n ho├í.
-
Bài tập 1 trang 145 SGK Hóa học 12
Viß║┐t phã░ãíng tr├¼nh h├│a hß╗ìc cß╗ºa c├íc phß║ún ß╗®ng trong qu├í tr├¼nh chuyß╗ân ─æß╗òi sau:
FeS2  Fe2O3  FeCl3  Fe(OH)3  Fe2O3  FeO  FeSO4  Fe
-
Bài tập 2 trang 145 SGK Hóa học 12
Cho sß║»t t├íc dß╗Ñng vß╗øi dung dß╗ïch H2SO4 lo├úng thu ─æã░ß╗úc V l├¡t kh├¡ H2 (─æktc), dung dß╗ïch thu ─æã░ß╗úc cho bay hãíi thu ─æã░ß╗úc tinh thß╗â FeSO4.7H2O c├│ khß╗æi lã░ß╗úng l├á 55,6 gam. Thß╗â t├¡ch kh├¡ H2(─æktc) ─æã░ß╗úc giß║úi ph├│ng l├á:
A. 8,19 lít.
B. 7,33 lít.
C. 4,48 lít.
D. 6,23 lít.
-
Bài tập 3 trang 145 SGK Hóa học 12
Ng├óm mß╗Öt ─æinh sß║»t nß║Àng 4 gam trong dung dß╗ïch CuSO4, sau mß╗Öt thß╗Øi gian lß║Ñy ─æinh sß║»t ra, sß║Ñy kh├┤, c├ón nß║Àng 4,2857 gam. Khß╗æi lã░ß╗úng sß║»t tham gia phß║ún ß╗®ng l├á:
A. 1,9990 gam
B. 1,9999 gam.
C. 0,3999 gam
D. 2,1000 gam.
-
Bài tập 4 trang 145 SGK Hóa học 12
Hß╗ùn hß╗úp A gß╗ôm FeO, Fe3O4, Fe2O3. Trong hß╗ùn hß╗úp A, mß╗ùi oxit ─æß╗üu c├│ 0,5 mol. Khß╗æi lã░ß╗úng cß╗ºa hß╗ùn hß╗úp A l├á:
A. 231 gam.
B. 232 gam.
C. 233 gam.
D. 234 gam.
- VIDEOYOMEDIA
-
Bài tập 5 trang 145 SGK Hóa học 12
Khß╗¡ ho├án to├án 16 gam Fe2O3 bß║▒ng kh├¡ CO ß╗ƒ nhiß╗çt ─æß╗Ö cao. Kh├¡ ─æi ra sau phß║ún ß╗®ng ─æã░ß╗úc dß║½n v├áo dung dß╗ïch Ca(OH)2 dã░. Khß╗æi lã░ß╗úng kß║┐t tß╗ºa thu ─æã░ß╗úc l├á:
A. 15 gam.
B. 20 gam.
C. 25 gam.
D. 30 gam.
-
Bài tập 1 trang 202 SGK Hóa học 12 nâng cao
a. T├¡nh chß║Ñt h├│a hß╗ìc chung cß╗ºa hß╗úp chß║Ñt sß║»t (II) l├á g├¼? Dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â chß╗®ng minh nhß╗»ng ─æiß╗üu ─æ├ú khß║│ng ─æß╗ïnh( viß║┐t phã░ãíng tr├¼nh h├│a hß╗ìc)
b. T├¡nh chß║Ñt h├│a hß╗ìc chung cho hß╗úp chß║Ñt sß║»t (III) l├á g├¼? Dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â chß╗®ng minh nhß╗»ng ─æiß╗üu khß║│ng ─æß╗ïnh (viß║┐t phã░ãíng tr├¼nh h├│a hß╗ìc)
-
Bài tập 2 trang 202 SGK Hóa học 12 nâng cao
H├úy dß║½n ra nhß╗»ng phß║ún ß╗®ng h├│a hß╗ìc ─æß╗â chß╗®ng minh rß║▒ng c├íc oxit sß║»t (II) l├á oxit bazo, c├íc hidroxit sß║»t (II) l├á bazo (Viß║┐t c├íc phã░ãíng tr├¼nh phß║ún ß╗®ng h├│a hß╗ìc)
-
Bài tập 3 trang 202 SGK Hóa 12 Nâng cao
Viß║┐t c├íc phã░ãíng tr├¼nh h├│a hß╗ìc biß╗âu diß╗àn nhß╗»ng chuyß╗ân ─æß╗òi h├│a hß╗ìc sau:
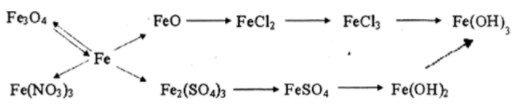
-
Bài tập 4 trang 202 SGK Hóa 12 Nâng cao
Ho├á tan 10 gam FeSO4 c├│ lß║½n tß║íp chß║Ñt l├á Fe2(SO4)3 trong nã░ß╗øc, ─æã░ß╗úc 200 cm3 dung dß╗ïch. Biß║┐t 20 cm3 dung dß╗ïch n├áy ─æã░ß╗úc axit ho├í bß║▒ng H2SO4 lo├úng l├ám mß║Ñt m├áu t├¡m cß╗ºa 25 cm3 dung dß╗ïch KMnO4 0,03 M.
a) Viß║┐t phã░ãíng tr├¼nh ho├í hß╗ìc dß║íng ion r├║t gß╗ìn. Cho biß║┐t vai tr├▓ cß╗ºa ion Fe2+ v├á ion MnO4-.
b) C├│ bao nhi├¬u mol ion Fe2+ t├íc dß╗Ñng vß╗øi 1 mol ion MnO4-?
c) C├│ bao nhi├¬u mol ion Fe2+ t├íc dß╗Ñng vß╗øi 25 cm3 dung dß╗ïch KMnO4 0,03M?
d) Có bao nhiêu gam Fe2+ trong 200 cm3 dung dịch ban đầu.
e) T├¡nh phß║ºn tr─âm theo khß╗æi lã░ß╗úng cß╗ºa FeSO4.
-
Bài tập 32.1 trang 74 SBT Hóa học 12
Nhận định nào sau đây sai ?
A. Sß║»t t├íc dß╗Ñng ─æã░ß╗úc vß╗øi dung dß╗ïch CuSO4
B. Sß║»t t├íc dß╗Ñng ─æã░ß╗úc vß╗øi dung dß╗ïch FeCl3.
C. Sß║»t t├íc dß╗Ñng ─æã░ß╗úc vß╗øi dung dß╗ïch FeCl2.
D. ─Éß╗ông t├íc dß╗Ñng ─æã░ß╗úc vß╗øi dung dß╗ïch FeCl3.
-
Bài tập 32.2 trang 74 SBT Hóa học 12
Hợp chất nào sau đây của sắt vừa có tính oxi hoá, vừa có tính khử?
A. FeO
B. Fe2O3
C. Fe(OH)3
D. Fe(NO3)3
-
Bài tập 32.3 trang 75 SBT Hóa học 12
Khß╗¡ ho├án to├án 0,3 mol mß╗Öt oxit sß║»t FexOy bß║▒ng Al thu ─æã░ß╗úc 0,4 mol Al2O3 theo sãí ─æß╗ô phß║ún ß╗®ng sau :
FexOy + Al  Fe + Al2O3
C├┤ng thß╗®c cß╗ºa oxit sß║»t l├á
A. FeO
B. Fe2O3
C. Fe3O4
D. kh├┤ng x├íc ─æß╗ïnh ─æã░ß╗úc
-
Bài tập 32.4 trang 75 SBT Hóa học 12
Khß╗¡ ho├án to├án hß╗ùn hß╗úp Fe2O3 v├á CuO bß║▒ng CO thu ─æã░ß╗úc sß╗æ mol CO2 tß║ío ra tß╗½ c├íc oxit c├│ tß╗ë lß╗ç tã░ãíng ß╗®ng l├á 3 : 2. Phß║ºn tr─âm khß╗æi lã░ß╗úng cß╗ºa Fe2O3 v├á CuO trong hß╗ùn hß╗úp lß║ºn lã░ß╗út l├á
A. 50% và 50%.
B. 75% và 25%.
C.75,5% và 24,5%.
D. 25% và 75%.
-
Bài tập 32.5 trang 75 SBT Hóa học 12
Khi nung hß╗ùn hß╗úp c├íc chß║Ñt Fe(NO3)2, Fe(OH)3 v├á FeCO3 trong kh├┤ng kh├¡ ─æß║┐n khß╗æi lã░ß╗úng kh├┤ng ─æß╗òi, thu ─æã░ß╗úc mß╗Öt chß║Ñt rß║»n l├á
A. Fe3O4.
B. FeO.
C. Fe.
D. Fe2O3.
-
Bài tập 32.6 trang 75 SBT Hóa học 12
Cho c├íc chß║Ñt : Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3. Cho tß╗½ng chß║Ñt tr├¬n lß║ºn lã░ß╗út t├íc dß╗Ñng vß╗øi dung dß╗ïch HNO3 ─æß║Àc, n├│ng th├¼ sß╗æ phß║ún ß╗®ng thuß╗Öc loß║íi phß║ún ß╗®ng oxi ho├í - khß╗¡ l├á
A. 8.
B. 5.
C. 7.
D. 6.
-
Bài tập 32.7 trang 75 SBT Hóa học 12
Cho 0,01 mol mß╗Öt hß╗úp chß║Ñt cß╗ºa sß║»t t├íc dß╗Ñng hß║┐t vß╗øi H2SO4 ─æß║Àc, n├│ng (dã░) tho├ít ra 0,112 l├¡t kh├¡ SO2 (─æktc) (l├á sß║ún phß║®m khß╗¡ duy nhß║Ñt). C├┤ng thß╗®c hß╗úp chß║Ñt cß╗ºa sß║»t l├á
A. FeS.
B. FeS2.
C. FeO.
D. FeCO3.
-
Bài tập 32.8 trang 76 SBT Hóa học 12
C├│ hiß╗çn tã░ß╗úng g├¼ xß║úy ra khi cho dung dß╗ïch Na2CO3 tß╗½ tß╗½ ─æß║┐n dã░ v├áo dung dß╗ïch FeCl3
A. Kh├┤ng c├│ hiß╗çn tã░ß╗úng g├¼
B. Có kết tủa nâu đỏ
C. Có sủi bọt khí
D. Có kết tủa nâu đỏ và sủi bọt khí
-
Bài tập 32.9 trang 76 SBT Hóa học 12
H├úy thay A1, A2 . . . A8 bß║▒ng nhß╗»ng chß║Ñt v├┤ cãí th├¡ch hß╗úp v├á ho├án th├ánh c├íc PTHH theo sãí ─æß╗ô c├íc chuß╗ùi phß║ún ß╗®ng sau :
(1) A1 + A2  A3
(2) A3 + A4  FeCl3
(3) A5 + FeCl3  A3 + I2 + A2
(4) A2 + A6  MnCl2 + A7 + A4
(5) A4 + A8  CaOCl2 + A7
-
Bài tập 32.10 trang 76 SBT Hóa học 12
Cho A l├á oxit, B l├á muß╗æi, C v├á D l├á kim loß║íi. H├úy viß║┐t PTHH cß╗ºa c├íc phß║ún ß╗®ng sau:
a) A + HCl ÔåÆ 2 muß╗æi + H2O
b) B + NaOH ÔåÆ 2 muß╗æi + H2O
c) C + muß╗æi ÔåÆ 1 muß╗æi
d) D + muß╗æi ÔåÆ 2 muß╗æi
-
Bài tập 32.11 trang 76 SBT Hóa học 12
Cho biß║┐t c├íc phß║ún ß╗®ng xß║úy ra khi cho hß╗ùn hß╗úp gß╗ôm Fe, FeO, Fe3O4, Fe2O3 v├áo :
a) Dung dịch H2SO4 loãng.
b) Dung dịch HNO3 loãng.
-
Bài tập 32.12 trang 76 SBT Hóa học 12
Ph├ón biß╗çt 3 hß╗ùn hß╗úp sau bß║▒ng phã░ãíng ph├íp ho├í hß╗ìc :
a) Fe và FeO
b) Fe và Fe2O3
c) FeO và Fe2O3
-
Bài tập 32.13 trang 76 SBT Hóa học 12
Khi cho 1 g sß║»t clorua nguy├¬n chß║Ñt t├íc dß╗Ñng vß╗øi lã░ß╗úng dã░ dung dß╗ïch AgNO3 tß║ío ra 2,6492 g bß║íc clorua. Hß╗Åi ─æ├│ l├á sß║»t (II) clorua hay sß║»t (III) clorua
-
Bài tập 32.14 trang 77 SBT Hóa học 12
Hß╗ùn hß╗úp A chß╗®a Fe, Ag v├á Cu ß╗ƒ dß║íng bß╗Öt, cho hß╗ùn hß╗úp A v├áo dung dß╗ïch B chß╗ë chß╗®a mß╗Öt chß║Ñt tan, khuß║Ñy k─® cho ─æß║┐n khi phß║ún ß╗®ng kß║┐t th├║c th├¼ thß║Ñy Fe v├á Cu t├íc dß╗Ñng hß║┐t v├á c├▓n lß║íi lã░ß╗úng Ag ─æ├║ng bß║▒ng lã░ß╗úng Ag trong hß╗ùn hß╗úp A.
a) Hß╗Åi dung dß╗ïch B chß╗®a chß║Ñt tan g├¼? Viß║┐t phã░ãíng tr├¼nh ho├í hß╗ìc cß╗ºa phß║ún ß╗®ng.
b) Nß║┐u sau phß║ún ß╗®ng thu ─æã░ß╗úc lã░ß╗úng Ag nhiß╗üu hãín lã░ß╗úng Ag trong A th├¼ dung dß╗ïch B chß╗®a chß║Ñt g├¼?
-
Bài tập 32.15 trang 77 SBT Hóa học 12
Cho 11,36 gam hß╗ùn hß╗úp gß╗ôm Fe, FeO, Fe2O3 v├á Fe3O4 phß║ún ß╗®ng hß║┐t vß╗øi dung dß╗ïch HNO3 lo├úng (dã░), thu ─æã░ß╗úc 1,344 l├¡t kh├¡ NO (sß║ún phß║®m khß╗¡ duy nhß║Ñt, ─æktc) v├á dung dß╗ïch X. C├┤ cß║ín dung dß╗ïch X thu ─æã░ß╗úc m gam muß╗æi khan. X├íc ─æß╗ïnh gi├í trß╗ï cß╗ºa m.
-
Bài tập 32.16 trang 77 SBT Hóa học 12
Cho 9,12 gam hß╗ùn hß╗úp gß╗ôm FeO, Fe2O3, Fe3O4 t├íc dß╗Ñng vß╗øi dung dß╗ïch HCl (dã░). Sau khi c├íc phß║ún ß╗®ng xß║úy ra ho├án to├án, ─æã░ß╗úc dung dß╗ïch Y, c├┤ cß║ín Y thu ─æã░ß╗úc 7,62 gam FeCl2 v├á m gam FeCl3. X├íc ─æß╗ïnh gi├í trß╗ï cß╗ºa m.
-
Bài tập 32.17 trang 77 SBT Hóa học 12
Trß╗Ön 5,6 gam bß╗Öt sß║»t vß╗øi 2,4 gam bß╗Öt lã░u huß╗│nh rß╗ôi nung n├│ng (trong ─æiß╗üu kiß╗çn kh├┤ng c├│ kh├┤ng kh├¡), thu ─æã░ß╗úc hß╗ùn hß╗úp rß║»n M. Cho M t├íc dß╗Ñng vß╗øi lã░ß╗úng dã░ dung dß╗ïch HCl, giß║úi ph├│ng hß╗ùn hß╗úp kh├¡ X v├á c├▓n lß║íi mß╗Öt phß║ºn kh├┤ng tan G. ─Éß╗â ─æß╗æt ch├íy ho├án to├án X v├á G cß║ºn vß╗½a ─æß╗º V l├¡t kh├¡ O2 (─æktc). X├íc ─æß╗ïnh gi├í trß╗ï cß╗ºa V.
-
Bài tập 32.18 trang 77 SBT Hóa học 12
Hß╗ùn hß╗úp X gß╗ôm FeCl2 v├á FeCl3 ─æem ho├á tan trong nã░ß╗øc. Lß║Ñy mß╗Öt nß╗¡a dung dß╗ïch thu ─æã░ß╗úc cho t├íc dß╗Ñng vß╗øi dung dß╗ïch NaOH (dã░) ngo├ái kh├┤ng kh├¡ thß║Ñy tß║ío ra 0,5 mol Fe(OH)3. Nß╗¡a c├▓n lß║íi cho t├íc dß╗Ñng vß╗øi dung dß╗ïch AgNO3 (dã░) tß║ío ra 1,3 mol AgCl. X├íc ─æß╗ïnh tß╗ë lß╗ç mol FeCl2 v├á FeCl3 trong X.





