Giải bài 6 tr 143 sách GK Hóa lớp 10
Có 100ml dung dịch H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha chế loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%:
a) Tính thể tích nước cần dùng để pha loãng?
b) Khi pha loãng phải tiến hành như thế nào?
Hướng dẫn giải chi tiết bài 6
Câu a:
Cách 1: Dựa vào các công thức tính toán
\(\begin{array}{l} m = D.V\\ C\% = \frac{{{m_{ct}}}}{{{m_{dd}}}}.100\\ {m_{dung{\rm{ }}dich}} = {m_{dung{\rm{ }}moi}} + {m_{chat\tan }} \end{array}\)
Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì khối lượng riêng của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
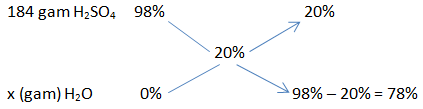
Cách 2: Dựa vào sơ đồ đường chéo
Muốn pha loãng dung dịch, ta sử dụng nước, coi nước là axit có nồng độ là O.
Khối lượng dung dịch axit sunfuric là:
m = D. V = 1,84 . 100 = 184 (g)
Áp dụng sơ đồ đường chéo:
Ta có tỉ lệ:
\(\frac{{184}}{x} = \frac{{20}}{{78}} \Rightarrow x = 717,6(gam)\)
Câu b:
Cách tiến hành khi pha loãng
- Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít.
- Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều.
Chú ý: Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng.
-- Mod Hóa Học 10 HỌC247
Video hướng dẫn giải bài 6 SGK
Bài tập SGK khác
Bài tập 4 trang 143 SGK Hóa học 10
Bài tập 5 trang 143 SGK Hóa học 10
Bài tập 1 trang 176 SGK Hóa học 10 nâng cao
Bài tập 3 trang 186 SGK Hóa học 10 nâng cao
Bài tập 6 trang 187 SGK Hóa học 10 nâng cao
Bài tập 7 trang 187 SGK Hóa học 10 nâng cao
Bài tập 8 trang 187 SGK Hóa học 10 nâng cao
Bài tập 9 trang 187 SGK Hóa học 10 nâng cao
Bài tập 10 trang 187 SGK Hóa học 10 nâng cao
Bài tập 33.1 trang 72 SBT Hóa học 10
Bài tập 33.2 trang 73 SBT Hóa học 10
Bài tập 33.3 trang 73 SBT Hóa học 10
Bài tập 33.4 trang 73 SBT Hóa học 10
Bài tập 33.5 trang 73 SBT Hóa học 10
Bài tập 33.6 trang 73 SBT Hóa học 10
Bài tập 33.7 trang 74 SBT Hóa học 10
Bài tập 33.8 trang 74 SBT Hóa học 10
Bài tập 33.9 trang 74 SBT Hóa học 10
Bài tập 33.10 trang 74 SBT Hóa học 10
Bài tập 33.11 trang 74 SBT Hóa học 10
Bài tập 33.12 trang 75 SBT Hóa học 10
Bài tập 33.13 trang 75 SBT Hóa học 10
Bài tập 33.14 trang 75 SBT Hóa học 10
Bài tập 33.15 trang 75 SBT Hóa học 10
Bài tập 33.16 trang 75 SBT Hóa học 10
Bài tập 33.17 trang 76 SBT Hóa học 10
Bài tập 33.18 trang 76 SBT Hóa học 10
Bài tập 33.19 trang 76 SBT Hóa học 10
-


Cho X chứa 0,2 mol Ca2+; 0,08 mol Cl– ; z mol HCO3– và t mol NO3–. Cô cạn X rồi nung đến khối lượng không đổi, thu được 16,44 gam chất rắn Y. Nếu thêm t mol HNO3 vào X rồi đun dung dịch đến cạn thì thu được muối khan có khối lượng là?
bởi Nguyễn Thị Thu Huệ
 22/03/2022
Theo dõi (0) 1 Trả lời
22/03/2022
Theo dõi (0) 1 Trả lời -


Cho 15 gam hỗn hợp X gồm 2 kim loại Al và Mg vào Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O (không còn sản phẩm khử khác). % khối lượng Al trong hỗn hợp X là (Al=27, Mg=24)
bởi Phan Quân
 22/03/2022
Theo dõi (0) 1 Trả lời
22/03/2022
Theo dõi (0) 1 Trả lời -


Hoà 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X và 1,344 lít (ở đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí H2 là 18. Số mol axit HNO3 thể hiện tính oxi hóa là?
bởi Trong Duy
 22/03/2022
Theo dõi (0) 1 Trả lời
22/03/2022
Theo dõi (0) 1 Trả lời -


Cho 11 gam X gồm Al và Fe vào dung dịch HNO3 loãng dư, thu được dung dịch Y và 6,72 lít khí NO ở (đktc) là sản phẩm khử duy nhất. Cô cạn cẩn thận dung dịch Y thì lượng muối khan thu được?
bởi Lê Nguyễn Hạ Anh
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -
ADMICRO


Trong phòng thí nghiệm, thường điều chế HNO3 bằng phản ứng: A. N2O5 + H2O → 2HNO3 B. 4NO2 + 2H2O + O2 → 4HNO3 C. NaNO3 + H2SO4 (đ) → HNO3 + NaHSO4 D. Cu(NO3)2 + 2H2O → Cu(OH)2 + 2HNO3
bởi Phí Phương
 22/03/2022
Theo dõi (0) 1 Trả lời
22/03/2022
Theo dõi (0) 1 Trả lời -


Khi cho Fe vào 200 ml dung dịch chứa NaNO3 và H2SO4. Sau phản ứng hoàn toàn thu được dung dịch A và 6,72 lít hỗn hợp khí X (đktc) gồm NO và H2 có tỉ lệ mol 2 : 1 và 3 gam chất rắn không tan. Biết dung dịch A không chứa muối amoni. Cô cạn dung dịch A thu được khối lượng muối khan là?
bởi hành thư
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Khi 5,6 gam Fe trong dung dịch HNO3 loãng (dư), thu được dung dịch có chứa m gam muối và khí NO (sản phẩm khử duy nhất). Giá trị của m là?
bởi Suong dem
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Với KBr, S, SiO2, P, Na3PO4, FeO, Cu và Fe2O3. Trong các chất trên, số chất có thể bị oxi hóa bởi dung dịch axit H2SO4 đặc, nóng là?
bởi thủy tiên
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Cho 6,48 gam bột Mg tan hết trong hỗn hợp gồm HCl và KNO3, thu được dung dịch X chỉ chứa m gam muối và 1,792 lít (đktc) hỗn hợp khí Y gồm N2O và H2. Khí Y có tỉ khối so với H2 bằng 14,125. Giá trị của m là?
bởi Lê Nhật Minh
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Khi cho 3,76 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm NaNO3 1M và H2SO4 2M, thu được dung dịch X chỉ chứa 16,66 gam muối trung hòa và hỗn hợp khí Y gồm NO, NO2, H2 (không còn sản phẩm khử nào khác và trong Y, khí H2 chiếm 14,29 % về số mol). Cho một lượng NaOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 5,44 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X là?
bởi Nguyễn Trọng Nhân
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Cho 3,6 gam Mg trong dung dịch HNO3 loãng dư. Thể tích khí NO (đktc, sản phẩm khử duy nhất) thu được là:
bởi Hoang Vu
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Khi cho HNO3 đặc nóng tác dụng một phân tử FeS2 sẽ nhường … electron. Số trong dấu … là?
bởi thuy linh
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Nếu Zn tới dư vào HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m là?
bởi Tra xanh
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Ta cho 39,84 gam hỗn hợp F gồm Fe3O4 và kim loại M vào HNO3 đun nóng, khuấy đều hỗn hợp để phản ứng xẩy ra hoàn toàn thu được 4,48 lít NO2 sản phẩm khử duy nhất (ở đktc), dung dịch G và 3,84 gam kim loại M. Cho dung dịch NaOH dư vào dung dịch G thu được kết tủa K. Nung K trong không khí đến khối lượng không đổi thu được 40 gam chất rắn R. Biết M có hóa trị không đổi trong các phản ứng trên. % khối lượng của M trong F gần nhất với giá trị nào?
bởi bach dang
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Để cho 19,225 gam hỗn hợp X gồm Mg, Zn cần dùng vừa đủ 800 ml HNO3 1,5M. Sau khi pứ kết thúc thu được dung dịch Y và 2,24 lít (đktc) hỗn hợp khí A gồm N2, N2O, NO, NO2 (N2O và NO2 có số mol bằng nhau) có tỉ khối đối với H2 là 14,5. Phần trăm về khối lượng của Mg trong X là?
bởi Sasu ka
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Ta cho 5,4 gam Al bằng dung dịch HNO3 dư, thu được x mol NO2 (là sản phẩm khử duy nhất). Giá trị của x là?
bởi Thanh Thanh
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Trong phản ứng hoà tan CuFeS2 với HNO3 đặc, nóng tạo ra các muối và H2SO4 thì một phân tử CuFeS2 sẽ: A. nhường 11 electron B. nhường 17 electron C. nhận 17 electron D. nhận 11 electron
bởi thu phương
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Ta cho 10,71 gam hỗn hợp gồm Al, Zn, Fe trong 4 lít dung dịch HNO3 a mol/l vừa đủ thu được dung dịch Y và 1,792 lít (đktc) hỗn hợp khí gồm N2 và N2O có tỉ lệ mol 1:1. Cô cạn dung dịch Y thu được m gam muối khan. Giá trị m và a lần lượt là?
bởi thanh hằng
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Cho 4,875 gam một kim loại X hóa trị (II) trong dung dịch HNO3 loãng thu được 1,12 lít khí NO (đktc) là sản phẩm khử duy nhất. Kim loại X là?
bởi Mai Trang
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Cho X gồm Al, Fe trong 352 ml dung dịch HNO3 2,5M (vừa hết ), thu được dung dịch Y chứa 53,4 gam hỗn hợp muối và 2,24 lít hỗn hợp khí Z gồm NO, N2O (đktc) có tỉ khối hơi đối với H2 là 17,1. Cho dung dịch Y tác dụng với một lượng dung dịch NH3 dư, lọc thu được m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào?
bởi Thùy Trang
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Đốt 6,72 gam M với oxi thu được 9,28 gam oxit. Nếu cho 5,04 gam M tác dụng hết với dung dịch HNO3 dư thu được dung dịch X và khí NO (là sản phẩm khử duy nhất). Thể tích NO (đktc) thu được là?
bởi bach hao
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Cho 10,62 gam hỗn hợp gồm Fe, Zn vào 800 ml dd hỗn hợp X gồm NaNO3 0,45 M và H2SO4 1M thu được dd Y và 3,584 lít khí NO (duy nhất). Dd Y hòa tan được tối đa m gam bột sắt và thu được V lít khí. Các khí đo ở đktc và NO là sản phẩm khử duy nhất của N+5 trong các thí nghiệm trên. Giá trị của m và V lần lượt là?
bởi Dương Minh Tuấn
 21/03/2022
Theo dõi (0) 1 Trả lời
21/03/2022
Theo dõi (0) 1 Trả lời -


Tính V dung dịch HNO3 0,5M tối thiểu cần dùng để hòa tan hoàn toàn hỗn hợp bột gồm 8,4 gam Sắt và 9,6 gam Đồng? (Biết khí NO là sản phẩm khử duy nhất).
bởi Lan Anh
 20/03/2022
Theo dõi (0) 1 Trả lời
20/03/2022
Theo dõi (0) 1 Trả lời -


Cho m gam A gồm Al và Mg có tỉ lệ mol 5 : 4 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch Y. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Z. Dẫn Z từ từ qua dung dịch KOH dư, thấy có 4,48 lít hỗn hợp khí T đi ra (đktc). Tỉ khối của T đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch Y thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ % của Al(NO3)3 trong Y gần nhất với?
bởi Thùy Nguyễn
 20/03/2022
Theo dõi (0) 1 Trả lời
20/03/2022
Theo dõi (0) 1 Trả lời -


Có 3 chất X, Y, Z thỏa mãn các tính chất sau: – X tác dụng với HCl, không tác dụng với NaOH và HNO3 đặc, nguội. – Y tác dụng được với HCl và HNO3 đặc nguội, không tác dụng với NaOH. – Z tác dụng được với HCl và NaOH, không tác dụng với HNO3 đặc nguội. Vậy X, Y, Z lần lượt là?
bởi Naru to
 17/03/2022
Theo dõi (0) 1 Trả lời
17/03/2022
Theo dõi (0) 1 Trả lời