Trong nội dung bài học Bài 13: Phản ứng oxi hóa - khử môn Hóa học 10 SGK Cánh Diều, HOC247 sẽ giúp các em hiểu một cách cụ thể nhất về phản ứng oxi hóa khử là gì cũng như giải các bài tập có trong bài phản ứng oxi hóa khử lớp 10. Mong rằng tài liệu này có thể giúp cho các em củng cố thêm kiến thức cũng như học tốt hơn môn học này!
Tóm tắt lý thuyết
1.1. Số oxi hóa
- Trong các đơn chất, điện tích của nguyên tử luôn bằng 0, trong phân tử hợp chất, điện tích của nguyên tử nói chung khác không. Chẳng hạn điện tích của Mg và 0 trong hợp chất ion MgO tương ứng là 2+ và 2-. Trong phân tử HCl, điện tích thực của H và Cl lần lượt là \({\delta ^ + }\) và \({\delta ^ - }\) trong đó 0< \(\delta \) < 1 và giá trị \(\delta \) này không để xác định được.
- Để thuận tiện hơn, người ta sử dụng điện tích giả định thay vì điện tích thực và gọi đó là số oxi hóa.
a. Khái niệm số oxi hoá
- Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Ví dụ
- Trong các hợp chất ion:
+ Na+Cl-: Số oxi hoá của Na là +1, của Cl là -1.
+ Mg2+O2-: Số oxi hoá của Mg là +2, của O là -2.
- Trong các hợp chất cộng hoá trị H-S-H:
+ Với giả định là hợp chất ion, hai cặp electron chung sẽ lệch hoàn toàn về phía nguyên tử S (có độ âm điện cao hơn), mỗi liên kết đơn có một electron của H bị chuyển sang S nên hợp chất son giả định là H+S2-H+. Vậy số oxi hoá của H là +1, S là -2.
b. Cách xác định số oxi hoá của nguyên tử các nguyên tố trong hợp chất
Có hai cách để xác định số oxi hoá của các nguyên tử nguyên tố hoá học trong hợp chất.
* Cách 1: Dựa theo số oxi hoá của một số nguyên tử đã biết và điện tích của phân tử hoặc ion.
- Theo cách này, có hai quy tắc sau đây:
+ Quy tắc 1:
- Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng không.
- Trong các hợp chất: Số oxi hoá của H là +1 (trừ một số hydride NaH, CaH2,...); Số oxi hoá của O là-2 (trừ một số trường hợp như OF, HD,...); Số oxi hoá của các kim loại kiềm (nhóm IA: Li, Na, K,...) luôn là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba,...) luôn là+2, số oxi hoá của Al là +3.
+ Quy tắc 2: Tổng số số oxi hoá của các nguyên tử trong phân tử bằng 0, của một con đa nguyên tử bằng chính điện tích của ion đó.
* Cách 2: Dựa theo công thức cấu tạo
- Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
- Cách này có ưu điểm là áp dụng được cho mọi trường hợp, tuy nhiên, cần phải biết công thức cấu tạo của chất.
Ví dụ:
- Xác định số oxi hoá của C và O trong CO2
- Carbon dioxide (CO2) có công thức cấu tạo là O=C=O.
- Trong mỗi liên kết đôi C = O, C góp 2 electron, khi giả định CO2 là hợp chất ion thì 2 electron này chuyển sang O. Vì có hai liên kết C=O nên CO, có công thức ion giả định là O2-C4+O2-. Từ đó xác định được số oxi hoá của O là -2, của C là +4.
| Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả thiết đó là hợp chất ion. |
|---|
1.2. Phản ứng oxi hóa - khử
- Nếu phân loại các phản ứng hoá học dựa theo số oxi hoá thì có hai loại sau: Phản ứng có sự thay đổi số oxi hoá và phản ứng không có sự thay đổi số oxi hoá của các nguyên tử trước và sau phản ứng.
a. Một số khái niệm
- Phản ứng oxi hoá- khử là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của ít nhất một nguyên tố hoá học.
Ví dụ
2Ag + Cl2 → 2AgCl (1)
2AgNO3 + BaCl2 → AgCl + Ba(NO3)2 (2)
Cl2 + 2NaOH → NaOCl + NaCl + H2O (3)
- Trong các phản ứng trên, phản ứng (1) là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hoá của Ag và Cl. Phản ứng (3) là phản ứng tạo nước Javel, trong phản ứng này, dù chỉ có sự thay đổi số oxi hoá ở chlorine nhưng nó vẫn là phản ứng oxi hoá - khử. Phản ứng (2) không phải phản ứng oxi hoá - khử.
- Đối với phản ứng oxi hoá - khử, một số khái niệm sau thường được sử dụng:
+ Chất khử (chất bị oxi hoá) là chất nhường electron. Ví dụ Ag trong phản ứng (1).
+ Chất oxi hoá (chất bị khử) là chất nhận electron Ví dụ Cl2, trong phản ứng (1).
+ Quá trình oxi hoá (sự oxi hoá) là quá trình nhường electron. Ví dụ quá trình Ag nhường electron trong phản ứng (1).
+ Quá trình khử (sự khử) là quá trình nhận electron. Ví dụ quá trình Cl nhận electron trong phản ứng (1).
b. Cân bằng phản ứng oxi hoá - khử theo phương pháp thăng bằng electron
- Phản ứng oxi hoá - khử có sự thay đổi số oxi hoá, tức là có các quá trình nhường và nhận electron. Ta có thể cân bằng các phản ứng oxi hoá - khử theo nguyên tắc trong một phản ứng, tổng số electron nhường phải bằng tổng số electron nhận.
Ví dụ 1: Cân bằng phản ứng: Al + O2 → Al2O3
- Bước 1. Xác định sự thay đổi số oxi hoá trước và sau phản ứng của các nguyên tử.
\(\mathop {Al}\limits^0 {\rm{ }} + {\rm{ }}\mathop {{O_2}}\limits^0 \; \to \;{\mathop {Al}\limits^{ + 3} _2}{\mathop O\limits^{ - 2} _3}\)
- Bước 2. Viết các quá trình oxi hoá và quá trình khử.
\(\mathop {Al}\limits^0 {\rm{ }}\; \to \;\mathop {Al}\limits^{ + 3} \,\,\, + \,\,\,3e\) (1)
\(\mathop O\limits^0 \;\,\, + \,\,2e\,\, \to \;\mathop O\limits^{ - 2} \) (2)
- Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các quá trình nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các quá trình (đã nhân hệ số) với nhau sẽ thu được sơ đồ (3).
2 x \(\mathop {Al}\limits^0 {\rm{ }}\; \to \;\mathop {Al}\limits^{ + 3} \,\,\, + \,\,\,3e\) (1)
3 x \(\mathop O\limits^0 \;\,\, + \,\,2e\,\, \to \;\mathop O\limits^{ - 2} \) (2)
→ \(2\mathop {Al}\limits^0 {\rm{ }} + {\rm{ 3}}\mathop O\limits^0 \; \to \;2\mathop {Al}\limits^{ + 3} \,\,\,\, + \,\,\,3\mathop O\limits^{ - 2} \)
Ví dụ 2: Cân bằng phản ứng: Cu +HNO3 → Cu(NO3)2 + NO + H2O
- Bước 1. \(\mathop {Cu}\limits^0 {\rm{ }} + H\mathop N\limits^{ + 5} {O_{3\;}} \to {\rm{ }}\mathop {Cu}\limits^{ + 2} {\left( {N{O_3}} \right)_2}\; + {\rm{ }}\mathop N\limits^{ + 2} O\;{\rm{ }} + \;{\rm{ }}{H_2}O\)
- Bước 2.
\(\mathop {Cu}\limits^0 {\rm{ }} \to {\rm{ }}\mathop {Cu}\limits^{ + 2} \,\,\, + \,\,2e\) (1)
\(\mathop N\limits^{ + 5} \,\,\,\, + \,\,\,3e\,\,\, \to \mathop N\limits^{ + 2} \) (2)
Bước 3.
\(\begin{array}{l}
3\,\,\,x\,\,\,\,\mathop {Cu}\limits^0 {\rm{ }} \to {\rm{ }}\mathop {Cu}\limits^{ + 2} \,\,\, + \,\,2e\\
2\,\,\,x\,\,\,\mathop N\limits^{ + 5} \,\,\,\, + \,\,\,3e\,\,\, \to {\rm{ }}\mathop N\limits^{ + 2}
\end{array}\)
\(3\mathop {Cu}\limits^0 {\rm{ }} + 2\mathop N\limits^{ + 5} \to {\rm{ }}\mathop {3Cu}\limits^{ + 2} \; + {\rm{ 2}}\mathop N\limits^{ + 2} \) (3)
Bước 4. 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
c. Ý nghĩa và một số phản ứng oxi hóa - khử quan trọng
- Phản ứng oxi hoá-khử có ý nghĩa rất quan trọng, hầu hết các quá trình tự nhiên và nhân tạo trên Trái Đất có liên quan đến phản ứng oxi hoá - khử.
- Một số loại phản ứng oxi hoá - khử quan trọng có thể kể ra như:
+ Phản ứng liên quan đến việc cung cấp năng lượng:
- Quá trình oxi hoá các phân tử thường giải phóng một lượng lớn năng lượng.
- Từ xa xưa, con người đã biết cách đốt cháy than củi để lấy lửa sưởi ấm, nấu nướng,...Phản ứng sinh ra năng lượng dưới dạng nhiệt khi đốt than là: C + O2 → CO2
- Phản ứng này toả năng lượng.
- Các hoạt động của cơ thể đều cần năng lượng, sự hô hấp đã cung cấp oxygen để oxi hoá các chất, chẳng hạn đường glucose sinh ra năng lượng: C6H12O6 + 6O2 → 6CO2 + 6H2O
- Phản ứng này toả năng lượng.
+ Phản ứng liên quan đến việc lưu trữ năng lượng:
- Pin lithium – ion trong điện thoại, máy tính, cũng như acquy trong ô tô, xe máy có thể dự trữ năng lượng dưới dạng điện năng dựa vào các phản ứng oxi hoá - khử.
- Phản ứng quang hợp cũng là một trong những phản ứng oxi hoá - khử quan trọng nhất trên Trái Đất, năng lượng được lấy từ ánh sáng mặt trời và tích trữ trong tinh bột: 6CO2 + 6H2O → C6H12O6 + 6O2
- Bên cạnh những phản ứng oxi hoá - khử quan trọng, có ích lợi đối với con người, còn có một loại phản ứng oxi hoá - khử diễn ra ngoài ý muốn, chẳng hạn các phản ứng ăn mòn kim loại, như sự tạo gỉ. Hằng năm, lượng kim loại mất đi do sự tạo gỉ vào khoảng 10-30% lượng kim loại được sản xuất ra, gây tổn thất rất lớn về kinh tế.
|
- Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của ít nhất một nguyên tố hoá học. - Việc cân bằng phản ứng oxi hoá - khử dựa theo nguyên tắc: trong một phản ứng, tổng số electron nhường phải bằng tổng số electron nhận sự thăng bằng electron). |
|---|
Bài tập minh họa
Bài 1: Quá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây:
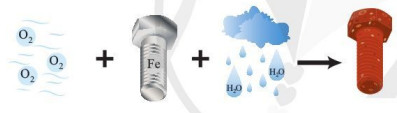
Trong quá trình này, hãy cho biết nguyên tử nguyên tố nào nhường electron, nguyên tố nào nhận electron. Giải thích.
Hướng dẫn giải
PT: 3O2 + 4Fe + 6H2O → 4Fe(OH)3↓
Fe → Fe3+ + 3e (nhường electron).
O2 + 4e → 2O2- (nhận electron).
Bài 2: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
A. Fe2 O3 + 6HNO3 → 2Fe(NO3 ) 3 + 3H2 O
B. H2 SO4 + Na2 O → Na2 SO4 + 2H2 O
C. Fe2 O3 + 3CO → 2Fe + 3CO2
D. 2AgNO3 + BaCl2 → Ba(NO3 ) 2 + 2AgCl ↓
Hướng dẫn giải
Nhắc lại: Phản ứng oxi hóa khử là phản ứng có sự thay đổi số oxi hóa.
Xét sự thay đổi số oxi hóa của các chất trong các phản ứng trên ta thấy chỉ có đáp án C có sự thay đổi số oxi hóa Fe3+xuống Fe0; C+2lên C+4
⇒ Chọn C
Bài 3: Cho dãy các chất và ion : Cl2, F2, SO2, Na+, Ca2+, Fe2+, Al3+, Mn2+, S2-, Cl-. Số chất và ion trong dãy đều có tính oxi hoá và tính khử là:
A. 3.
B. 4.
C. 6.
D. 5.
Hướng dẫn giải
Đáp án B
Các chất vừa có tính khử vừa có tính oxi hóa là: Cl2, SO2, Fe2+, Mn2+
Các chất chỉ có tính oxi hóa: F2, Na+, Ca2+, Al3+
Các chất chỉ có tính khử: S2-, Cl-
Bài 4: Xác định số oxi hóa của các ion sau: Na+, Cu2+, Fe2+, Fe3+, Al3+.
Hướng dẫn giải
|
Ion |
Na+ |
Cu2+ |
Fe2+ |
Fe3+ |
Al3+ |
|
Số oxi hóa |
+1 |
+2 |
+2 |
+3 |
+3 |
*Lưu ý: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích của ion đó.
Bài 5: Cân bằng phản ứng:
FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O
Hướng dẫn giải
Bước 1. Xác định sự thay đổi số oxi hóa:
Fe+2 → Fe+3
S-2 → S+6
N+5 → N+1
Bước 2. Lập thăng bằng electron:
Fe+2 → Fe+3 + 1e
S-2 → S+6 + 8e
FeS → Fe+3 + S+6 + 9e
2N+5 + 8e → 2N+1
→ Có 8FeS và 9N2O.
Bước 3. Đặt các hệ số tìm được vào phản ứng và tính các hệ số còn lại:
8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O
Luyện tập Bài 13 Hóa 10 Cánh Diều
Học xong bài học này, em có thể:
- Nếu được khái niệm và xác định được số oxi hoá của nguyên tử các nguyên tố trong hợp chất.
- Nêu được khái niệm về phản ứng oxi hoá- khử và ý nghĩa của phản ứng oxi hoá - khử.
- Mô tả được một số phản ứng oxi hoá - khử quan trọng gắn liền với cuộc sống.
- Cân bằng được phản ứng oxi hoá - khử bằng phương pháp thăng bằng electron.
3.1. Trắc nghiệm Bài 13 Hóa 10 Cánh Diều
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Cánh Diều Bài 13 cực hay có đáp án và lời giải chi tiết.
-
- A. 4
- B. 5
- C. 2
- D. 3
-
- A. Fe(OH)2 là chất khử, H2O là chất oxi hoá.
- B. Fe(OH)2 là chất khử, O2 là chất oxi hoá
- C. O2 là chất khử, H2O là chất oxi hoá.
- D. Fe(OH)2 là chất khử, O2 và H2O là chất oxi hoá
-
- A. 22.
- B. 24.
- C. 18.
- D. 16.
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 13 Hóa 10 Cánh Diều
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Cánh Diều Bài 13 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Luyện tập trang 71 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi trang 71 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 1 trang 72 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 2 trang 72 SGK Hóa học 10 Cánh Diều - CD
Luyện tập 3 trang 72 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi trang 72 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi trang 73 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 1 trang 74 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi 2 trang 74 SGK Hóa học 10 Cánh Diều - CD
Luyện tập trang 74 SGK Hóa học 10 Cánh Diều - CD
Vận dụng trang 75 SGK Hóa học 10 Cánh Diều - CD
Giải câu hỏi trang 75 SGK Hóa học 10 Cánh Diều - CD
Giải bài 1 trang 76 SGK Hóa học 10 Cánh Diều - CD
Giải bài 2 trang 76 SGK Hóa học 10 Cánh Diều - CD
Giải bài 3 trang 76 SGK Hóa học 10 Cánh Diều - CD
Giải bài 4 trang 76 SGK Hóa học 10 Cánh Diều - CD
Giải bài 5 trang 76 SGK Hóa học 10 Cánh Diều - CD
Giải bài 13.1 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.2 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.3 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.4 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.5 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.6 trang 37 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.7 trang 38 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.8 trang 38 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.9 trang 38 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.10 trang 39 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.11 trang 39 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.12 trang 39 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.13 trang 39 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.14 trang 40 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.15 trang 40 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.16 trang 40 SBT Hóa học 10 Cánh Diều - CD
Giải bài 13.17 trang 40 SBT Hóa học 10 Cánh Diều - CD
Hỏi đáp Bài 13 Hóa học 10 Cánh Diều
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





