Bộ đề thi chọn HSG môn Hóa học 10 năm 2021 có đáp án Trường THPT Long Châu Sa được hoc247 biên soạn và tổng hợp dưới đây sẽ hệ thống tất cả các bài tập tự luận có đáp án nhằm giúp bạn đọc củng cố kiến thức lý thuyết và rèn luyện kỹ năng giải bài tập môn Hóa học 10. Mời các bạn cùng tham khảo.
|
TRƯỜNG THPT LONG CHÂU SA |
ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG NĂM HỌC: 2020 - 2021 Môn thi: HÓA HỌC 10 |
ĐỀ SỐ 1
Câu 1: Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (trong đó R có số oxi hóa thấp nhất) là a%, còn trong oxit cao nhất là b%.
a) Xác định R biết a:b = 11:4.
b) Viết công thức phân tử, công thức electron, công thức cấu tạo của hai hợp chất trên.
c) Viết phương trình phản ứng khi cho oxit cao nhất của R tác dụng với dung dịch NaClO, dung dịch Na2CO3.
Câu 2: Cho sơ đồ phản ứng:
KClO3 → (X1) → clorua vôi → CaCO3 → (X2) → Ca(NO3)2
(X3) → (Y1) → lưu huỳnh → (Y2) → (Y1) → (Y3) → Na2SO4 → (Y4) → (Y5) → PbS.
(X3) → (Y1) → lưu huỳnh → (Y6) → (Y2) → (Y3) → (Y1) → K2SO4 → (Y7) → PbS.
Biết các chất X1, X2, X3 có phân tử khối thỏa mãn: X1+X2+X3 = 214; các chất Y1, Y2, Y3, Y4, Y5, Y6, Y7 là các hợp chất khác nhau của lưu huỳnh và có phân tử khối thoả mãn các điều kiện:
Y1+Y7 = 174
Y2+Y5 = 112
Y3+Y4 = 154
Y5+Y6 = 166
Mỗi mũi tên tương ứng với một phản ứng.
Hãy viết các phương trình hóa học của các phản ứng theo sơ đồ trên.
Câu 3: Nguyên tử nguyên tố R có tổng số electron ở các phân lớp s là 7.
a) Viết cấu hình electron nguyên tử của R. Xác định tên nguyên tố R.
b) Với R có phân lớp 3d đã bão hoà, hoà tan hoàn toàn m gam một oxit của R trong dung dịch H2SO4 đặc, nóng sinh ra 0,56 lít (ở đktc) khí SO2 là sản phẩm khử duy nhất. Hấp thụ toàn bộ lượng khí SO2 trên vào 2 lít dung dịch KMnO4 vừa đủ thu được dung dịch T (coi thể tích dung dịch không thay đổi).
- Viết các phương trình hoá học và tìm m.
- Tính nồng độ mol/l của dung dịch KMnO4 đã dùng.
Câu 4: Trong một bình kín dung tích không đổi chứa a mol O2, 2a mol SO2 ở 27,3OC; 10 atm và có mặt xúc tác V2O5 (chiếm thể tích không đáng kể. Nung nóng bình một thời gian ở 409,5oC cho đến khi áp suất trong bình là P (atm).
a) Lập biểu thức tính P theo hiệu suất h (%) và xét xem P thay đổi trong khoảng giá trị nào?
b) Nêu phương pháp tách riêng từng chất ra khỏi hỗn hợp sau phản ứng.
Câu 5: Cho 30,88 gam hỗn hợp Cu, Fe3O4 vào V ml dung dịch HCl 2M được dung dịch X và còn lại 1,28 gam chất rắn không tan. Cho AgNO3 dư tác dụng với dung dịch X được 0,56 lít khí (ở đktc) không màu hoá nâu trong không khí và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn.
a) Viết các phương trình phản ứng xảy ra.
b) Tính V và m?
Câu 6: Dung dịch X là dung dịch HCl. Dung dịch Y là dung dịch NaOH. Cho 60 ml dung dịch X vào cốc chứa 100 gam dung dịch Y, tạo ra dung dịch chỉ chứa một chất tan. Cô cạn dung dịch thu được 14,175 gam chất rắn Z. Nung Z đến khối lượng không đổi, thì chỉ còn lại 8,775 gam chất rắn.
a) Tìm nồng độ mol/l của dung dịch X, nồng độ phần trăm của dung dịch Y và công thức của Z.
b) Cho 16,4 gam hỗn hợp X1 gồm Al, Fe vào cốc đựng 840 ml dung dịch X. Sau phản ứng thêm tiếp 1600 gam dung dịch Y vào cốc. Khuấy đều cho phản ứng hoàn toàn, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi thu được 13,1 gam chất rắn Y1. Tìm thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp X1.
Câu 7: Điện phân dung dịch NaCl một thời gian được dung dịch A và khí thoát ra chỉ có V lít H2 (ở đktc). Cho dung dịch A vào dung dịch H2S, lắc kỹ để dung dịch A phản ứng vừa đủ với H2S được 0,16 gam chất rắn màu vàng và dung dịch B (không có khí thoát ra). Cho từ từ dung dịch Br2 0,1M vào dung dịch B đến khi thôi mất màu brom thấy hết 50 ml dung dịch và được dung dịch C. Cho dung dịch BaCl2 dư vào dung dịch C được 2,33 gam kết tủa.
a) Viết các phương trình phản ứng, xác định thành phần của A, B, C.
b) Tính V.
Câu 8: Cho sơ đồ thí nghiệm như hình vẽ:
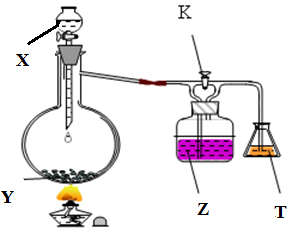
Hãy cho biết hiện tượng xảy ra trong thí nghiệm khi khóa K đóng, khóa K mở và giải thích. Biết các chất X, Y, Z, T trong mỗi thí nghiệm lần lượt là:
Thí nghiệm 1: H2SO4 đặc, C, dung dịch KMnO4, dung dịch Br2.
Thí nghiệm 2: dung dịch HCl, KMnO4, dung dịch KBr, dung dịch FeCl2.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi vui lòng xem tại online hoặc đăng nhập để tải về máy)---
ĐỀ SỐ 2
Câu 1: (2 điểm)
1. Cho nguyên tố X, ở trạng thái cơ bản có 11 electron thuộc các phân lớp p. X có hai đồng vị hơn kém nhau hai nơtron. Trong đồng vị số khối lớn, số hạt mang điện gấp 1,7 lần hạt không mang điện.
a. Viết cấu hình electron của X.
b. Xác định vị trí của X trong bảng tuần hoàn.
c. Xác định thành phần cấu tạo của hai đồng vị và thành phần % theo khối lượng của mỗi đồng vị trong X tự nhiên biết nguyên tử khối (NTK) trung bình của X bằng 35,48. Coi NTK có giá trị bằng số khối.
2. Hợp chất Z được tạo bởi hai nguyên tố M, R có công thức M3R trong đó R chiếm 6,67% về khối lượng. Trong hạt nhân nguyên tử của M có n = p + 4, còn trong hạt nhân của R có p’ = n’, trong đó n, p, n’, p’ là số nơtron và proton tương ứng của M và R. Biết rằng tổng số hạt proton trong phân tử Z là 84. Xác định công thức phân tử của Z ?
Câu 2: (2 điểm)
1. Viết các phương trình phản ứng xảy ra trong các thí nghiệm được mô tả sau:
a. Hòa tan FeCl2 vào nước rồi thêm H2SO4 loãng dư, sau đó thêm dung dịch KMnO4 dư thấy có khí màu vàng lục thoát ra và dung dịch thu được có chứa muối mangan (II).
b. Hòa tan Fe3O4 trong dung dịch H2SO4 đặc nóng dư được dung dịch A và khí B mùi hắc. Sục khí B vào dung dịch brom hoặc dung dịch KMnO4 đều thấy các dung dịch này bị nhạt màu.
2. H2SO4 đặc có tính háo nước, nó có thể lấy nước từ một số hợp chất hữu cơ. Trong quá trình than hóa saccarozơ có hình thành hỗn hợp khí A (gồm 2 khí).
a. Giải thích quá trình hình thành hỗn hợp khí A.
b. Trình bày phương pháp hóa học chứng minh sự có mặt của các khí trong A.
c. So sánh quá trình làm khô và quá trình than hóa của H2SO4 đặc.
Câu 3: (2 điểm)
1. Viết 6 phương trình phản ứng điều chế clo và cho biết phản ứng nào được dùng để điều chế clo trong công nghiệp.
2. Hoàn thành các phương trình phản ứng sau và cho biết các chất ứng với các chữ cái (A), (B),... tương ứng:
(1) FeS2 + khí (A) → chất rắn (B) + khí (D)
(2) (D) + khí (E) → chất rắn (F) + H2O
(3) (F) + (A) → (D)
(4) (E) + NaOH → (G) + H2O
(5) (G) + NaOH → (H) + H2O
(6) (H) + (I) → (K) + (L)
(7) (K) + HCl → (I) + (E)
(8) (E) + Cl2 + H2O → ...
Câu 4: (2 điểm)
Hòa tan m gam KMnO4 trong dung dịch HCl đặc dư được dung dịch A và V lít khí D (đktc). Pha loãng dung dịch A được 500 ml dung dịch B.
- Để trung hòa axit dư trong 50 ml dung dịch B cần dùng vừa đủ 24 ml dung dịch NaOH 0,5 M.
- Thêm AgNO3 dư vào 100 ml dung dịch B để kết tủa hoàn toàn ion clorua thu được 17,22 gam kết tủa.
a. Viết phương trình hóa học của các phản ứng xảy ra.
b. Tính nồng độ mol/lít các chất tan trong B.
c. Tính m, V và thể tích dung dịch HCl 36,5% (D = 1,18 g/ml) đã dùng.
Câu 5: (2 điểm)
Hỗn hợp X gồm Fe và kim loại M (hóa trị n không đổi). Hòa tan hoàn toàn m gam X trong dung dịch H2SO4 đặc nóng, dư được dung dịch A và V lít khí SO2 (đktc) là sản phẩm khử duy nhất. Hấp thụ hoàn toàn lượng SO2 trên bằng 500 ml dung dịch NaOH 0,2M được dung dịch chứa 5,725 gam chất tan.
Thêm vào m gam X lượng M gấp đôi lượng M ban đầu được hỗn hợp Y. Cho Y tan hết trong dung dịch HCl được 1,736 lít H2 (đktc).
Thêm một lượng Fe vào m gam X để được hỗn hợp Z chứa lượng sắt gấp đôi lượng sắt có trong X. Cho Z tác dụng với dung dịch H2SO4 loãng dư được dung dịch B chứa 5,605 gam muối.
a. Viết các phương trình hóa học của các phản ứng xảy ra.
b. Tính V.
c. Tìm kim loại M và thành phần % theo khối lượng mỗi kim loại trong X.
---(Nội dung đầy đủ, chi tiết phần đáp án của đề thi vui lòng xem tại online hoặc đăng nhập để tải về máy)---
...
Trên đây là một phần trích đoạn nội dung Bộ đề thi chọn HSG môn Hóa học 10 năm 2021 có đáp án Trường THPT Long Châu Sa. Để xem toàn bộ nội dung và đáp án đề kiểm tra các em chọn chức năng xem online hoặc đăng nhập vào trang hoc247.net để tải tài liệu về máy tính.
Hy vọng đề kiểm tra này sẽ giúp các em học sinh lớp 10 ôn tập tốt và đạt thành tích cao trong bài kiểm tra sắp tới.
Tư liệu nổi bật tuần
- Xem thêm
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)
ERROR:connection to 10.20.1.101:9312 failed (errno=111, msg=Connection refused)


