Giải câu hỏi 1 trang 37 SGK Khoa học tự nhiên 7 Kết nối tri thức
Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-.
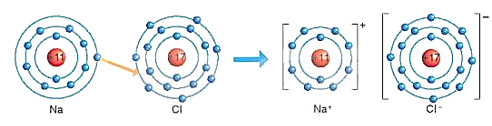
Hình 6.2. Sơ đồ mô tả sự hình thành liên kết ion trong phân tử NaCl
Hướng dẫn giải chi tiết câu hỏi 1 trang 37
Phương pháp giải
Quan sát Hình 6.2, đếm quả cầu màu xanh ở đường tròn ngoài cùng của nguyên tử Na, Cl, ion Na+, ion Cl-
Lời giải chi tiết
- Nguyên tử Na có 1 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Na+ có 8 electron ở lớp vỏ ngoài cùng (lớp 2)
- Nguyên tử Cl có 7 electron ở lớp vỏ ngoài cùng (lớp 3). Ion Cl- có 8 electron ở lớp vỏ ngoài cùng (lớp 3)
-- Mod Khoa học tự nhiên 7 HỌC247
Bài tập SGK khác
Giải câu hỏi trang 36 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 37 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 38 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 38 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 1 trang 39 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 39 SGK Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.1 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.2 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.3 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.4 trang 23 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.5 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.6 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.7 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.8 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.9 trang 24 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.10 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.11 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.12 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
Giải bài 6.13 trang 25 SBT Khoa học tự nhiên 7 Kết nối tri thức - KNTT
-


Phát biểu nào sau đây đúng?
bởi Nguyễn Hiền
 18/11/2022
18/11/2022
A. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
B. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
C. Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
D. Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Theo dõi (0) 1 Trả lời


