Giải bài 6 tr 33 sách GK Hóa lớp 9
Trộn 30ml dung dịch có chứa 2,22 g CaCl2 với 70 ml dung dịch có chứa 1,7 g AgNO3.
a) Hãy cho biết hiện tượng quan sát được và viết phương trình hóa học.
b) Tính khối lượng chất rắn sinh ra.
c) Tính nồng độ mol của chất còn lại trong dung dịch sau phản ứng. Cho rằng thể tích của dung dịch thay đổi không đáng kể.
Hướng dẫn giải chi tiết
Phương trình phản ứng
CaCl2 (dd) + 2AgNO3 → 2AgCl (r) + Ca(NO3)2 (dd)
Câu a:
Hiện tượng quan sát được: Tạo ra chất không tan, màu trắng, lắng dần xuống đáy cốc đó là AgCl
\(\\ n_{CaCl_{2}}= \frac{2,22}{111} = 0,02 \ mol \\ \\ n_{AgCl} = \frac{1,7 }{170} = 0,01 \ mol\)
Câu b:
Lượng chất rắn tạo thành:
mAgCl = 0,01 x 143,5 = 1,435 (g)
Câu c:
Lượng AgNO3 tác dụng hết với CaCl2, số mol CaCl2 dư là:
nCaCl2 dư = 0,02 – 0,005 = 0,015 mol
Do dung dịch thay đổi thể tích không đáng kể nên thể tích của dung dịch là:
Vdd = 0,03 + 0,07 = 0,1 (l)
Nồng độ các chất còn lại trong dung dịch sau phản ứng:
\(\\ C_{M_{CaCl_{2}}} =\frac{ 0,015 }{0,1} = 0,15 \ (M) \\ \\ C_{M_{Ca(NO_{3})_{2}}}= \frac{0,005}{0,1 } = 0,05 \ (M)\)
-- Mod Hóa Học 9 HỌC247
Video hướng dẫn giải SGK
Bài tập SGK khác
Bài tập 4 trang 33 SGK Hóa học 9
Bài tập 5 trang 33 SGK Hóa học 9
Bài tập 9.1 trang 11 SBT Hóa học 9
Bài tập 9.2 trang 11 SBT Hóa học 9
Bài tập 9.3 trang 11 SBT Hóa học 9
Bài tập 9.4 trang 11 SBT Hóa học 9
Bài tập 9.5 trang 12 SBT Hóa học 9
Bài tập 9.6 trang 12 SBT Hóa học 9
-


Tính nồng độ phần trăm của dd HCl đã dùng
bởi Phan Quân
 23/04/2019
23/04/2019
cho 50g hỗn hợp hai muối CaCO3 và CaSO4 tác dụng vừa đủ với 300g dd HCl. Sau khi phản ứng kết thúc thu đc 6,72 lít khí bay ra ở đktc
a, viết PTHH
b, Tính nồng độ phần trăm của dd HCl đã dùng
c, Tính thành phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu
Theo dõi (0) 1 Trả lời -


Hai muối nào sau đây có thể dùng tồn tại trong dung dịch
a NaCl và AgNO3
b K2SO4 và Ba(NO3)2
c Na2SO4 và KNO3
d CuSO4 và Na2S
e BaCl2 và KNO3
f FeSO4 và K2S
Theo dõi (0) 1 Trả lời -


Tính khối lượng muối khan sau phản ứng
bởi Thùy Nguyễn
 23/04/2019
23/04/2019
Hòa tan 55g hỗn hợp X2SO3 và X2CO3 cần 500ml HCl 2M. Tính khối lượng muối khan sau phản ứng.
...Thỉnh cao nhân, tôi giải mãi không raTheo dõi (0) 1 Trả lời -


Tính số mol hỗn hợp ban đầu
bởi Nguyễn Thị Trang
 23/04/2019
23/04/2019
cho dung dịch bạc nitrat tác dụng với dung dịch hỗn hợp có 6,25 gam muối KCl và KBr thu được 10,39 gam hỗn hợp kết tủa .Tính số mol hỗn hợp ban đầu
Theo dõi (0) 1 Trả lời -
ADMICRO


/ Ko được dùng thêm hóa chất nào #, hãy nhận biết 5 lọ mất nhãn sau : NaHSO4, Mg(HCO3)2, Ca(HCO3)2, Na2CO3, KHCO3
Theo dõi (0) 2 Trả lời -


Hòa tan hoàn toàn 14,2 gam hỗn hợp C gồm MgCO3 và muối cacbonat của kim loại R vào axit HCl 7,3% vừa đủ thu được dung dịch B và 3,36l CO2 (đktc) Nồng độ MgCl2 trong B là 6,082% Xác định kim loại R và tính % theo kim loại mỗi chất trong C
Theo dõi (0) 1 Trả lời -


Xác định công thức muối cacbonat trên
bởi Trần Bảo Việt
 23/04/2019
23/04/2019
Hòa tan 13,8 gam muối cacbonat của 1 kim loại hóa trị I trong 110ml dd HCl 2M sau khi phản ứng kết thúc thì oxit vẫn còn dư và thể tích khí thoát ra vượt quá 2016ml (đktc)
a) Xác định công thức muối cacbonat trên
b) Tính thể tích khí
Theo dõi (0) 1 Trả lời -


Tính khối lượng kết tủa
bởi thu phương
 23/04/2019
23/04/2019
Cho 29,25 g NaCl vào 250ml đ AgNO3 20% ( D= 1,14 g/ml )
a)Tính khối lượng kết tủa
b)Tính nồng độ phần trăm các chất sau phản ứng
Theo dõi (0) 1 Trả lời -


Hãy nhận biết các dung dịch naoh,Na2SO4,HCL,NaNO3
bởi hai trieu
 23/04/2019
23/04/2019
Hãy nhận biết các dung dịchNaOH,Na2SO4,HCL,NaNO3 bị mất nhãn đựng trong mỗi lọ bằng phương pháp hóa học. Viết phương trình nếu có
Theo dõi (0) 1 Trả lời -


Cách để nhận biết NaHSO3 và NaHCO3 mà không dùng thuốc thử ?
Theo dõi (0) 1 Trả lời -


Tìm công thức của muối sunfua
bởi sap sua
 23/04/2019
23/04/2019
đốt cháy hoàn toàn 4,4 g một muối sunfua kim loại M (MS) trong oxi dư. Chất rắn thu được sau phản ứng đem hòa tan trong một lượng H2SO4 vừa đủ 36,75% thu được dd X . Nồng độ phần trăm của dd X là 41,67% . Tìm vông thức của muối sunfua
Theo dõi (0) 1 Trả lời -


Tính tỉ lệ thể tích khí Oxi tạo thành của 2 phản ứng?
bởi Đan Nguyên
 23/04/2019
23/04/2019
Thực hiện nung a gam KClO3 và b gam KMnO4để thu khí Oxi.Sau khi phản ứng xảy ra hoàn toàn thì tháy khối lượng các chất còn lại sau phản ứng bằng nhau.
a)Tính tỉ lệ a/b?
b)Tính tỉ lệ thể tích khí Õi tạo thành của 2 phản ứng?
Giúp mk vs nha!!!
Theo dõi (0) 1 Trả lời -


Tính thành phần % thể tích hỗn hợp khí A
bởi Nguyễn Thanh Hà
 23/04/2019
23/04/2019
Hòa tan 55g hỗn hợp Na2CO3 và Na2SO3 với lượng vừa đủ 500 ml axit H2SO4 1M thu được 1 muối trung hòa duy nhất và hỗn hợp khí A. Tính thành phần % thể tích hỗn hợp khí A.
Theo dõi (0) 1 Trả lời -


Xác định công thức của muối ngậm nước
bởi thu trang
 23/04/2019
23/04/2019
Khi làm nguội 1026,4 g dd bão hòa muối sunfat kim loại kiềm có ngậm nước (M2SO4.nH2O) với 12>n>7 từ nhiệt độ 80oC xuống 10oC thì thấy có 395,4 g tinh thể ngậm nước tách ra.Độ tan ở 80oC là 28,3 g ; ở 10oC là 9g. Xác định công thức của muối ngậm nước
Theo dõi (0) 1 Trả lời -


Làm lạnh 600g dd bão hòa NaCl từ 90oC xuống 10oC thì có bao nhiêu gam tinh thể NaCl tách ra?
bởi Lê Minh Trí
 23/04/2019
23/04/2019
Làm lạnh 600g dd bão hòa NaCl từ 90oC xuống 10oC thì có bao nhiêu gam tinh thể NaCl tách ra( biết độ tan của tinh thể NaCL ở 90oC và 10oC lần lượt là 50g và 35g)
Theo dõi (0) 1 Trả lời -


Hỗn hợp A gồm Mg và MgCO3 tác dụng với dung dịch CH3C00H dư. Khí tạo thành dẫn qua dung dịch Ca(OH)2 dư thu được 10g kết tủa và còn lại 2,8 lít khí không màu (ở ĐKTC)
a, Viết phương trình hóa học
b, Tính thành phần % về khối lượng mỗi chất trong hỗn hợp A
Theo dõi (0) 1 Trả lời -


Viết 5 phương trình khác nhau BaCl2 tạo NaCl
bởi Nguyễn Tiểu Ly
 24/04/2019
24/04/2019
1/ Viết 5 phương trình khác nhau:
\(BaCl_2+?\)-> \(?+Nacl\)
Theo dõi (0) 1 Trả lời -


Trộn 100ml dung dịch \(Fe_2\left(SO_4\right)_3\) 1,5M với 150ml dung dịch \(Ba\left(OH\right)_2\) 2M.
a, Tính khối lượng kết tủa thu được sau phản ứng.
b, Tính nồng độ mol của các chất có trong dung dịch sau phản ứng
Theo dõi (0) 1 Trả lời -


Hãy tìm công thức hóa học của muối sắt đã dùng
bởi Kim Ngan
 24/04/2019
24/04/2019
cho 10 gam dung dịch muối sắt clorua 32.5% tác dụng với dung dịch bạc nitrat dư thì tạo thành 8.61gam kết tủa . Hãy tìm công thức hóa học của muối sắt đã dùng
Theo dõi (0) 1 Trả lời -


Xác định khối lượng MSO4 tách ra khi làm lạnh 800gdd MSO4 bão hòa ở 70oC xuống 20oC
bởi khanh nguyen
 24/04/2019
24/04/2019
xác định khối lượng MSO4 tách ra khi làm lạnh 800gdd MSO4 bão hòa ở 70oC xuống 20oC . Cho biết độ tan của MSO4 ở 70oC là 35,93g và ở 20oC là 21g
thank mình đang cần gấp
Theo dõi (0) 1 Trả lời -


Tính % khối lượng mỗi chất trong hỗn hợp đầu
bởi Lê Văn Duyệt
 24/04/2019
24/04/2019
1. Hoà tan 20 gam hỗn hợp gồm CaCO3 và CaSO4 bằng dung dịch HCl thu được 3,36 lít khí CO2(đktc) . Tính thành phần % khối lượng mỗi muối trong hỗn hợp đầu.
2. Cho 10 gam hỗn hợp gồm CaCO3,CuO,Al hoà tan trong HCl dư. Dẫn toàn bộ lượng khí thu được đi qua nước vôi trong dư thì thu được 1 gam kết tủa và còn lại là 0,672 lít khí không màu(đktc)
a, Viết các phương trình phản ứng xảy ra
b, Tính % khối lượng mỗi chất trong hỗn hợp đầu
Theo dõi (0) 1 Trả lời -


Xác định khối lượng hỗn hợp ACO3 và BCO3
bởi Nguyễn Thị Lưu
 24/04/2019
24/04/2019
Hoà tan hết m gam hỗn hợp gồm ACO3 và BCO3(A,B có hoá trị II)cần dùng 300ml dung dịch hcl 1M sau phản ứng thu được V lít khí CO2 và dd..cô cạn dd A thu được 30,1 gam muối khan.xác định m
Theo dõi (0) 1 Trả lời -


Hỏi khi làm lạnh 600g dd bão hòa CuSO4 ở 80oC xuống 5oC thì có bao nhiêu gam tinh thể CuSO4. 5H2O thoát ra?
bởi Aser Aser
 24/04/2019
24/04/2019
Cho biết độ tan của CuSO4 ở 5oC là 15g và ở 80oC là 50g . Hỏi khi làm lạnh 600g dd bão hòa CuSO4 ở 80oC xuống 5oC thì có bao nhiêu gam tinh thể CuSO4. 5H2O thoát ra?
Theo dõi (0) 1 Trả lời -


Nhận biết Na2CO3, NaCl, NaOH, KHSO4, Ba(OH)2
bởi Đào Lê Hương Quỳnh
 24/04/2019
24/04/2019
Cho 5 dung dịch sau: Na2CO3, NaCl, NaOH, KHSO4, Ba(OH)2
a) Chỉ dùng 1 hóa chất nhận biết cả 5 dung dịch trên
b) Không dùng thêm hóa chất nào cả, nhận biết 5 dung dịch trên có cùng nồng độ.
Theo dõi (0) 1 Trả lời -


một người làm vườn đã dùng 600g (NH4)2HPO4 để bón rau. nguyên tố dinh dưỡng nào có trong loại phân bón này. tính thành phần phần trăm của nguyên tố dinh dưỡng trong phân bón. tính khối lượng của nguyên tố dinh dưỡng bón cho ruộng rau
Theo dõi (0) 1 Trả lời -


Trình bày phương pháp hóa học để nhận biết KCl và K2CO3
bởi Hoa Hong
 24/04/2019
24/04/2019
Trình bày phương pháp hóa học để nhận biết KCl và K2CO3
Theo dõi (0) 1 Trả lời -


Nhận biết các dung dịch sau: K2CO3,Na2SO4,NaCl
bởi Bo Bo
 24/04/2019
24/04/2019
nhận biết các dung dịch sau: K2CO3,Na2SO4,NaCl
Theo dõi (0) 1 Trả lời -


Hỏi phản ứng NaHSO3 và Na2CO3 vào 200g dung dịch HCl 14,6% có xảy ra hoàn toàn không ?
bởi Truc Ly
 24/04/2019
24/04/2019
Cho 50g hỗn hợp gồm hai muối NaHSO3 và Na2CO3 vào 200g dung dịch HCl 14,6%. Hỏi phản ứng có xảy ra hoàn toàn không ?
Theo dõi (0) 1 Trả lời -


Ba dd muối Na2SO3 , NaHSO3, Na2SO4 có thể được phân biệt bằng những phản ứng hóa học nào ?
bởi thu hảo
 24/04/2019
24/04/2019
Câu 1/ Có 8 oxit ở dạng bột gồm: Na2O, CaO, Ag2O, Al2O3, Fe2O3, MnO2, CuO và CaC2. Bằng những phản ứng đặc trưng nào có thể phân biệt các chất đó ?
Câu 2/ Ba dd muối Na2SO3 , NaHSO3, Na2SO4 có thể được phân biệt bằng những phản ứng hóa học nào ?
Theo dõi (0) 1 Trả lời -


Trong phòng thí nghiệm để điều chế O2 người ta nung nóng KMnO4. Tính khối lượng KMnO4 cần dùng để thu được 1,12l khí O2 ở đktc. Biết hiệu suất phản ứng là 75%.
Cần gấp, cần gấp.
Theo dõi (0) 1 Trả lời -


Hiện tượng gì xảy ra khi cho dd naoh tác dụng với dd : k2so4,fe2(so4)3, na2so4, cuso4 ,nacl ,bacl2
bởi Truc Ly
 24/04/2019
24/04/2019
Hiện tượng gì xảy ra khi cho dd naoh tac dung với dd : k2so4,fe2(so4)3, na2so4, cuso4 ,nacl ,bacl2
Theo dõi (0) 1 Trả lời -


Tính khối lượng Mg và Fe
bởi Hoa Hong
 24/04/2019
24/04/2019
Cho m(g) hỗn hợp gồm Mg và Fe(nMg=nFe) vào dung dịch CuSO4 d,thu được 19.2 gam chất rắn . Tính giá trị của m
Theo dõi (0) 1 Trả lời -


Tìm khối lượng CaCO3 và KHCO3
bởi Thu Hang
 24/04/2019
24/04/2019
Mọi người giúp mình với ,đang cần gấp
Hòa tan m gam hỗn hợp x gồm CaCO3 và KHCO3 bằng dung dịch HCl dư sau phản ứng thu được 6.72 lít khí (đktc).Tìm m
Theo dõi (0) 1 Trả lời -


Cho từ từ dung dịch chứa 0,35 mol HCl vào dung dịch chứa 0,2 mol Na2CO3 thu được bao nhiêu ml khí CO2 thoát ra?
bởi Dương Minh Tuấn
 25/04/2019
25/04/2019
a)Cho từ từ dung dịch chứa 0,2 mol Na2CO3 vào dung dịch chứa 0,35 mol HCl thì thu được bao nhiêu ml khí CO2 thoát ra?
b)Cho từ từ dung dịch chứa 0,35 mol HCl vào dung dịch chứa 0,2 mol Na2CO3 thu được bao nhiêu ml khí CO2 thoát ra?
Theo dõi (0) 1 Trả lời -


Gọi tên các loại muối và cho biết muối nào là muối trung hòa, muối nào là muối axit?
bởi Phan Thị Trinh
 25/04/2019
25/04/2019
a, hãy nêu cách gọi tên muối
b, gọi tên các loại muối và cho biết muối nào là muối trung hòa, muối nào là muối axit? : KCl, NaNO3, FeCl2, FeCl3, Mg(NO3)2, Ca(HCO3)2, KHSO4
Theo dõi (0) 1 Trả lời -


Hoàn thành sơ đồ phản ứng
bởi nguyen bao anh
 25/04/2019
25/04/2019
Mình cần mn giải giúp câu này nè:
Viết các phương trình biểu diễn dãy chuyển hóa sau:
a) \(CaCO_3\underrightarrow{t^0}\left[{}\begin{matrix}A^{+B}\rightarrow C^{+D}\rightarrow E^{+F}\rightarrow CaCO_3\\P^{+X}\rightarrow Q^{+Y}\rightarrow R^{+Z}\rightarrow CaCO_3\end{matrix}\right.\)
b)\(A\underrightarrow{t^o}\left[{}\begin{matrix}B^{+D}\rightarrow E\\\xrightarrow[G]{B}A\\G\underrightarrow{t^o}F\end{matrix}\right.\xrightarrow[F]{E}A\)
Trong đó A,B,D,E,G,F là các chất vô cơ khác nhau
A là hợp chất của Ca
Theo dõi (0) 1 Trả lời -


Tính thể tích khí thu được
bởi hi hi
 25/04/2019
25/04/2019
a) cho rất từ từ dung dịch A chứa a mol HCl vào dung dịch B chứa b mol Na2CO3 (a <2b) thì thu được dung dịch C và V lít khí. tính V
b) Nếu cho dung dịch B và dung dịch A thì được D và V1 lít khí. biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở diều kiện tiêu chuẩn. lập biểu thức nếu mối quan hệ giữa V1 với a,b
Theo dõi (0) 1 Trả lời -


Cho 60g MgCO3 chứa 10% tạp chất tác dụng với dung dịch axit HCl 20%.
a) Viết PTHH.
b) Tính khối lượng HCl đã dùng để phản ứng xảy ra hoàn toàn.
c) Tính C% của dung dịch tạo thành.
Theo dõi (0) 1 Trả lời -


Tìm thể tích NaOH 1.5M va KOH 0.5M
bởi Huong Duong
 25/04/2019
Hòa tan 13g muối sắt clorua vào nước đc dd A chia A thành 2 phần bằng nhau phần 1 cho td vs dd AgNO3 dư thì thu được 17.22g kết tủa màu trắng.xác định công thức muối sắt clorua phần 2 cho tác dụng với V ml dd chứa NaOH 1.5M va KOH 0.5M đã lấy dư 25%so với lượng cần thiết lấy kết tủa đem nung đến kl koonh đổi thì thu đc a gam chất rắn Tìm V aTheo dõi (0) 1 Trả lời
25/04/2019
Hòa tan 13g muối sắt clorua vào nước đc dd A chia A thành 2 phần bằng nhau phần 1 cho td vs dd AgNO3 dư thì thu được 17.22g kết tủa màu trắng.xác định công thức muối sắt clorua phần 2 cho tác dụng với V ml dd chứa NaOH 1.5M va KOH 0.5M đã lấy dư 25%so với lượng cần thiết lấy kết tủa đem nung đến kl koonh đổi thì thu đc a gam chất rắn Tìm V aTheo dõi (0) 1 Trả lời -


Tìm công thức muối đem nung
bởi thanh hằng
 25/04/2019
25/04/2019
Nung 8,1g một muối cácbonat kim loại hóa trị II thu được nước và CO2 . Dẫn khí vào nước vôi trong thu được 10g kết tủa, tìm công thức muối đem nung
Theo dõi (0) 1 Trả lời -


Nhận biết NaCl; Na2CO3; Na2SO4; Ba(NO3)2.
bởi Mai Trang
 25/04/2019
25/04/2019
Trong phòng thí nghiệm có các loại lọ đựng dung dịch muối mất nhãn gồm:
NaCl; Na2CO3; Na2SO4; Ba(NO3)2. Chỉ sử dụng thêm một hóa chất, trình bày cách nhận biết các lọ đựng dung dịch muối trên.
Các bác làm hộ em.. em đang cần gấp.
Theo dõi (0) 1 Trả lời -


Các muối thường gặp là gì vậy?
bởi Quynh Nhu
 25/04/2019
25/04/2019
các muối thường gặp là gì vậy cho càng nhiều càng tốt nha , cảm ơn
Theo dõi (0) 1 Trả lời -


Điều chế được mấy lít khí SO2?
bởi Hoa Hong
 25/04/2019
25/04/2019
Hòa tan 111g hhX (CaSO3 và Na2SO3) vào 61,25g dd H2SO4 80%; sau khi phản ứng xong thig: điều chế được mấy lít khí SO2 (ĐKTC); cho rằng SO2 thoát ra hết.
Theo dõi (0) 1 Trả lời -


Tính C% của các chất sau phản ứng
bởi Anh Nguyễn
 25/04/2019
25/04/2019
200g dd CuSO4 có 16g CuSO4 với 300g dd NaOH có chứa 12g NaOH
a) Tính C% của các chất sau phản ứng
b) Tính mCuO=?
Theo dõi (0) 1 Trả lời -


Có 4 chất rắn Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng H2O và CO2, hãy phân biệt.
Theo dõi (0) 1 Trả lời -


Hãy nhận biết các chất sau KOH, K2SO4, KCl
bởi Lê Văn Duyệt
 25/04/2019
25/04/2019
Hãy nhận biết các chất sau :
a/ KOH, K2SO4, KCl
b/ Na2SO4, NaCl, NaNO3
Theo dõi (0) 1 Trả lời -


Tính nồng độ phần trăm của dd HCl đã dùng
bởi A La
 25/04/2019
25/04/2019
cho 5,3g Na2CO3 tác dụng hết với 100g dd HCl
a, viết pthh
b, tính thể tích khí ở đktc thu đc
c, tính nồng độ phần trăm của dd HCl đã dùng
d, tính nồng độ phần trăm của dd sau phản ứng
Theo dõi (0) 1 Trả lời -


Trình bày phương pháp để điều chế NaCl từ hỗn hợp trên viết phương trình minh họa
bởi hành thư
 25/04/2019
25/04/2019
Có một hỗn hợp chất rắn Na2CO3 , NaCl , NaHCO3 , CaCl2 . Trình bày phương pháp để điều chế NaCl từ hỗn hợp trên viết phương trình minh họa
Theo dõi (0) 1 Trả lời -


Tính khối lượng các chất trong kết tủa Y
bởi Cam Ngan
 25/04/2019
25/04/2019
Mình đăng bài này rồi nhưng không thấy ai trả lời nên phải đăng lại lần nữa
Trong 1 lít dung dịch hỗn hợp X gồm 0.2 mol Na2CO3 và 0.5 mol (NH4)2CO3. Cho 86 gam hỗn hợp BaCl2 và CaCl2 vào dung dịch X. Sau phản ứng kết thúc thu được 79.4 gam kết tủa Y. Tính khối lượng các chất trong kết tủa Y
Mình đang cần giải bài này gấp nếu mà không giải đc thì mách lối cho mình làm cũng đc mình cảm ơn
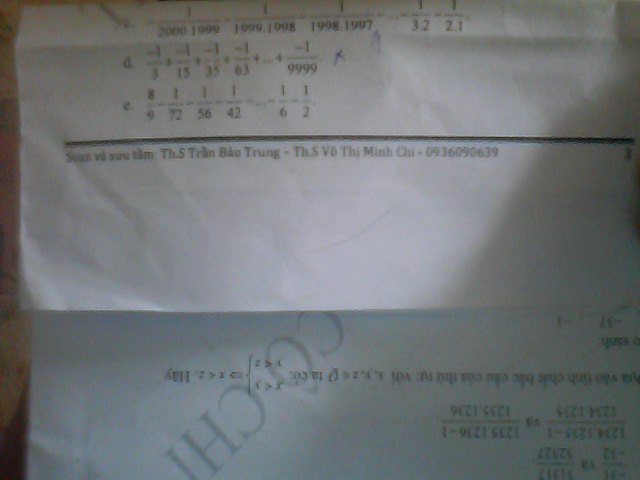
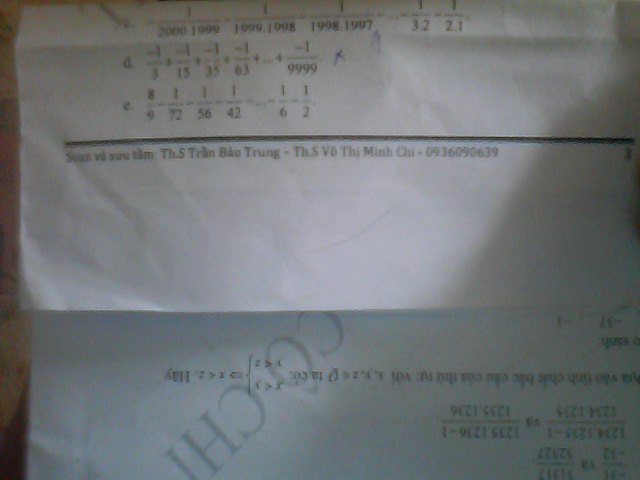
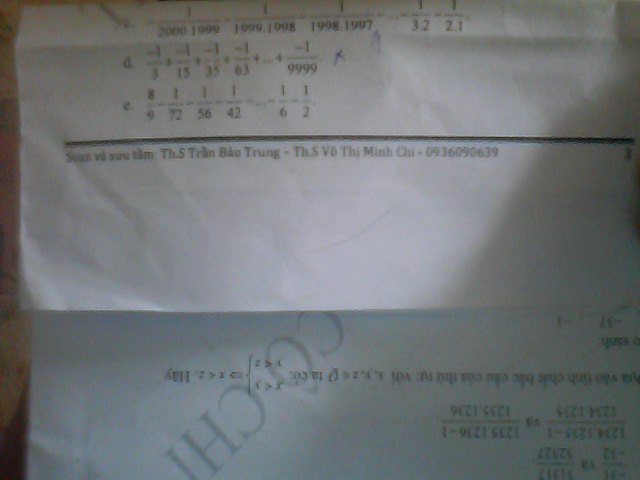 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tính khối lượng dd NaOH 10%
bởi Nguyễn Sơn Ca
 25/04/2019
25/04/2019
Cho 500ml dd H2SO4 1M tac dung voi 200ml dd BaCl2 0,5M
a, viet pt
b, tinh Cm/l cua dd thu duoc sau pu
c, tinh khoi luong ket tus thu duoc
d, tinh khoi luong dd NaOH 10% can dung de trung hoa het dd sau pu
Theo dõi (0) 1 Trả lời -


Tính khối lượng MgSo4
bởi Phan Thị Trinh
 25/04/2019
25/04/2019
Hòa tan 6g 2 muối MgCo3 và MgSo4 bằng H3So4 vừa đủ thì thu được 672 ml khí Co2 ở (đktc).
A) Viết PTPU
B)Tính thành phần % mỗi muối.
C) Tính khối lượng MgSo4
Theo dõi (0) 1 Trả lời -


Tính khối lượng kết tủa m1, m2
bởi Lê Chí Thiện
 25/04/2019
25/04/2019
Cho dd CuSO4 vào 500 ml dd NaOH 1M, phản ứng xảy ra vừa đủ thu được m1 (g) 1 kết tủa, rồi đem nung đến khối lượng không đổi thu được m2 chất rắn x
a) Viết PTHH
b) Tính m1 , m2
Theo dõi (0) 1 Trả lời -


Tính thể tích khí CO2
bởi Duy Quang
 25/04/2019
25/04/2019
Hòa tan hết m gam hỗn hợp gồm M2CO3 và RCO3 trong dung dịch HCL dư thu được dung dịch Y và V lít khí CO2 (đktc). Cô cạn dung dịch Y thì được (m+3,3) gam muối khan. Tính thể tích khí CO2
Theo dõi (0) 1 Trả lời





