Phß║ºn ├ön tß║¡p cuß╗æi n─âm luyß╗çn tß║¡p vß╗ü mß╗æi quan hß╗ç qua lß║íi giß╗»a c├íc loß║íi hß╗úp chß║Ñt v├┤ cãí v├á kim loß║íi, phi kim; T├¡nh chß║Ñt h├│a hß╗ìc cãí bß║ún cß╗ºa mß╗Öt sß╗æ hß╗úp chß║Ñt hß╗»u cãí. Vß║¡n dß╗Ñng ─æß╗â giß║úi mß╗Öt sß╗æ b├ái tß║¡p li├¬n quan.
Tóm tắt lÛ thuyết
1.1. H├ôA V├ö Cãá
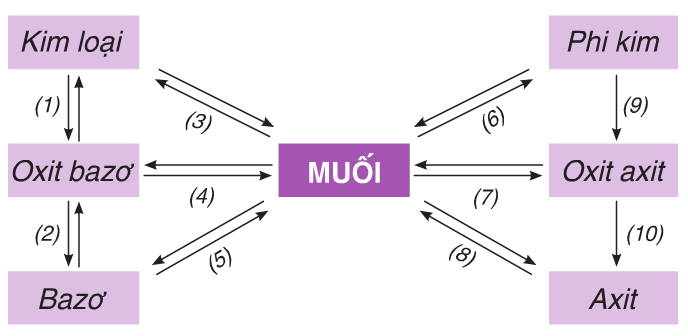
1.1.1. Mß╗æi quan hß╗ç giß╗»a c├íc loß║íi chß║Ñt v├┤ cãí
H├¼nh 1: Mß╗æi quan hß╗ç giß╗»a c├íc loß║íi chß║Ñt v├┤ cãí
1.1.2. Vận dụng
V├¡ dß╗Ñ 1: Viß║┐t phã░ãíng tr├¼nh phß║ún ß╗®ng ho├án th├ánh sãí ─æß╗ô sau:
Hã░ß╗øng dß║½n:
Fe + 2HCl  FeCl2 + H2
FeCl2 + Ag2SO4  FeSO4 + 2AgCl
FeSO4 + Ba(NO3)2  Fe(NO3)2 + BaSO4
Fe(NO3)2 + 2KOH  Fe(OH)2 + 2KNO3
Fe(OH)2 + O2 \(\overset{t^{0}}{\rightarrow}\) Fe2O3 + H2O
2Fe + 3Cl2  2FeCl3
2FeCl3 + 3Ag2SO4  Fe2(SO4)3 + 6AgCl
Fe2(SO4)3 + 3Ba(NO3)2  2Fe(NO3)3 + 3BaSO4
Fe(NO3)3 + 3KOH  Fe(OH)3 + 3KNO3
2Fe(OH)3 \(\overset{t^{0}}{\rightarrow}\) Fe2O3 + H2O
2FeCl2 (lß╗Ñc nhß║ít)+ Cl2 ÔåÆ 2FeCl3(v├áng n├óu)
2FeCl3 + Fe  3FeCl2
10FeSO4 + 2KMnO4 + 8H2SO4  5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Fe2(SO4)3 + Fe \(\overset{t^{0}}{\rightarrow}\) 3FeSO4
4Fe(NO3)2 + O2 + 4HNO3  4Fe(NO3)3 + 2H2O
2Fe(NO3)3 + Cu  2Fe(NO3)2 + Cu(NO3)2
4Fe(OH)2(trß║»ng xanh) + O2 + 2H2O ÔåÆ 4Fe(OH)3(n├óu ─æß╗Å)
V├¡ dß╗Ñ 2: Ho├án th├ánh c├íc phß║ún ß╗®ng sau:
Fe2(SO4)3 + ?  Fe(NO3)3 + ?
AlCl3 + ?  Al2(SO4)3 + ?
Al2O3 + KHSO4  ? + ? + ?
KHCO3 + Ca(OH)2  ? + ? + ?
NaCl + ?  NaOH + ?
Ca(HCO3)2 + ?  CaCO3 + ?
Hã░ß╗øng dß║½n:
Fe2(SO4)3 + 3Ba(NO3)2  2Fe(NO3)3 + 3BaSO4
2AlCl3 + 3Ag2SO4  Al2(SO4)3 + 6 AgCl
Al2O3 + 6KHSO4  Al2(SO4)3 + 3K2SO4 + 3H2O
KHCO3 + Ca(OH)2  CaCO3 + KOH + H2O
Điện phân có vách ngăn:
2NaCl + 2H2O  2NaOH + H2 + Cl2
Ca(HCO3)2 +K2CO3  CaCO3 + 2KHCO3
1.2. H├ôA Hß╗«U Cãá
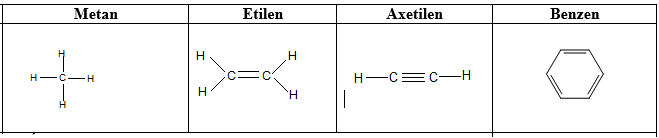
1.2.1. C├┤ng thß╗®c cß║Ñu tß║ío
H├¼nh 2: C├┤ng thß╗®c cß║Ñu tß║ío cß╗ºa mß╗Öt v├ái chß║Ñt hß╗»u cãí
1.2.2. Tính chất hóa học
a) Rã░ß╗úu etylic, axit axetic, chß║Ñt b├®o.
| Rã░ß╗úu etylic | Axit axetic | Chß║Ñt b├®o | |
| C├┤ng thß╗®c | C2H5OH | CH3COOH | (RCOO)3C3H5 |
| Phß║ún ß╗®ng ─æß╗æt ch├íy | C2H5OH +3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 3H2O | CH3COOH + 3O2 \(\overset{t^{0}}{\rightarrow}\) 2CO2 + 2H2O |
Chß║Ñt b├®o (RCOO)3C3H5 + O2 \(\overset{t^{0}}{\rightarrow}\) CO2 + H2O |
| Phß║ún ß╗®ng thß╗ºy ph├ón | Kh├┤ng phß║ún ß╗®ng | Kh├┤ng phß║ún ß╗®ng |
Chß║Ñt b├®o + Nã░ß╗øc \(\overset{axit,t^{0}}{\rightarrow}\) Glixerin + c├íc axit b├®o |
| Phß║ún ß╗®ng vß╗øi dung dß╗ïch kiß╗üm | Kh├┤ng phß║ún ß╗®ng | CH3COOH + NaOH ÔåÆ CH3COONa + H2O |
Chß║Ñt b├®o + dd kiß╗üm ÔåÆ Glixerin + C├íc muß╗æi cß╗ºa axit b├®o |
| Phß║ún ß╗®ng vß╗øi Na |
2C2H5OH + 2Na  2C2H5ONa + H2 |
2 CH3COOH + 2Na ÔåÆ 2CH3COONa + H2 | Kh├┤ng phß║ún ß╗®ng |
| Phß║ún ß╗®ng este h├│a |
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O |
CH3COOH + C2H5OH \(\rightleftharpoons\) CH3COOC2H5 + H2O | Kh├┤ng phß║ún ß╗®ng |
| T├íc dß╗Ñng vß╗øi muß╗æi cß╗ºa axit yß║┐u hãín | Kh├┤ng phß║ún ß╗®ng |
2 CH3COOH + CaCO3  (CH3COO)2Ca + CO2 + H2O |
Kh├┤ng phß║ún ß╗®ng |
| ß╗¿ng dß╗Ñng | D├╣ng l├ám rã░ß╗úu bia, nã░ß╗øc giß║úi kh├ít, nhi├¬n liß╗çu, nguy├¬n liß╗çu ─æiß╗üu chß║┐ c├íc chß║Ñt hß╗»u cãí,ÔǪ | Nguy├¬n liß╗çu ─æß╗â tß╗òng hß╗úp chß║Ñt dß║╗o, phß║®m nhuß╗Öm,dã░ß╗úc phß║®m,ÔǪ | L├á th├ánh phß║ºn cãí bß║ún trong thß╗®c ─ân cß╗ºa ngã░ß╗Øi v├á ─æß╗Öng vß║¡t, cung cß║Ñp n─âng lã░ß╗úng,ÔǪ |
b) Glucozãí, Saccarozãí, tinh bß╗Öt v├á xenlulozãí
| Glucozãí | Saccarozãí | Tinh bß╗Öt v├á xenlulozãí | |
| C├┤ng thß╗®c | C6H12O6 | C12H22O11 | (-C6H10O5-)n |
| Phß║ún ß╗®ng Oxi h├│a |
C6H12O6 + Ag2O\(\overset{NH_{3}}{\rightarrow}\) C6H12O7 + 2Ag. |
Kh├┤ng phß║ún ß╗®ng | Kh├┤ng phß║ún ß╗®ng |
| Phß║ún ß╗®ng l├¬n men |
C6H12O6 \(\overset{men\,\,giam}{\rightarrow}\)2C2H5OH + 2CO2 |
Kh├┤ng phß║ún ß╗®ng | Kh├┤ng phß║ún ß╗®ng |
| Phß║ún ß╗®ng thß╗ºy ph├ón | Kh├┤ng phß║ún ß╗®ng | C12H22O11 + H2O \(\xrightarrow[t^{0}]{Axit}\) C6H12O6 + C6H12O6 ÔÇï | (ÔÇôC6H10O5 ÔÇô)n + nH2O \(\xrightarrow[t^{0}]{Axit}\) nC6H12O6 |
| Phß║ún ß╗®ng vß╗øi iot | Kh├┤ng phß║ún ß╗®ng | Kh├┤ng phß║ún ß╗®ng | tß║ío m├áu xanh t├¡m |
Bài tập minh họa
Bài 1:
N├¬u phã░ãíng ph├íp t├ích hß╗ùn hß╗úp gß╗ôm MgO, Fe2O3, CuO ß╗ƒ thß╗â rß║»n th├ánh c├íc chß║Ñt nguy├¬n chß║Ñt.
Hã░ß╗øng dß║½n:
Trã░ß╗øc ti├¬n ta sß║¢ khß╗¡ c├íc oxit kim loß║íi tr├¬n bß║▒ng hi─æro ß╗ƒ nhiß╗çt ─æß╗Ö cao (chß╗ë c├│ oxit kim loß║íi ─æß╗®ng sau nh├┤m mß╗øi bß╗ï khß╗¡)
Ta c├│ phß║ún ß╗®ng khß╗¡ nhã░ sau: CuO + H2 ÔåÆ Cu + H2O; Fe2O3 + 3H2 ÔåÆ 2Fe + 3H2O
C├▓n lß║íi MgO kh├┤ng bß╗ï khß╗¡. Sau ─æ├│ ta cho c├íc chß║Ñt thu ─æã░ß╗úc t├íc dß╗Ñng vß╗øi axit HCl th├¼ Cu kh├┤ng phß║ún ß╗®ng v├á bß╗ï oxi h├│a ß╗ƒ ngo├ái kh├┤ng kh├¡ tß║ío th├ánh CuO:
2Cu + O2 ÔåÆ 2CuO. Ta t├ích ─æã░ß╗úc CuO ra khß╗Åi hß╗ùn hß╗úp.
MgO + 2HCl  MgCl2 + H2 ; Fe + 2HCl  FeCl2 + H2
Hai muß╗æi thu ─æã░ß╗úc l├á MgCl2 v├á FeCl2 ta cho ─æiß╗çn ph├ón dung dß╗ïch th├¼ FeCl2 bß╗ï ─æiß╗çn ph├ón tß║ío th├ánh Fe, sau ─æ├│ Fe bß╗ï oxi h├│a th├ánh Fe2O3 ta t├ích ─æã░ß╗úc Fe2O3
Muối MgCl2 không bị điện phân dung dịch thì ta điện phân nóng chảy tạo thành Mg, sau đó đốt nóng thì Mg bốc cháy trong không khí tạo ra MgO
MgCl2  Mg + Cl2; 2Mg + O2  2MgO
Cuß╗æi c├╣ng ta t├ích ─æã░ß╗úc cß║ú ba chß║Ñt tr├¬n ra khß╗Åi hß╗ùn hß╗úp th├ánh c├íc chß║Ñt nguy├¬n chß║Ñt.
Bài 2:
Hß╗ùn hß╗úp 3 kim loß║íi Fe, Al, Cu nß║Àng 17,4 gam. Nß║┐u h├▓a tan hß╗ùn hß╗úp bß║▒ng axit H2SO4 lo├úng dã░ th├¼ tho├ít ra 8,96 dm3 H2 (ß╗ƒ ─æktc). C├▓n nß║┐u h├▓a tan hß╗ùn hß╗úp bß║▒ng axit ─æß║Àc n├│ng, dã░ th├¼ tho├ít ra 12,32 dm3 SO2 (ß╗ƒ ─æktc). T├¡nh khß╗æi lã░ß╗úng mß╗ùi kim loß║íi ban ─æß║ºu.
Hã░ß╗øng dß║½n:
Cu kh├┤ng tan trong H2SO4 lo├úng, chß╗ë c├│ Fe v├á Al tan ─æã░ß╗úc trong axit lo├úng
Fe + H2SO4  FeSO4 + H2
2Al + 3H2SO4  Al2(SO4)3 + 3H2
H2SO4 ─æß║Àc n├│ng h├▓a tan cß║ú 3 kim loß║íi:
2Fe + 6H2SO4  Fe2(SO4)3 + 3SO2 + 6H2O
2Al + 6H2SO4  Al2(SO4)3 + 3SO2 + 6H2O
Cu + 2H2SO4  CuSO4 + SO2 + 2H2O
Số mol H2 = 0,4; số mol SO2 = 0,55
Gß╗ìi sß╗æ mol cß╗ºa Fe, Al, Cu lß║ºn lã░ß╗út l├á x, y, z ta c├│ :
\(\left\{ \begin{array}{l} 56x{\rm{ }} + {\rm{ }}27y{\rm{ }} + {\rm{ }}64z{\rm{ }} = {\rm{ }}17,4\\ x{\rm{ }} + {\rm{ }}1,5y = 0,4\\ 1,5x{\rm{ }} + {\rm{ }}1,5y{\rm{ }} + {\rm{ }}z{\rm{ }} = {\rm{ }}0,55 \end{array} \right. \Rightarrow \left\{ \begin{array}{l} x = 0,1(mol)\\ y = 0,2(mol)\\ z = 0,1(mol) \end{array} \right.\)
Khß╗æi lã░ß╗úng cß╗ºa sß║»t ban ─æß║ºu l├á: mFe = 0,1. 56 = 5,6 (gam)
Khß╗æi lã░ß╗úng cß╗ºa nh├┤m ban ─æß║ºu l├á: mAl = 0,2. 27 = 5,4 (gam)
Khß╗æi lã░ß╗úng cß╗ºa ─æß╗ông ban ─æß║ºu l├á: mCu = 0,1. 64 = 6,4 (gam)
Bài 3:
─Éß╗æt ch├íy ho├án to├án 0,295 gam chß║Ñt hß╗»u cãí X chß╗®a C, H, O thu ─æã░ß╗úc 0,44 gam CO2, 0,225 gam H2O. Trong mß╗Öt th├¡ nghiß╗çm kh├íc, khi ph├ón t├¡ch mß╗Öt lã░ß╗úng chß║Ñt X nhã░ tr├¬n cho 55,8 cm3 N2 (─æo ß╗ƒ ─æktc). Tß╗ë khß╗æi hãíi cß╗ºa X so vß╗øi H2 l├á 29,5. Lß║¡p CTHH v├á CTPT cß╗ºa X.
Hã░ß╗øng dß║½n:
MX = 59. ─Éß║Àt CTPT cß╗ºa X l├á CxHyOzNt
├üp dß╗Ñng c├┤ng thß╗®c: \(\frac{{{M_X}}}{{{m_X}}} = \frac{{44x}}{{{m_{C{O_2}}}}} = \frac{y}{{{m_{{H_2}O}}}} = \frac{{11,2t}}{{{V_{{N_2}}}}}\)
\(\frac{{59}}{{0,295}} = \frac{{44x}}{{0,44}} = \frac{y}{{0,225}} = \frac{{11,2t}}{{0,0558}}\)
=> x = 2; y = 5; t = 1
Vß╗øi MA = 59 => z = 1. Vß║¡y CTPT: C2H5ON
3. Luyện tập Bài 56 Hóa học 9
3.1. Trắc nghiệm
B├ái kiß╗âm tra Trß║»c nghiß╗çm H├│a hß╗ìc 9 B├ái 56 c├│ phã░ãíng ph├íp v├á lß╗Øi giß║úi chi tiß║┐t gi├║p c├íc em luyß╗çn tß║¡p v├á hiß╗âu b├ái.
-
- A. saccarozãí v├á tinh bß╗Öt.
- B. glucozãí v├á xenlulozãí
- C. glucozãí v├á saccarozãí
- D. saccarozãí v├á xenlulozãí.
-
- A. CH3COOH, (-C6H10O5-)n.
- B. CH3COOC2H5 , C2H5OH.
- C. CH3COOH , C2H5OH
- D. CH3COOH, CH3COOC2H5.
-
- A. tinh bß╗Öt, xenlulozãí, PVC, glucozãí.
- B. tinh bß╗Öt, xenlulozãí, saccarozãí, chß║Ñt b├®o.
- C. tinh bß╗Öt, xenlulozãí, saccarozãí, glucozãí.
- D. tinh bß╗Öt, xenlulozãí, saccarozãí, PE.
-
- A. Chß║Ñt b├®o, glucozãí, tinh bß╗Öt, xenlulozãí, saccarozãí
- B. Saccarozãí, glucozãí, tinh bß╗Öt, xenlulozãí, chß║Ñt b├®o
- C. Saccarozãí, glucozãí, tinh bß╗Öt, chß║Ñt b├®o, xenlulozãí
- D. Saccarozãí, glucozãí, chß║Ñt b├®o, xenlulozãí, tinh bß╗Öt
-
- A. 1,38 g
- B. 2,76 g
- C. 27,6 g
- D. 13,8 g
-
- A. 0.25M
- B. 0.2M
- C. 0.5M
- D. 2.5M
-
- A. 1,12 lít.
- B. 2,24 lít.
- C. 4,48 lít.
- D. 5,6 lít.
C├óu 8-20: Mß╗Øi c├íc em ─æ─âng nhß║¡p xem tiß║┐p nß╗Öi dung v├á thi thß╗¡ Online ─æß╗â cß╗ºng cß╗æ kiß║┐n thß╗®c vß╗ü b├ái hß╗ìc n├áy nh├®!
3.2. Bài tập SGK và Nâng cao
C├íc em c├│ thß╗â hß╗ç thß╗æng lß║íi nß╗Öi dung b├ái hß╗ìc th├┤ng qua phß║ºn hã░ß╗øng dß║½n Giß║úi b├ái tß║¡p H├│a hß╗ìc 9 B├ái 56.
Bài tập 1 trang 167 SGK Hóa học 9
Bài tập 2 trang 167 SGK Hóa học 9
Bài tập 3 trang 167 SGK Hóa học 9
Bài tập 4 trang 167 SGK Hóa học 9
Bài tập 5 trang 167 SGK Hóa học 9
Bài tập 1 trang 168 SGK Hóa học 9
Bài tập 2 trang 168 SGK Hóa học 9
Bài tập 3 trang 168 SGK Hóa học 9
Bài tập 4 trang 168 SGK Hóa học 9
Bài tập 5 trang 168 SGK Hóa học 9
Bài tập 6 trang 168 SGK Hóa học 9
Bài tập 7 trang 168 SGK Hóa học 9
4. Hß╗Åi ─æ├íp vß╗ü B├ái 56 chã░ãíng 5 H├│a hß╗ìc 9
Trong qu├í tr├¼nh hß╗ìc tß║¡p nß║┐u c├│ bß║Ñt k├¼ thß║»c mß║»c g├¼, c├íc em h├úy ─æß╗â lß║íi lß╗Øi nhß║»n ß╗ƒ mß╗Ñc Hß╗Åi ─æ├íp ─æß╗â c├╣ng cß╗Öng ─æß╗ông H├│a HOC247 thß║úo luß║¡n v├á trß║ú lß╗Øi nh├®.