Nß╗Öi dung b├ái luyß╗çn tß║¡p l├á hß╗ç thß╗æng ho├í kiß║┐n thß╗®c vß╗ü c├íc kh├íi niß╗çm cãí bß║ún: chß║Ñt, ─æãín chß║Ñt, hß╗úp chß║Ñt, nguy├¬n tß╗¡, nguy├¬n tß╗æ ho├í hß╗ìc, ph├ón tß╗¡. Cß╗ºng cß╗æ: ph├ón tß╗¡ l├á hß║ít hß╗úp th├ánh cß╗ºa hß║ºu hß║┐t c├íc chß║Ñt v├á nguy├¬n tß╗¡ l├á hß║ít hß╗úp th├ánh cß╗ºa ─æãín chß║Ñt kim loß║íi.
Tóm tắt lÛ thuyết
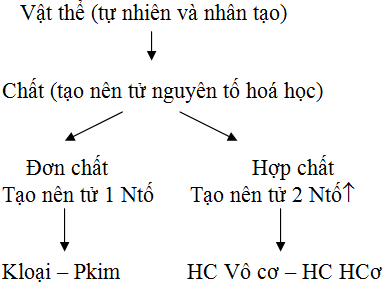
1.1. Sãí ─æß╗ô vß╗ü mß╗æi quan hß╗ç giß╗»a c├íc kh├íi niß╗çm
H├¼nh 1: Sãí ─æß╗ô vß╗ü mß╗æi quan hß╗ç giß╗»a c├íc kh├íi niß╗çm
1.2. Tổng kết về Chất - nguyên tử và phân tử
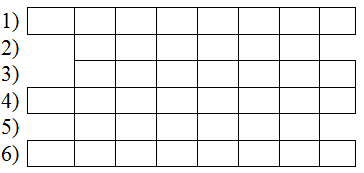
Tr├▓ chãíi ├┤ chß╗»:
- Câu 1: (8 chữ cái) Hạt vô cùng nhỏ, trung hoà về điện.
- C├óu 2: (6 chß╗» c├íi) Gß╗ôm nhiß╗üu chß║Ñt trß╗Ön lß║½n vß╗øi nhau.
- C├óu 3: (7 chß╗» c├íi) Khß╗æi lã░ß╗úng ph├ón tß╗¡ tß║¡p trung hß║ºu hß║┐t ß╗ƒ phß║ºn n├áy.
- Câu 4: (8 chữ cái) Hạt cấu tạo nên nguyên tử, mang giá trị điện tích âm.
- C├óu 5: (6 chß╗» c├íi) Hß║ít cß║Ñu tß║ío n├¬n hß║ít nh├ón nguy├¬n tß╗¡, mang gi├í trß╗ï ─æiß╗çn t├¡ch dã░ãíng.
- Câu 6: (8 chữ cái) Chỉ tập trung những nguyên tử cùng loại (có cùng số proton trong hạt nhân).
Đáp án:
Từ khóa là: PHÂN TỬ
Bài tập minh họa
Bài 1:
Chß╗ìn kh├íi niß╗çm ß╗ƒ cß╗Öt A gh├®p vß╗øi c├íc v├¡ dß╗Ñ ß╗ƒ cß╗Öt B sao cho ph├╣ hß╗úp?
| Cột A | Cột B |
|
1. Vật thể tự nhiên 2. Vật thể nhân tạo |
a. Con dao b. Quả chanh c. quyển sách d. hạt cát e. máy vi tính f. không khí g. biển h. ô tô |
Hã░ß╗øng dß║½n:
1. Vật thể tự nhiên: quả chanh, hạt cát, không khí, biển
2. Vật thể nhân tạo: con dao, quyển sách, máy vi tính, ô tô
Bài 2:
Gh├®p cß╗Öt A vß╗øi cß╗Öt B sao cho ph├╣ hß╗úp
| Cột A | Cột B |
|
1. Nguyên tử khối 2. Phân tử khối 3. Phân tử 4. Kí hiệu hóa học |
a.─Éß║íi diß╗çn cho chß║Ñt b. ─Éß║íi diß╗çn cho nguy├¬n tß╗æ h├│a hß╗ìc c. Khß╗æi lã░ß╗úng nguy├¬n tß╗¡ t├¡nh bß║▒ng ─ævC d. Khß╗æi lã░ß╗úng ph├ón tß╗¡ t├¡nh bß║▒ng ─ævC e. Biß╗âu diß╗àn nguy├¬n tß╗æ h├│a hß╗ìc, chß╗ë mß╗Öt nguy├¬n tß╗¡ cß╗ºa nguy├¬n tß╗æ |
Hã░ß╗øng dß║½n:
1 -c, 2-d, 3-b, 4 - e
Bài 3:
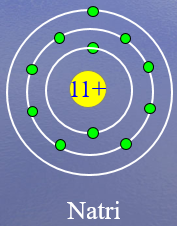
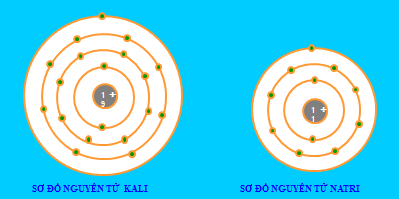
Nhìn vào mô hình cấu tạo của nguyên tử Natri và suy luận các thông tin sau:
1) Số proton?
2) Số electron?
3) Sß╗æ lß╗øp electron?
4) Sß╗æ electron lß╗øp ngo├ái c├╣ng?
Hã░ß╗øng dß║½n:
1) Số proton là 11
2) Số electron là 11
3) Sß╗æ lß╗øp electron l├á 3
4) Sß╗æ electron lß╗øp ngo├ái c├╣ng l├á 1 electron
Bài 4:
Nêu điểm giống và khác nhau giữa nguyên tử Kali và Natri.
Hã░ß╗øng dß║½n:
- Giß╗æng nhau: ─Éß╗üu c├│ 1 elctron ß╗ƒ lß╗øp ngo├ái c├╣ng
- Khác nhau:
- Kali c├│ 19 electron v├á c├│ 4 lß╗øp electron
- Natri c├│ 11 electron v├á c├│ 3 lß╗øp electron
Bài 5:
Ph├ón tß╗¡ mß╗Öt hß╗úp chß║Ñt gß╗ôm 1 nguy├¬n tß╗¡ nguy├¬n tß╗æ X li├¬n kß║┐t vß╗øi 4 nguy├¬n tß╗¡ hi─æro, v├á nß║Àng bß║▒ng nguy├¬n tß╗¡ oxi.
a, Tính Nguyên tử khối của X, cho biết tên và Kí hiệu hóa học của nguyên tố X.
b, T├¡nh % vß╗ü khß╗æi lã░ß╗úng cß╗ºa nguy├¬n tß╗æ X trong hß╗úp chß║Ñt.
Hã░ß╗øng dß║½n:
Ta c├│: X + 4 = 16 ÔçÆ x = 12
a. Nguyên tử khối của X là: 12 + 4 = 16
Tên của hợp chât X là Metan
Kí hiệu hóa học của nguyên tố X là C
b. % vß╗ü khß╗æi lã░ß╗úng cß╗ºa nguy├¬n tß╗æ Cacbon trong hß╗úp chß║Ñt metan l├á:
\(\% C = \frac{{12}}{{12 + 4}}.100 = 75(\% )\)
3. Luyện tập Bài 8 Hóa học 8
Sau bài học cần nắm:
- Ph├ón biß╗çt chß║Ñt v├á vß║¡t thß╗â, t├ích chß║Ñt ra khß╗Åi hß╗ùn hß╗úp, theo sãí ─æß╗ô nguy├¬n tß╗¡ chß╗ë ra c├íc th├ánh phß║ºn cß║Ñu tß║ío n├¬n nguy├¬n tß╗¡.
- Dß╗▒a v├áo bß║úng nguy├¬n tß╗¡ khß╗æi ─æß╗â t├¼m nguy├¬n tß╗¡ khß╗æi, ph├ón tß╗¡ khß╗æi v├á ngã░ß╗úc lß║íi.
3.1. Trắc nghiệm
B├ái kiß╗âm tra Trß║»c nghiß╗çm H├│a hß╗ìc 8 B├ái 8 c├│ phã░ãíng ph├íp v├á lß╗Øi giß║úi chi tiß║┐t gi├║p c├íc em luyß╗çn tß║¡p v├á hiß╗âu b├ái.
-
- A. H2O, Na, HCl, K, O2
- B. O2 , Ba , Fe , Cu , H2
- C. H2SO4 , NaCl , Mg , Cl2
- D. H2, O2 , HCl , CaO, H2O
-
- A. 1.
- B. 10.
- C. 12.
- D. -10
-
- A. Cß╗ôn ─æß╗â l├óu trong lß╗ì kh├┤ng k├¡n dß╗à bß╗ï bay hãíi
- B. Sắt bị gỉ trong không khí.
- C. H├▓a tan muß╗æi ─ân v├áo nã░ß╗øc ─æã░ß╗úc dd nã░ß╗øc muß╗æi.
- D. Nã░ß╗øc ─æ├í h├▓a tan th├ánh nã░ß╗øc lß╗Ång.
C├óu 4-10: Mß╗Øi c├íc em ─æ─âng nhß║¡p xem tiß║┐p nß╗Öi dung v├á thi thß╗¡ Online ─æß╗â cß╗ºng cß╗æ kiß║┐n thß╗®c vß╗ü b├ái hß╗ìc n├áy nh├®!
3.2. Bài tập SGK và Nâng cao
C├íc em c├│ thß╗â hß╗ç thß╗æng lß║íi nß╗Öi dung b├ái hß╗ìc th├┤ng qua phß║ºn hã░ß╗øng dß║½n Giß║úi b├ái tß║¡p H├│a hß╗ìc 8 B├ái 8.
Bài tập 1 trang 30 SGK Hóa học 8
Bài tập 2 trang 31 SGK Hóa học 8
Bài tập 3 trang 31 SGK Hóa học 8
Bài tập 4 trang 31 SGK Hóa học 8
Bài tập 5 trang 31 SGK Hóa học 8
Bài tập 8.1 trang 9 SBT Hóa học 8
Bài tập 8.2 trang 10 SBT Hóa học 8
Bài tập 8.3 trang 10 SBT Hóa học 8
Bài tập 8.4 trang 10 SBT Hóa học 8
Bài tập 8.5 trang 10 SBT Hóa học 8
Bài tập 8.6 trang 11 SBT Hóa học 8
Bài tập 8.7 trang 11 SBT Hóa học 8
Bài tập 8.8 trang 11 SBT Hóa học 8
Bài tập 8.9 trang 11 SBT Hóa học 8
4. Hß╗Åi ─æ├íp vß╗ü B├ái 8 chã░ãíng 1 H├│a hß╗ìc 8
Trong qu├í tr├¼nh hß╗ìc tß║¡p nß║┐u c├│ bß║Ñt k├¼ thß║»c mß║»c g├¼, c├íc em h├úy ─æß╗â lß║íi lß╗Øi nhß║»n ß╗ƒ mß╗Ñc Hß╗Åi ─æ├íp ─æß╗â c├╣ng cß╗Öng ─æß╗ông H├│a HOC247 thß║úo luß║¡n v├á trß║ú lß╗Øi nh├®.