Hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 8 Bài 8: Quy tắc Octet môn Hóa học lớp 10 CTST giúp các em học sinh nắm vững phương pháp giải bài tập và ôn luyện tốt kiến thức.
-
Giải câu hỏi 1 trang 52 SGK Hóa học 10 Chân trời sáng tạo - CTST
Hình 8.1 giải thích sự hình thành phân tử hydrogen (H2) và fluorine (F2) từ các nguyên tử. Theo em, các nguyên tử hydrogen và fluorine đã “bắt chước” cấu hình electron của các nguyên tử khí hiếm nào khi tham gia liên kết?
.jpg)
-
Giải câu hỏi 2 trang 52 SGK Hóa học 10 Chân trời sáng tạo - CTST
Sử dụng sơ đồ tương tự như Hình 8.1, hãy giải thích sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng
.jpg)
Hình 8.1. Sự hình thành các phân tử hydrogen và flurione
-
Giải câu hỏi 3 trang 53 SGK Hóa học 10 Chân trời sáng tạo - CTST
Từ Hình 8.2, cho biết mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của nguyên tử khí hiếm nào?
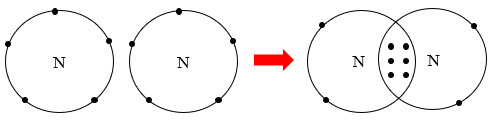
Hình 8.2. Sự hình thành liên kết trong phân tử nitrogen
-
Luyện tập trang 53 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử của các nguyên tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các electron hóa trị khi tham gia liên kết hình thành phân tử hydrogen fluoride (HF)?
- VIDEOYOMEDIA
-
Giải câu hỏi 4 trang 53 SGK Hóa học 10 Chân trời sáng tạo - CTST
Ion sodium và ion fluoride có cấu hình electron của các khi hiếm tương ứng nào?
-
Giải câu hỏi 5 trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Trình bày sự hình thành ion lithium. Cho biết ion lithium có cấu hình electron của khí hiếm tương ứng nào?
-
Luyện tập trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Biết phân tử magnesium oxide hình thành bởi các ion Mg2+ và O2-. Vận dụng quy tắc octet, trình bày sự hình thành các ion trên từ những nguyên tử tương ứng.
-
Giải bài 1 trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm argon khi tham gia hình thành liên kết hóa học?
A. Fluorine
B. Oxygen
C. Hydrogen
D. Chlorine
-
Giải bài 2 trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Để đạt quy tắc octet, nguyên tử của nguyên tố potassium (Z = 19) phải nhường đi
A. 2 electron
B. 3 electron
C. 1 electron
D. 4 electron
-
Giải bài 3 trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng quy tắc octet, trình bày sơ đồ mô tả sự hình thành phân tử potassium chloride (KCl) từ nguyên tử của các nguyên tố potassium và chlorine.
-
Giải bài 4 trang 54 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải thích sự hình thành liên kết trong phân tử H2O bằng cách áp dụng quy tắc octet?
-
Giải bài 8.1 trang 28 SBT Hóa học 10 Chân trời sáng tạo - CTST
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững.
B. Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng.
C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8.
D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất.
-
Giải bài 8.2 trang 28 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
A. Chlorine.
B. Sulfur.
C. Oxygen.
D. Hydrogen.
-
Giải bài 8.3 trang 28 SBT Hóa học 10 Chân trời sáng tạo - CTST
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
A. helium.
B. argon.
C. krypton.
D. neon.
-
Giải bài 8.4 trang 28 SBT Hóa học 10 Chân trời sáng tạo - CTST
Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
A. Helium và argon.
B. Helium và neon.
C. Neon và argon.
D. Argon và helium.
-
Giải bài 8.5 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
A. Neon và argon.
B. Helium và xenon.
C. Helium và radon.
D. Helium và krypton.
-
Giải bài 8.6 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
A. cho đi 2 electron.
B. nhận vào 1 electron.
C. cho đi 3 electron.
D. nhận vào 2 electron.
-
Giải bài 8.7 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
A. 3.
B. 2.
C. 5.
D. 4.
-
Giải bài 8.8 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
A. H2O. B. NH3. C. HCl. D. BF3.
-
Giải bài 8.9 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Em hãy nêu tên và công thức hoá học của 1 chất ở thể rắn, 1 chất ở thể lỏng và 1 chất ở thể khí (trong điều kiện thường), trong đó nguyên tử oxygen đạt được cấu hình bền của khí hiếm neon.
-
Giải bài 8.10 trang 29 SBT Hóa học 10 Chân trời sáng tạo - CTST
Potassium iodide (KI) được sử dụng như một loại thuốc long đờm, giúp làm lỏng và phá vỡ chất nhầy trong đường thở, dùng cho các bệnh nhân hen suyễn, viêm phế quản mãn tính. Trong trường hợp bị nhiễm phóng xạ, KI còn giúp ngăn tuyến giáp hấp thụ iodine phóng xạ, bảo vệ và giảm nguy cơ ung thư tuyến giáp. Trong phân tử KI, các nguyên tử K và I đều đã đạt được cơ cấu bền của khí hiếm gần nhất. Đó lần lượt là những khí hiếm nào?





