Giải bài 11 tr 119 sách GK Hóa lớp 10
Trong một dung dịch có hòa tan 2 muối NaBr và NaCl. Nồng độ phần trăm của mỗi muối trong dung dịch đều bằng nhau và bằng C%. Hãy xác định nồng độ C% của 2 muối trong dung dịch, biết rằng 50g dung dịch hai muối nói trên tác dụng vừa đủ với 50ml dung dịch AgNO3 8%, có khối lượng riêng D = 1,0625 g/cm3.
Hướng dẫn giải chi tiết bài 11
Số mol Bạc nitrat là:
\({n_{AgN{O_3}}} = \frac{{50.1,0625.8}}{{100.170}} = 0,025(mol)\)
Phương trình hóa học của phản ứng:
NaBr + AgNO3 → AgBr↓ + NaNO3
x mol x mol x mol
NaCl + AgNO3 → AgCl↓ + NaNO3
y mol y mol y mol
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dung dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
Ta có hệ phương trình đại số:
\(\left\{ \begin{array}{l}
x + y = 0,025\\
103x = 58,5y
\end{array} \right.\)
Giải ra, ta có x = 0,009 mol NaBr
Khối lượng muối Natribromua là:
→ mNaBr = mNaCl = 103 x 0,009 = 0,927g
Nông độ phần trăm của dung dịch là:
\(C\% = \frac{{0,927}}{{50}}.100\% = 1,86\% \)
-- Mod Hóa Học 10 HỌC247
Video hướng dẫn giải bài 11 SGK
Bài tập SGK khác
Bài tập 8 trang 119 SGK Hóa học 10
Bài tập 9 trang 119 SGK Hóa học 10
Bài tập 10 trang 119 SGK Hóa học 10
Bài tập 12 trang 119 SGK Hóa học 10
Bài tập 13 trang 119 SGK Hóa học 10
Bài tập 14 trang 119 SGK Hóa học 10
Bài tập 26.1 trang 60 SBT Hóa học 10
Bài tập 26.2 trang 60 SBT Hóa học 10
Bài tập 26.3 trang 60 SBT Hóa học 10
Bài tập 26.4 trang 61 SBT Hóa học 10
Bài tập 26.5 trang 61 SBT Hóa học 10
Bài tập 26.6 trang 61 SBT Hóa học 10
Bài tập 26.7 trang 61 SBT Hóa học 10
Bài tập 26.8 trang 61 SBT Hóa học 10
Bài tập 26.9 trang 61 SBT Hóa học 10
Bài tập 26.10 trang 61 SBT Hóa học 10
Bài tập 26.11 trang 61 SBT Hóa học 10
Bài tập 26.12 trang 62 SBT Hóa học 10
Bài tập 26.13 trang 62 SBT Hóa học 10
Bài tập 26.14 trang 62 SBT Hóa học 10
Bài tập 26.15 trang 62 SBT Hóa học 10
Bài tập 26.16 trang 62 SBT Hóa học 10
Bài tập 1 trang 149 SGK Hóa học 10 nâng cao
Bài tập 2 trang 149 SGK Hóa học 10 nâng cao
Bài tập 3 trang 149 SGK Hóa học 10 nâng cao
Bài tập 4 trang 149 SGK Hóa học 10 nâng cao
Bài tập 5 trang 150 SGK Hóa học 10 nâng cao
Bài tập 6 trang 150 SGK Hóa học 10 nâng cao
Bài tập 7 trang 150 SGK Hóa học 10 nâng cao
Bài tập 8 trang 150 SGK Hóa học 10 nâng cao
-


Dùng 4,48 lít (đktc) H2 tác dụng 2,24 lít (đktc) một halogen X đến khi phản ứng hoàn toàn thu được khí Y . Dẫn khí Y vào dung dịch AgNO3 dư thấy tạo ra 28,7 gam kết tủa. Hãy tìm X?
bởi Van Tho
 12/05/2022
Theo dõi (0) 1 Trả lời
12/05/2022
Theo dõi (0) 1 Trả lời -


Cho hình vẽ điều chế Clo trong phòng Thí nghiệm như sau:
bởi Sasu ka
 12/05/2022
12/05/2022
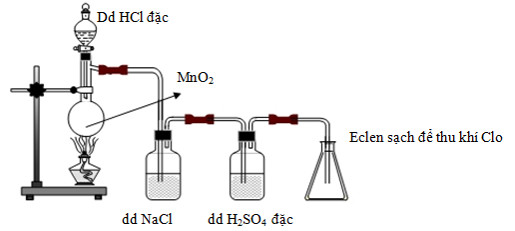
Phát biểu nào sau đây không đúng?
A. Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO.
B. Khí Clo thu được trong bình eclen là khí Clo khô.
C. Có thể thay MnO2 bằng KMnO4 hoặc KClO3.
D. Không thể thay dung dịch HCl đặc bằng dung dịch NaCl.
Theo dõi (0) 1 Trả lời -


Khi sản xuất chlorine trong công nghiệp, NaOH và H2 được tạo thành ở cực âm, còn Cl2 được tạo thành từ cực dương. Tại sao cần sử dụng màng ngăn xốp để ngăn cách 2 điện cực?
bởi ngọc trang
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Viết phương trình hóa học minh họa tính oxi hóa giảm dần trong dãy Cl2, Br2, I2
bởi Sam sung
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -
ADMICRO


Phản ứng thế của một số muối halide Chuẩn bị: 3 ống nghiệm, dung dịch NaBr, dung dịch NaI, nước Cl2, nước Br2 loãng.
bởi Việt Long
 16/04/2022
16/04/2022
Tiến hành:
- Lấy khoảng 2 mL dung dịch NaBr vào ống nghiệm (1), 2 mL dung dịch NaI vào mỗi ống nghiệm (2) và (3)
- Thêm vào ống nghiệm (1) và (2) vài giọt nước Cl2, thêm vào ống (3) vài giọt nước Br2, lắc đều các ống nghiệm
Lưu ý: Cẩn thận không để nước Cl2, nước Br2 giây ra tay, quần áo
Quan sát sự thay đổi màu của dung dịch trong các ống nghiệm và trả lời câu hỏi:
1. Nhận xét sự thay đổi màu của dung dịch trong các ống nghiệm
2. So sánh tính oxi hóa của Cl2, Br2, I2
3. Hãy chọn một thuốc thử để chứng tỏ có sự tạo thành I2 khi cho nước chlorine (hoặc nước bromine) tác dụng với dung dịch sodium iodine
Theo dõi (0) 1 Trả lời -


Khí Cl2 phản ứng với dung dịch sodium hydrogen nóng tạo thành sodium chlorine, sodium chlorate và nước Lập phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử
bởi lê Phương
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Đính một mẩu giấy màu ẩm vào thanh kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mầu giấy vào bình tam giác chứa khí chlorine
bởi Vũ Hải Yến
 15/04/2022
15/04/2022
Quan sát hiện tượng và trả lời câu hỏi:
1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích
2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hóa – tự khử trong phản ứng này?
Theo dõi (0) 1 Trả lời -


Một nhà máy nước sử dụng 5 mg Cl2 để khử trùng 1 L nước sinh hoạt. Tính khối lượng Cl2 nhà máy cần dùng để khử trùng 80 000 m3 nước sinh hoạt
bởi Huong Duong
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Xác định chất oxi hóa, chất khử trong phản ứng sodium và iron với chlorine, dùng mũi tên chỉ rõ sự nhường electron từ chất khử sang chất oxi hóa
bởi Thùy Trang
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Nguyên tử halogen có thể nhận 1 electron từ nguyên tử kim loại hoặc góp chung electron với nguyên tử phi kim Mô tả sự hình thành liên kết trong phân tử NaCl và HCl để minh họa
bởi Hoàng Anh
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Trong tự nhiên, các nguyên tố halogen tồn tại ở dạng hợp chất. Viết công thức một vài hợp chất của halogen thường được dùng trong thực tế?
bởi Long lanh
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Từ các số oxi hóa của chlorine, hãy giải thích tại sao Cl2 vừa có tính oxi hóa vừa có tính khử?
bởi Ngoc Son
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Xác định số oxi hóa của chlorine trong các chất sau: Cl2, HCl, HClO, HClO2, HClO3, HClO4?
bởi Phong Vu
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Dựa vào bán kính nguyên tử, hãy dự đoán xu hướng biến đổi độ dài liên kết trong dãy các phân tử halogen?
bởi Tieu Giao
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -


Liên kết trong phân tử halogen là liên kết cộng hóa trị phân cực hay không phân cực?
bởi minh vương
 16/04/2022
Theo dõi (0) 1 Trả lời
16/04/2022
Theo dõi (0) 1 Trả lời -

 Theo dõi (0) 1 Trả lời
Theo dõi (0) 1 Trả lời -


Tra cứu số liệu Bảng 6.1, Bảng 6.2 và Hình 6.2 để hoàn thành bảng mô tả một số đặc điểm cấu tạo của các nguyên tử halogen theo mẫu sau:
bởi sap sua
 16/04/2022
16/04/2022
Nguyên tử
Lớp electron ngoài cùng
Bán kính nguyên tử
Độ âm điện
Fluorine
?
?
?
Chlorine
?
?
?
Bromine
?
?
?
Iodine
?
?
?
Từ bảng số liệu thu được, hãy:
a) Giải thích tại sao nguyên tử halogen có xu hướng nhận 1 electron từ nguyên tử kim loại, hoặc góp chung 1 electron với nguyên tử phi kim, để hình thành liên kết.
b) Nêu và giải thích xu hướng biến đổi bán kính nguyên tử, độ âm điện của các nguyên tử halogen. Từ đó dự đoán xu hướng biến đổi tính oxi hóa từ F đến I
c) Dựa vào cấu hình electron lớp ngoài cùng và độ âm điện, giải thích tại sao nguyên tử fluorine chỉ có số oxi hóa -1 trong các hợp chất?
Theo dõi (0) 1 Trả lời





