Nội dung Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học lớp 10 chương trình SGK Chân trời sáng tạo sẽ giúp các em ôn tập lý thuyết, luyện tập các bài tập liên quan đến xác định cấu hình electron, từ đó có thể học tốt môn Hóa học lớp 10. Mời các em cùng tham khảo.
Tóm tắt lý thuyết
1.1. Lịch sử phát minh bảng tuần hoàn các nguyên tố hóa học
- Người ta đã tìm cách phân loại các nguyên tố hóa học khi đã biết một số nguyên tố đáng kể.
+ Năm 1789, cách phân loại đầu tiên được A. Lavoisier (người Pháp) thực hiện: xếp 33 nguyên tố hóa học thành nhóm các chất khí, kim loại, phi kim và "đất".
+ Năm 1829, J. W. Dobereiner (người Đức) phân loại các nguyên tố thành các nhóm có tính chất hóa học giống nhau. Ví dụ: lithium, sodium và potassium là nhóm các kim loại mềm, dễ phản ứng.
+ Năm 1866, J. Newlands (người Anh) đã xếp các nguyên tố hóa học theo chiều tăng khối lượng nguyên tử thành các octave (quãng tám), trong đó nguyên tử thứ 8 lặp lại tính chất của nguyên tố đầu tiên.
+ Năm 1869, 2 nhà hóa học D. I. Mendeleev (người Nga) và J. L. Meyer (người Đức) đều sắp xếp các nguyên tố theo chiều tăng khối lượng nguyên tử vào các hàng và cột, bắt đầu mỗi hàng (bảng của Mendeleev) hoặc cột mới (bảng của Meyer) khi các tính chất của nguyên tố bắt đầu lặp lại.

D. I. Mendeleev (1834 - 1907)
- Trong bảng tuần hoàn các nguyên tố hóa học của Mendeleev, ông đã thay đổi vị trí một số nguyên tố để tính chất của nguyên tố phù hợp với quy luật, đồng thời để trống một số chỗ cho các nguyên tố chưa biết.
- Sau này các nguyên tố ở vị trí còn trống đó được tìm ra và tính chất của chúng đều phù hợp với dự đoán của Mendeleev.
.jpg)
Hình 5.1. Bảng tuần hoàn các nguyên tố hóa học của Mendeleev (1869)
- Hiện nay, với những hiểu biết về cấu tạo nguyên tử, bảng tuần hoàn các nguyên tố hóa học hiện đại sắp xếp 118 nguyên tố theo chiều tăng của điện tích hạt nhân nguyên tử.
- Bảng tuần hoàn chứa 118 nguyên tố hóa học được sắp xếp theo nguyên tắc sau:
+ Các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số electron trong nguyên tử được xếp thành 1 hàng.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
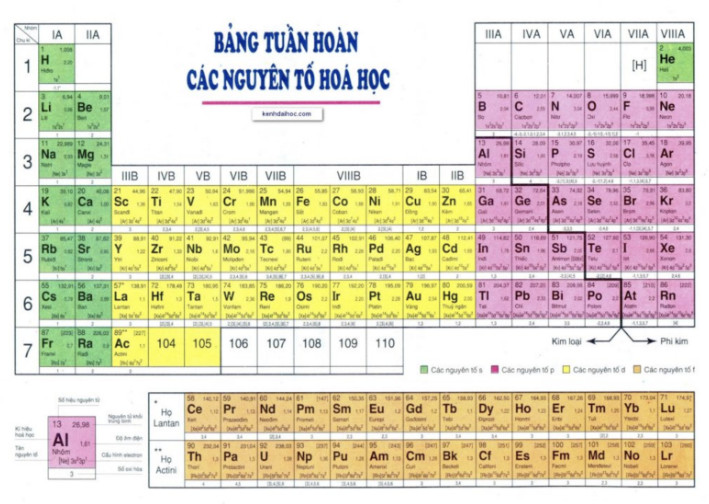
Hình 5.2. Bảng tuần hoàn các nguyên tố hóa học
- Khi sắp xếp như vậy, sự tuần hoàn tính chất của các đơn chất và hợp chất được thể hiện qua chu kì (hàng) và nhóm (cột).
1.2. Bảng tuần hoàn các nguyên tố hóa học
a. Tìm hiểu về ô nguyên tố
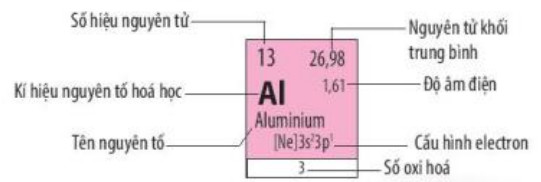
Hình 5.3. Ô nguyên tố aluminium
Trong bảng tuần hoàn, mỗi nguyên tố được xếp vào một ô, gọi là ô nguyên tố, số thứ tự của ô là số hiệu nguyên tử của nguyên tố đó
Mỗi ô nguyên tố chứa các thông tin quan trọng nhất về nguyên tố hóa học. Tùy theo từng loại bảng, các thông tin có thể là số hiệu nguyên tử, kí hiệu nguyên tố, tên nguyên tố, nguyên tử khối trung bình,...
| Mỗi nguyên tố hoá học được xếp vào một ố trong bảng tuần hoàn các nguyên tố hoá học, gọi là ô nguyên tố. Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hoá học trong ô đó. |
|---|
b. Tìm hiểu về chu kì
.jpg)
Hình 5.4. Các nguyên tố thuộc chu kì 2 và chu kì 3
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì. Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì. Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
c. Tìm hiểu về nhóm
Bảng tuần hoàn hiện nay có 18 cột, chia thành 4 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột (Hình 5.2).
Electron hoá trị là những electron có khả năng tham gia hình thành liên kết hoá học. Chúng thường nằm ở lớp ngoài cùng hoặc ở cả phần lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hoà. Những nguyên tố có cùng số electron hoá trị thường có tính chất hoá học tương tự nhau.
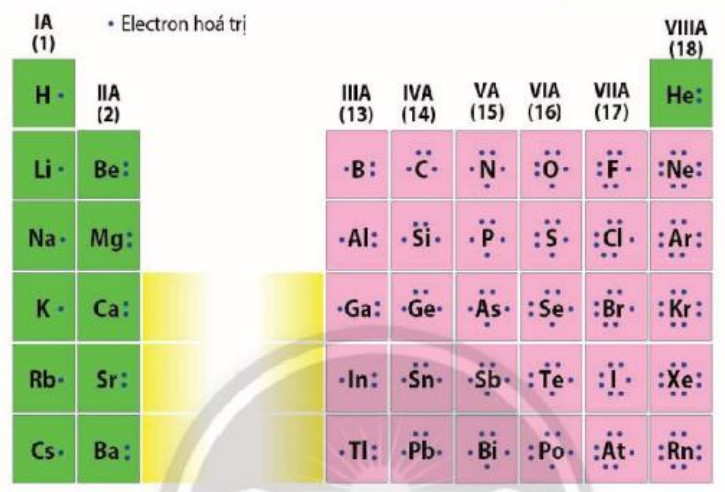
Hình 5.5. Biểu diến electron hóa trị của các nguyên tố nhóm A
|
- Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau (trừ nhóm VIIIB), do đó có tính chất hoá học gần giống nhau và được xếp theo cột. - Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm. |
|---|
d. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hoá học
Các nguyên tố hoá học cũng có thể được chia thành các khối như sau:
- Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA, có cấu hình electron: [Khí hiếm] ns1\( \div \)2
- Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He), có cấu hình electron: [Khí hiếm] ns2np1\( \div \)6
- Khối các nguyên tố d gồm các nguyên tố thuộc nhóm B, có cấu hình electron: [Khí hiếm] (n-1)1\( \div \)10ns1\( \div \)2
- Khối các nguyên tố f gồm các nguyên tố xếp thành hai hàng ở cuối bảng tuần hoàn, có cấu hình electron: [Khí hiếm] (n-2)f0\( \div \)14(n-1)d0\( \div \)2ns2 (trong đó n=6 và n=7). Chúng gồm 14 nguyên tố họ Lanthanide (từ Ce đến Lu) và 14 nguyên tố họ Actinide (từ Th đến Lr).
|
- Dựa vào cấu hình electron, người ta phân loại các nguyên tố thành nguyên tố s, nguyên tố C, nguyên tố d và nguyên tố f. - Dựa vào tính chất hoá học, người ta phân loại các nguyên tố thành nguyên tố kim loại, nguyên tố phi kim và nguyên tố khí hiếm. |
|---|
e. Trình bày nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố hoá học được xếp vào một bảng theo những nguyên tắc nhất định, gọi là bảng tuần hoàn. Bảng tuần hoàn hiện nay gồm 118 nguyên tố hoá học. Vị trí của mỗi nguyên tố hoá học trong bảng tuần hoàn được xác định qua số thứ tự ô nguyên tố, chu kì và nhóm.
- Khi sắp xếp như vậy, sự tuần hoàn tính chất của các đơn chất và hợp chất được thể hiện qua chu kì và nhóm.
|
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn: - Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử. - Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì. - Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp cùng một nhóm, trừ nhóm VIIIB. |
|---|
Bài tập minh họa
Bài 1: Cách đây hàng nghìn năm, người ta chỉ biết đến một số nguyên tố như đồng (copper), bạc (silver) và vàng (gold). Mãi đến năm 1700, cũng chỉ mới có 13 nguyên tố được xác định. Khi đó, các nhà hóa học nghi ngờ rằng vẫn còn nhiều nguyên tố bí ẩn khác chưa được khám phá. Bằng việc sử dụng các phương pháp khoa học hiện đại, chi trong một thập kỉ (1765 – 1775) đã có thêm 5 nguyên tố hóa học được xác định. Trong đó, có 3 khí không màu là hydrogen, nitrogen và oxygen. Tính đến năm 2016, tổng cộng đã có 118 nguyên tố hóa học được xác định trên bảng tuần hoàn các nguyên tố hóa học. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào và có mối liên hệ như thế nào với cấu hình electron nguyên tử của nguyên tố đó?

Hướng dẫn giải
- Nguyên tắc sắp xếp nguyên tố trong bảng tuần hoàn: theo chiều tăng dần số hiệu nguyên tử
- Mối liên hệ giữa cấu hình electron và sự sắp xếp nguyên tố trong bảng tuần hoàn:
+ Sắp xếp theo chiều tăng dần số electron
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng (chu kì)
+ Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên trong nhóm
Bài 2: X và Y là hai nguyên tố kế tiếp nhau trong cùng một nhóm A của bảng tuần hoàn. Biết rằng tổng số electron trong nguyên tử X và Y là 30, số electron của X nhỏ hơn số electron của Y. Phát biểu nào sau đây là sai?
A. X thuộc chu kì nhỏ và Y thuộc chu kì lớn của bảng tuần hoàn.
B. X và Y đều là những kim loại.
C. X và Y đều đứng đầu mỗi chu kì trong bảng tuần hoàn.
D. X và Y đều có cùng số lớp electron bão hòa.
Hướng dẫn giải
Đáp án D
Ta tính được eX = 9 và eY = 19
Cấu hình electron nguyên tử của X: 1s22s22p63s1
Cấu hình electron nguyên tử của Y: 1s22s22p63s23p64s1
X có 2 lớp electron bão hòa, Y có 3 lớp electron bão hòa.
Bài 3: Hợp chất A được tạo thành từ cation X+ và anion Y2-. Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11, tổng số electron trong Y2- là 50. Biết rằng hai nguyên tố trong Y2- đều thuộc cùng một nhóm A và thuộc hai chu kì lien tiếp. Phân tử khối của A là bao nhiêu?
Hướng dẫn giải
Xét ion X+ : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
⇒ Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H.
Ion X+ có dạng AaHb. Vậy a.pA + b = 11 và a + b = 5
|
a |
1 |
2 |
3 |
4 |
|
b |
4 |
3 |
2 |
1 |
|
pA |
7 |
4 |
3 |
2,5 |
Chọn được nghiệm thích hợp a = 1 , b = 4 và pA = 7 ⇒ Ion X+ là NH4+.
Xét ion Y2- có dạng MXLY2-: x.eM + y.eL + 2 = 50
Vậy x.eM + y.eL = 48 và x + y = 5.
Số electron trung bình của các nguyên tử trong Y2- là 9,6
⇒ Có 1 nguyên tử có số electron nhỏ hơn 9,6
⇒ Nguyên tử của nguyên tố thuộc chu kì II.
⇒ Nguyên tử của nguyên tố còn lại thuộc chu kì III.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron
Vậy eM - eL = 8
Ta chọn được nghiệm: eM = 16 và eL = 8 . Ion có dạng SO42- .
Chất A là: Phân tử khối của A là 132.
Luyện tập Bài 5 Hóa 10 CTST
Sau bài học này, học sinh sẽ:
- Nêu được lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoá học.
- Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hoá học và nêu được các khái niệm liên quan (ô, chu kì, nhóm).
- Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hoá học (dựa theo cấu hình electron).
- Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố , p, d, f; dựa theo tính chất hoá học: kim loại, phi kim, khí hiếm).
3.1. Trắc nghiệm Bài 5 Hóa 10 CTST
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Chân trời sáng tạo Bài 5 cực hay có đáp án và lời giải chi tiết.
-
- A. 7
- B. 8
- C. 9
- D. 11
-
- A. 12Mg.
- B. 13Al.
- C. 11Na.
- D. 14Si.
-
- A. 1
- B. 3
- C. 4
- D. 2
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 5 Hóa 10 CTST
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Chân trời sáng tạo Bài 5 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 36 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 2 trang 36 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 3 trang 36 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 4 trang 36 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 5 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập 1 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 6 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập 2 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 7 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 8 trang 38 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 9 trang 39 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 10 trang 39 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 11 trang 39 SGK Hóa học 10 Chân trời sáng tạo - CTST
Luyện tập trang 40 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải câu hỏi 12 trang 40 SGK Hóa học 10 Chân trời sáng tạo - CTST
Vận dụng trang 40 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 1 trang 42 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 2 trang 42 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 3 trang 42 SGK Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.1 trang 19 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.2 trang 19 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.3 trang 19 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.4 trang 20 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.5 trang 20 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.6 trang 20 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.7 trang 20 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.8 trang 20 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.9 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.10 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.11 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.12 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.13 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.14 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Giải bài 5.15 trang 21 SBT Hóa học 10 Chân trời sáng tạo - CTST
Hỏi đáp Bài 5 Hóa học 10 CTST
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





