Lý thuyết Bài 17: Biến thiên Enthalpy trong các phản ứng hóa học lớp 10 do HOC247 biên soạn chuẩn theo chương trình SGK Kết nối tri thức nhằm giúp cho các bạn có thêm tài liệu và giải các bài tập chương Năng lượng một cách hiệu quả nhất. Rất mong rằng các bạn hãy xem nó 1 cách nghiêm túc để cho các bạn có được kinh nghiệm và kiến thức cần nắm nhé. Chúc các bạn thành công!
Tóm tắt lý thuyết
1.1. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
- Khi các phản ứng hoá học xảy ra thường có sự trao đổi nhiệt với môi trường, làm thay đổi nhiệt độ môi trường.
- Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.

Ví dụ:
- Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp lửa để sưởi. Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng toả nhiệt. Những lúc nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn, đó là do xảy ra phản ứng thu nhiệt.
- Khi nung vôi, người ta sử dụng phản ứng đốt cháy than để cung cấp nhiệt cho phản ứng phân huỷ đá vôi. Phản ứng đốt than là phản ứng toả nhiệt, phản ứng phân huỷ đá vôi là phản ứng thu nhiệt.
|
- Phản ứng toả nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ chất phản ứng ra môi trường. - Phản ứng thu nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng. |
|---|
1.2. Biến thiên Enthalpy của phản ứng
a. Biến thiên Enthalpy
- Hầu hết các quá trình hoá học trong thực tế xảy ra ở điều kiện áp suất không đổi.
- Nhiệt lượng toả ra hay thu vào của phản ứng ở điều kiện này gọi là biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là \({\Delta _r}H(*)\)).
- Phương trình hoá học kèm theo trạng thái của các chất và giá trị \({\Delta _r}H\) gọi là phương trình nhiệt hoá học.
Ví dụ 1: Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, toả ra nhiệt lượng 571,6 kJ, Phản ứng trên có biến thiên enthalpy \({\Delta _r}H_{298}^0\) = -571,6 kJ, biểu diễn bằng phương trình nhiệt hoá học như sau:
2H2(g) + O2(g) → 2H2O \({\Delta _r}H_{298}^0\) = -571,6 kJ
Ví dụ 2: Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2 tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phản ứng trên có biến thiên enthalpy \({\Delta _r}H_{298}^0(*)\) = +9,0 kJ và biểu diễn bằng phương trình nhiệt hoá học như sau:
Cu(OH)2 (s) → CuO (s) + H2O (1) \({\Delta _r}H_{298}^0\) = +9,0 kJ
b. Biến thiên Enthalpy chuẩn
- Biến thiên enthalpy của các phản ứng phụ thuộc vào điều kiện xảy ra phản ứng (như nhiệt độ, áp suất) và trạng thái vật lí của các chất. Để so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định chúng ở cùng một điều kiện. Biên thiên enthalpy chuần là nhiệt toả ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25 °C (298 K), kí hiệu \({\Delta _r}H_{298}^0\)
Ví dụ: Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng toả ra là 393,5 kJ. Phương trình nhiệt hoá học của phản ứng được viết như sau:
C (graphite) + O2 (g) → CO2 (g) \({\Delta _r}H_{298}^0\) = -393,5 kJ
c. Ý nghĩa của biến thiên Enthalpy
- Dấu của biến thiên enthalpy cho biết phản ứng toả nhiệt hay thu nhiệt:
\({\Delta _r}H\) > 0 phản ứng thu nhiệt.
\({\Delta _r}H\) < 0: phản ứng toả nhiệt.
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng toả ra hay thu vào của phản ứng càng nhiều.
Ví dụ: Xét 2 phản ứng
CH4 (g) +2O2(g) → CO2 (g) + 2H2O (i) \({\Delta _r}H_{298}^0\) = -890 kJ/mol
CH3OH (l) + 3/2O2 (g) → CO2(g) + 2H2O (l) \({\Delta _r}H_{298}^0\) = -726 kJ/mol
- Vậy, khi đốt 1 mol methane (16 g) toả ra nhiệt lượng nhiều hơn đốt 1 mol methanol (32g).
- Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng toả nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
| Biến thiên Enthalpy của phản ứng là nhiệt lượng toả ra hay thu vào của phản ứng ở một điều kiện xác định. |
|---|
1.3. Tính biến thiên Enthalpy của phản ứng theo nhiệt tạo thành
a. Khái niệm nhiệt tạo thành
- Nhiệt tạo thành (\({\Delta _f}H\))(*) của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
- Nhiệt tạo thành chuẩn (\({\Delta _f}H_{298}^0\)) là nhiệt tạo thành ở điều kiện chuẩn.
- Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng không, ví dụ:
\({\Delta _f}H_{298}^0\) (O2 (g)) = 0 kJ/mol.
Ví dụ 1: Nước lỏng được tạo thành từ khi hydrogen và khí oxygen theo phản ứng: H2 (g) + 1/2O2(g) → H2O (l)
- Ở điều kiện chuẩn, cứ 1 mol H2O (l) tạo thành từ 1 mol H2 (g) và mol 1/2O2 (g) giải phóng nhiệt lượng là 285,8 kJ.
- Như vậy nhiệt tạo thành của nước lỏng: \({\Delta _f}H_{298}^0\) (H2O (l)) = -285,8 kJ/mol.
Ví dụ 2: Phản ứng 1/2N2(g) + 1/2O2(g) → NO(g) có biến thiên enthalpy \({\Delta _f}H_{298}^0\)(NO(g))= +90,3 kJ/mol. Giá trị \({\Delta _f}H_{298}^0\) > 0, tức phản ứng này là phản ứng thu nhiệt.
Bảng 17.1. Nhiệt tạo thành chuẩn của một số chất thường gặp
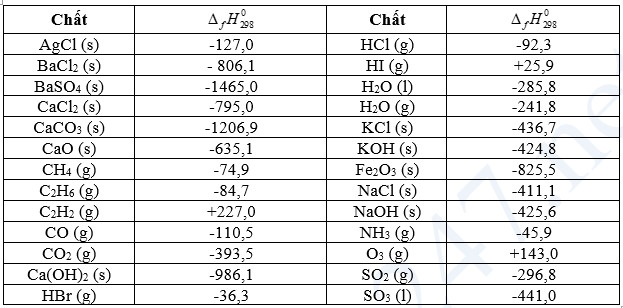
b. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
- Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tồng nhiệt tạo thành các chất sản phẩm (sp) và tồng nhiệt tạo thành của các chất đầu (cd).
- Ở điều kiện chuẩn: \({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp)} - \sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \)
- Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hoá học.
Ví dụ 1: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: SO2(g) + 1/2O2(g) → SO3(l) biết nhiệt tạo thành \({\Delta _f}H_{298}^0\) của SO2(g) là -296,8 kJ/ mol, của SO3 (l) là 2441,0 kJ/mol.
Lời giải:
\({\Delta _r}H_{298}^0\) = \({\Delta _f}H_{298}^0\)(SO3(l) – [\({\Delta _f}H_{298}^0\)(SO2(g) + 1/2\({\Delta _f}H_{298}^0\)(O2)] = -441,0 - (-296,8 +0.1/2) = -144,2 (kJ).
Ví dụ 2: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: 4FeS2(s) + 1O2(g) → 2Fe2O3(s) + 8SO2 (g) biết nhiệt tạo thành \({\Delta _f}H_{298}^0\) của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là -177,9 kJ/mol, -825,5 kJ/mol và -296,8 kJ/mol.
Lời giải: Tổng nhiệt tạo thành các chất đầu là:
\(\sum {{\Delta _f}H_{298}^0(c{\rm{d}})} = {\Delta _f}H_{298}^0\,(Fe{S_2}(s)).4 + {\Delta _f}H_{298}^0({O_2}(g)).11\) = (-177,9) 4+ 0.11 = -711,6 (kJ)
- Tổng nhiệt tạo thành các chất sản phẩm là:
\(\sum {{\Delta _f}H_{298}^0(sp)} = {\Delta _f}H_{298}^0\,(F{e_2}{O_3}(s)).2 + {\Delta _f}H_{298}^0(S{O_2}(g)).8\) = (-825,5) 2 + (-296,8). 8 = 4 025,4 (kJ)
- Vậy, biến thiên enthalpy của phản ứng:
\({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp)} - \sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \) = -4025,4 - (-711,6)= -3 313,8 (kJ)
1.4. Tính biến thiên Enthalpy của phản ứng theo năng lượng liên kết
- Phản ứng hoá học là quá trình phá vỡ các liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm, Sự phá vỡ liên kết cần cung cấp năng lượng, trong khi sự hình thành liên kết lại giải phóng năng lượng. Biên thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bảng hiệu số giữa tông năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
- Ở điều kiện chuẩn: \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd) - } \sum {{E_b}(sp)} \)
Ví dụ 1: Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) → 2HCl(g) biết Eb (H-H) = 436 kJ/mol, Eb (C–C) = 243 kJ/mol, Eb (H–Cl) = 432 kJ/mol.
Lời giải:
- Biến thiên enthalpy chuẩn của phản ứng là: \({\Delta _r}H_{298}^0\) = Eb(H-H) + Eb(Cl-Cl)-2. Eb(H-Cl) = 436 + 243-2.432 = -185 (KJ)
- Phản ứng toả nhiệt vị khi tạo thành 2 liên kết H-Cl toả ra năng lượng lớn hơn năng lượng cần thiết để phá vỡ liên kết H-H và Cl-Cl.
Ví dụ 2: Xác định biến thiên enthalpy chuẩn của phản ứng
C2H4(g) + H2(g) → C2H6 biết năng lượng liên kết (ở điều kiện chuẩn):
| Liên kết | H-H | C-H | C-C | C=C |
| Phân tử | hydrogen | hydrocarbon | alkanel | alkene |
| Eb (kJ/mol) | 436 | 418 | 346 | 612 |
Lời giải
.jpg)
\({\Delta _r}H_{298}^0\) = Eb(C=C) + 4Eb(C-H) + Eb(H-H) - Eb(C-C) - 6Eb(C-H) = 612 + 4.418 + 436 - 346-6.418 = -134 (kJ)
|
- Biểu thức tính biến thiên enthalpy của các phản ứng ở điều kiện chuẩn: + Theo nhiệt tạo thành: \({\Delta _r}H_{298}^0 = \sum {{\Delta _f}H_{298}^0(sp)} - \sum {{\Delta _f}H_{298}^0(c{\rm{d}})} \) + Theo năng lượng liên kết (các chất đều ở thể khí) \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd) - } \sum {{E_b}(sp)} \) |
|---|
Bài tập minh họa
Bài 1: Phản ứng giữa đường glucose với oxygen tạo ra carbon dioxide, hơi nước và tỏa nhiều nhiệt. Sau khi chơi thể thao, cơ thể mệt mỏi, nếu uống một cốc nước hoa quả, em sẽ cảm thấy khỏe hơn. Có phải đường glucose đã “cháy” và cấp bù năng lượng cho cơ thể?
Hướng dẫn giải
Do đường glucose đã phản ứng với oxygen tạo ra carbon dioxide, hơi nước, tỏa nhiều nhiệt và giải phóng được 36 ATP nên đường glucose bù năng lượng cho cơ thể.
Bài 2: Phản ứng tôi vôi tỏa ra nhiệt lượng rất lớn, có thể làm sôi nước. Hãy nêu các biện pháp để đảm bảo an toàn khi thực hiện quá trình tối vôi.
Hướng dẫn giải
Khi thực hiện quá trình tôi vôi trong phòng thí nghiệm cần chú ý một số biện pháp sau để đảm bảo an toàn:
- Mặc đồ bảo hộ như găng tay, kính mắt
- Chọn địa điểm tôi vôi thoáng và rộng rãi, đồ dùng khác để xa khu vực tôi
- Chọn dụng cụ tôi vôi chịu nhiệt do quá trình này tỏa lượng nhiệt lớn có thể làm hỏng dụng cụ.
Bài 3: Cho biết năng lượng liên kết trong các phân tử O2, N2, và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: N2(g) + O2(g) → 2NO(g)
Hướng dẫn giải
\({\Delta _r}H_{298}^o = {\rm{[}}{E_b}\left( {N \equiv N} \right).1 + {E_b}\left( {O = O} \right).1] - {E_b}\left( {NO} \right).2\) = [945.1 + 494.1] – 607.2 = 225 (kJ)
Luyện tập Bài 17 Hóa 10 KNTT
Sau bài học này, học sinh có thể:
- Trình bày được khái niệm phản ứng toả nhiệt, thu nhiệt, điều kiện chuẩn; nhiệt tạo thành và biến thiên enthalpy (nhiệt phản ứng) của phản ứng.
- Nêu được ý nghĩa của dấu và giá trị của biến thiên enthalpy chuẩn.
- Tính được biến thiên enthalpy chuẩn của một số phản ứng theo năng lượng liên kết, nhiệt tạo thành.
3.1. Trắc nghiệm Bài 17 Hóa 10 KNTT
Các em có thể hệ thống lại nội dung kiến thức đã học được thông qua bài kiểm tra Trắc nghiệm Hóa học 10 Kết nối tri thức Bài 17 cực hay có đáp án và lời giải chi tiết.
-
- A. 41,67 kJ.
- B. 42,67 kJ.
- C. 31,67 kJ.
- D. 32,67 kJ.
-
- A. -1323 kJ.mol-1
- B. -1428,4 kJ.mol-1
- C. -283 kJ.mol-1
- D. -563 kJ.mol-1
-
- A. 124,7 kJ
- B. 2804,7 kJ
- C. 1604,7 kJ
- D. 694,7 kJ
Câu 4-10: Mời các em đăng nhập xem tiếp nội dung và thi thử Online để củng cố kiến thức về bài học này nhé!
3.2. Bài tập SGK Bài 17 Hóa 10 KNTT
Các em có thể xem thêm phần hướng dẫn Giải bài tập Hóa học 10 Kết nối tri thức Bài 17 để giúp các em nắm vững bài học và các phương pháp giải bài tập.
Giải câu hỏi 1 trang 81 SGK Hóa học 10 Kết nối tri thức - KNTT
Hoạt động trang 82 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 84 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 7 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 8 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.1 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.2 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.3 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.4 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.5 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.6 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.7 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.8 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.9 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.10 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.11 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.12 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.13 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.14 trang 48 SBT Hóa học 10 Kết nối tri thức - KNTT
Hỏi đáp Bài 17 Hóa học 10 KNTT
Trong quá trình học tập nếu có thắc mắc hay cần trợ giúp gì thì các em hãy comment ở mục Hỏi đáp, Cộng đồng Hóa học HOC247 sẽ hỗ trợ cho các em một cách nhanh chóng!
Chúc các em học tập tốt và luôn đạt thành tích cao trong học tập!





