Hoạt động trang 82 SGK Hóa học 10 Kết nối tri thức
Theo dõi sự thay đổi nhiệt độ của phản ứng trung hòa
Chuẩn bị: dung dịch HCl 0,5 m, dung dịch NaOH 0,5 M, 1 cốc 150 mL, giá treo nhiệt kế, nhiệt kế (có dải đo đến 1000C), que khuấy và 2 ống đong 100 ml.
Tiến hành:
- Dùng ống đong lấy 50 mL dung dịch HCl 0,5 M cho vào cốc phản ứng, lắp nhiệt kế lên giá sao cho đầu nhiệt kế nhúng vào dung dịch trong cốc (Hình 17.1). Đọc nhiệt độ dung dịch.
- Dùng ống đong khác lấy 50 mL dung dịch NaOH 0,5M cho vào cốc phản ứng. Khuấy nhẹ.
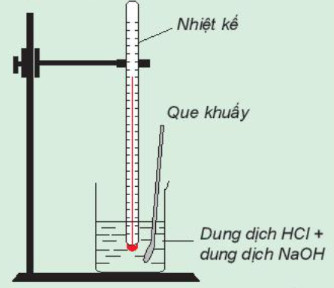
Theo dõi sự thay đổi nhiệt độ của dung dịch và trả lời câu hỏi:
1. Nhiệt độ trên nhiệt kế thay đổi như thế nào sau khi rót dung dịch NaOH vào cốc?
Phản ứng trung hòa là tỏa nhiệt hay thu nhiệt?
2. Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ thay đổi như thế nào so với thí nghiệm trên?
Hướng dẫn giải chi tiết Hoạt động trang 82
Hướng dẫn giải
Thực hiện theo các bước và quan sát sự thay đổi về nhiệt độ:
+ Nhiệt độ tăng: phản ứng tỏa nhiệt
+ Nhiệt độ giảm: phản ứng thu nhiệt
Lời giải chi tiết
1. Phản ứng hóa học: NaOH + HCl → NaCl + H2O
Nhiệt độ đo được (HCl) lúc ban đầu thấp hơn so với nhiệt độ sau phản ứng
→ Phản ứng trung hòa là phản ứng tỏa nhiệt
2. Trong thí nghiệm trên, nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ sau phản ứng vẫn tăng nhưng tăng ít hơn so với thí nghiệm trên.
-- Mod Hóa Học 10 HỌC247
Bài tập SGK khác
Giải câu hỏi 1 trang 81 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 2 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 3 trang 83 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 4 trang 84 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 5 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 6 trang 86 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 7 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải câu hỏi 8 trang 88 SGK Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.1 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.2 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.3 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.4 trang 45 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.5 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.6 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.7 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.8 trang 46 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.9 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.10 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.11 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.12 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.13 trang 47 SBT Hóa học 10 Kết nối tri thức - KNTT
Giải bài 17.14 trang 48 SBT Hóa học 10 Kết nối tri thức - KNTT
-


Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng được biểu diễn như sau 2H2(g) + O2(g) → 2H2O(l)
bởi Ngoc Son
 25/10/2022
25/10/2022
Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng được biểu diễn như sau:
2H2(g) + O2(g) → 2H2O(l) \({\Delta _r}H_{298}^0 = - 571,6kJ\)
Nhận xét nào sau đây là đúng?
A. Phản ứng trên tỏa ra nhiệt lượng là 571,6 kJ.
B. Phản ứng trên thu vào nhiệt lượng là 571,6 kJ.
C. Phản ứng trên cần cung cấp một nhiệt lượng là 571,6 kJ để phản ứng xảy ra.
D. Năng lượng của phản ứng là 571,6 kJ.
Theo dõi (0) 1 Trả lời





